18-elektronové pravidlo - 18-electron rule
Pravidlo 18 elektronů je chemické pravidlo, které se používá především k predikci a racionalizaci vzorců stabilních komplexů přechodných kovů , zejména organokovových sloučenin . Pravidlo je založeno na skutečnosti, že valenční orbitaly přechodných kovů se skládají z pěti d orbitalů , jednoho orbitálu a tří p orbitalů, které mohou společně pojmout 18 elektronů buď jako vazebné nebo nevázané elektronové páry. To znamená, že kombinace těchto devíti atomových orbitalů s orbitaly ligandu vytvoří devět molekulárních orbitalů, které jsou buď vazbou kov-ligand nebo ne-vazbou. Když má kovový komplex 18 valenčních elektronů, říká se, že dosáhl stejné elektronové konfigurace jako vzácný plyn v daném období. Pravidlo není užitečné pro komplexy kovů, které nejsou přechodnými kovy, a zajímavé nebo užitečné komplexy přechodných kovů toto pravidlo poruší kvůli důsledkům odchylujícím se od pravidla, které má reaktivita. Toto pravidlo bylo poprvé navrženo americkým chemikem Irvingem Langmuirem v roce 1921.
Použitelnost
Pravidlo užitečně předpovídá vzorce pro nízkootáčkové komplexy triád Cr, Mn, Fe a Co. Známé příklady zahrnují ferrocen , pentakarbonyl železa , karbonyl chrómu a nikl karbonyl .
Ligandy v komplexu určují použitelnost 18-elektronového pravidla. Obecně platí, že komplexy, které se řídí pravidlem, jsou složeny alespoň částečně z π-akceptorových ligandů (také známých jako π-kyseliny). Tento druh ligandu vyvíjí velmi silné ligandové pole , které snižuje energie výsledných molekulárních orbitalů, takže jsou příznivě obsazeny. Typické ligandy zahrnují olefiny , fosfiny a CO . Komplexy π-kyselin typicky obsahují kov v nízkooxidačním stavu. Vztah mezi oxidačním stavem a povahou ligandů je racionalizován v rámci zpětného vazby π .
Důsledky pro reaktivitu
Sloučeniny, které se řídí pravidlem 18 elektronů, jsou typicky „inertní vůči výměně“. Příklady zahrnují [Co (NH 3 ) 6 ] Cl 3 , Mo (CO) 6 , a [Fe (CN) 6 ] 4 . V takových případech obecně dochází k výměně ligandu prostřednictvím disociačních substitučních mechanismů, přičemž rychlost reakce je určena rychlostí disociace ligandu. Na druhou stranu, 18-elektronové sloučeniny mohou být vysoce reaktivní vůči elektrofilům, jako jsou protony, a takové reakce jsou asociativní v mechanismu, což jsou acidobazické reakce.
Komplexy s méně než 18 valenčními elektrony mají tendenci vykazovat zvýšenou reaktivitu. Pravidlo 18 elektronů je tedy často receptem na nereaktivitu ve stechiometrickém nebo katalytickém smyslu.
Duodectetovo pravidlo
Výpočtová zjištění naznačují, že valenční p-orbitaly na kovu se účastní vazby kov-ligand, i když slabě. Weinhold a Landis však v kontextu orbitálů s přirozenými vazbami nepočítají p-orbitaly kovů ve vazbě kov-ligand, ačkoli tyto orbitaly jsou stále zahrnuty jako polarizační funkce . Výsledkem je pravidlo duodectet (12 elektronů) pouze pro pět d-orbitalů a jeden s-orbitál.
Současná shoda v komunitě obecné chemie spočívá v tom, že na rozdíl od pravidla singulárního oktetu pro prvky hlavní skupiny přechodné kovy striktně nedodržují pravidlo 12 elektronů nebo 18 elektronů, ale že pravidla popisují dolní a horní hranici valence počet elektronů. Zatímco se tedy snadno vyskytují d-orbitální a s-orbitální vazby přechodného kovu, zapojení vyšší energie a prostorově difúznějších p-orbitalů do vazby závisí na centrálním atomu a koordinačním prostředí.
Výjimky
π-donorové nebo σ-donorové ligandy s malými interakcemi s kovovými orbitaly vedou ke slabému poli ligandu, které zvyšuje energie t 2g orbitalů. Tyto molekulární orbitaly se stanou nevázacími nebo slabě anti-vazebnými orbitaly (malý Δ okt ). Přidání nebo odstranění elektronu má proto malý vliv na stabilitu komplexu. V tomto případě neexistuje žádné omezení počtu d-elektronů a jsou možné komplexy s 12–22 elektrony. Malý Δ okt umožňuje plnění eg * (> 18 e - ) a π-donorové ligandy mohou zajistit t 2g antibonding (<18 e - ). Tyto typy ligandů se nacházejí ve spodní až střední části spektrochemické řady. Například: [TiF 6 ] 2- (Ti (IV), d 0 , 12 e - ), [Co (NH 3 ) 6 ] 3+ (Co (III), d 6 , 18 e - ), [Cu ( OH 2 ) 6 ] 2+ (Cu (II), d 9 , 21 e - ).
Pokud jde o kovové ionty, Δ okt se zvyšuje o skupinu i se zvyšujícím se oxidačním číslem . Silná ligandová pole vedou k nízkootáčkovým komplexům, které způsobují určité výjimky z pravidla 18 elektronů.
16-elektronové komplexy
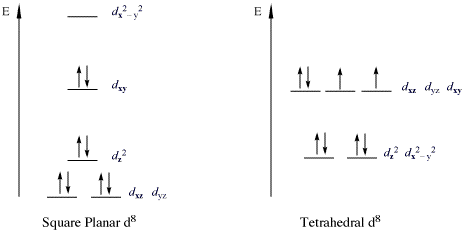
Důležitou třídou komplexů, které porušují pravidlo 18e jsou 16-elektronové komplexy s kovy d 8 konfigurací. Všechny vysokootáčkové d 8 kovové ionty jsou oktaedrické (nebo čtyřboká ), ale nízkootáčkové d 8 kovové ionty jsou všechny čtvercové rovinné. Důležité příklady čtvercově planárních nízkootáčkových d 8 kovových iontů jsou Rh (I), Ir (I), Ni (II), Pd (II) a Pt (II). Na následujícím obrázku je znázorněno rozdělení d subshellu v nízkootáčkových čtvercovo-planárních komplexech. Příklady převládají zejména pro deriváty triády kobaltu a niklu. Takové sloučeniny jsou obvykle čtvercové-planární . Nejznámějším příkladem je Váška je komplex (IrCl (CO) (PPh 3 ) 2 ), [PtCI 4 ] 2 , a zeiseho sůl [PtCl 3 ( η 2 -C 2 H 4 )] - . V takových komplexech je orbitál d z 2 dvojnásobně obsazený a nevázaný.
Mnoho katalytických cyklů pracuje prostřednictvím komplexů, které se střídají mezi 18-elektronovou a čtvercovou planární 16-elektronovou konfigurací. Mezi příklady patří syntéza kyseliny Monsantooctové , hydrogenace , hydroformylace , izomerizace olefinů a některé polymerace alkenů.
Jiná porušení lze klasifikovat podle druhů ligandů na kovovém středu.
Objemné ligandy
Objemné ligandy mohou vyloučit přístup úplného doplňku ligandů, který by umožnil kovu dosáhnout 18 elektronové konfigurace. Příklady:
- Ti ( neopentyl ) 4 (8 e - )
- Cp * 2 Ti (C 2 H 4 ) (16 e - )
- V (CO) 6 (17 e - )
- Cp * Cr (CO) 3 (17 e - )
- Pt (P t Bu 3 ) 2 (14 e - )
- Co ( norbornyl ) 4 (13 e - )
- [FeCp 2 ] + (17 e - )
Někdy se tyto komplexy zapojují do agostických interakcí s uhlovodíkovou strukturou objemného ligandu. Například:
- W (CO) 3 [P (C 6 H 11 ) 3 ] 2 má 16 e - , ale má krátký spojovací kontakt mezi jedním C-H vazby a W centra.
- Cp (PMe 3 ) V (CHCMe 3 ) (14 e - , diamagnetický) má krátkou vazbu V – H s „alkyliden-H“, takže popis sloučeniny je někde mezi Cp (PMe 3 ) V (CHCMe 3 ) a Cp (PMe 3 ) V (H) (CCMe 3 ).
Komplexy s vysokou rotací
Komplexy kovů s vysokou rotací mají jednotlivě obsazené orbitaly a nemusí mít žádné prázdné orbitaly, do kterých by ligandy mohly darovat elektronovou hustotu. Obecně je v komplexu málo nebo žádné π-kyselé ligandy. Tyto jednotlivě obsazené orbitaly se mohou kombinovat s jednotlivě obsazenými orbitaly radikálních ligandů (např. Kyslíku ), nebo přidání ligandu se silným polem může způsobit párování elektronů, čímž se vytvoří prázdný orbitál, do kterého může darovat. Příklady:
- CrCl 3 ( THF ) 3 (15 e - )
- [Mn (H 2 O) 6 ] 2+ (17 e - )
- [Cu (H 2 O) 6 ] 2+ (21 e - , viz komentáře níže)
Komplexy obsahující ligandy se silným π často porušují pravidlo 18 elektronů. Tyto ligandy zahrnují fluorid (F - ), oxid (O 2 - ), nitrid (N 3 - ), alkoxidy (RO - ) a imidy (RN 2 - ). Příklady:
- [CrO 4 ] 2− (16 e - )
- Mo (= NR) 2 Cl 2 (12 e - )
V posledně uvedeném případě dochází k podstatnému darování dusíkových osamocených párů Mo (takže sloučeninu lze také popsat jako 16 e - sloučeninu). To je patrné z krátké délky vazby Mo – N a z úhlu Mo – N – C (R), který je téměř 180 °. Protiklady:
- trans- WO 2 (Me 2 PCH 2 CH 2 PMe 2 ) 2 (18 e - )
- Cp * ReO 3 (18 e - )
V těchto případech jsou vazby M = O „čisté“ dvojné vazby (tj. Žádné darování osamělých párů kyslíku na kov), což se odráží v relativně velkých vzdálenostech vazeb.
ligandy darující π
Ligandy, kde koordinační atom nese nevázané osamělé páry, často stabilizují nenasycené komplexy. Amidy a alkoxidy kovů často porušují pravidlo 18e
Kombinace efektů
Výše uvedené faktory se někdy mohou kombinovat. Mezi příklady patří
- Cp * VOCl 2 (14 e - )
- TiCl 4 (8 e - )
Vyšší počty elektronů
Některé komplexy mají více než 18 elektronů. Příklady:
- Kobaltocen (19 e - )
- Nickelocen (20 e - )
- Ion hexakvakopropy (II) [Cu (H 2 O) 6 ] 2+ (21 e - )
- TM (CO) 8 - ( TM = Sc, Y, La) (20 e - )
Často případy, kdy komplexy mají více než 18 valenčních elektronů, se připisují elektrostatickým silám - kov přitahuje ligandy k sobě, aby se pokusil vyvážit svůj kladný náboj, a počet elektronů, které končí, je nedůležitý. V případě metalocenů stabilizuje chelatační povaha cyklopentadienylového ligandu jeho vazbu na kov. Poněkud uspokojivá jsou následující dvě pozorování: kobaltocen je silný donor elektronů a snadno tvoří 18-elektronový kobaltoceniový kation; a nickelocene tendenci reagovat se substráty, čímž se získá 18-elektronové komplexy, např CpNiCl (PR 3 ) a volný CPH.
V případě nikelocenu jsou další dva elektrony na orbitálech, které jsou slabě protichytné na kov-uhlík; proto se často účastní reakcí, při kterých jsou přerušeny vazby M – C a počet elektronů v kovu se změní na 18.
20-elektronové systémy TM (CO) 8 - (TM = Sc, Y, La) mají krychlový ( O h ) rovnováha geometrie a singletový ( 1 1 g ) elektronické základní stav. Existuje jedna obsazená valence MO se symetrií 2u , která je tvořena pouze ligandovými orbitaly bez příspěvku kovových AO. Ale adukty TM (CO) 8 - (TM = Sc, Y, La) splňují 18-elektronové pravidlo, když vezmeme v úvahu pouze ty valenční elektrony, které zaujímají orbitály vázající kov-ligand.
Viz také
Reference
Další čtení
- Tolman, CA (1972). "Pravidlo 16 a 18 elektronů v organokovové chemii a homogenní katalýze". Chem. Soc. Rev. 1 (3): 337 doi : 10,1039 / CS9720100337 .