Alkohol - Alcohol

V chemii , alkohol je organická sloučenina, která nese alespoň jednu hydroxylovou funkční skupinu (-OH), navázaný na nasyceném uhlíku atomu. Termín alkohol původně označoval primární alkohol ethanol (ethylalkohol), který se používá jako droga a je hlavním alkoholem přítomným v alkoholických nápojích . Důležitou třídou alkoholů, z nichž methanol a ethanol jsou nejjednoduššími členy, zahrnuje všechny sloučeniny, pro které je obecný vzorec je C n H 2n + 1 OH. Jednoduché monoalkoholy, které jsou předmětem tohoto článku zahrnuje primární (RCH 2 OH), sekundární (R 2 CHOH) a terciární (R 3 COH) alkoholy.
Přípona -ol se objevuje v chemickém názvu IUPAC všech látek, kde funkční skupinou s nejvyšší prioritou je hydroxylová skupina. Pokud je ve sloučenině přítomna skupina s vyšší prioritou, použije se v názvu IUPAC předpona hydroxy- . Přípona -ol v názvech jiných než IUPAC (například paracetamol nebo cholesterol ) také obvykle naznačuje, že látkou je alkohol. Mnoho látek, které obsahují hydroxylové funkční skupiny (zejména cukry, jako je glukóza a sacharóza ) má názvy, které neobsahují ani příponu -ol , ani předponu hydroxy- .
Dějiny
Hořlavost výdechů vína znali již starověcí přírodní filozofové jako Aristoteles ( 384–322 př. N. L. ), Theophrastus (asi 371–287 př. N. L.) A Plinius starší (23/24–79 n. L.). To však okamžitě nevedlo k izolaci alkoholu, a to i navzdory vývoji pokročilejších destilačních technik v římském Egyptě druhého a třetího století . Důležitým poznatkem , který byl poprvé nalezen v jednom ze spisů připisovaných Jābirovi ibn Ḥayyānovi (deváté století n. L. ), Bylo to, že přidáním soli do vroucího vína, což zvyšuje relativní těkavost vína , může být zvýšena hořlavost výsledných par. Destilace vína je doložena v arabských dílech připisovaných al-Kindī (c. 801–873 CE) a al-Fārābī (asi 872–950) a v 28. knize al-Zahrāwī (latinsky: Abulcasis , 936–1013) Kitāb al-Taṣrīf (později přeloženo do latiny jako Liber servatoris ). Ve dvanáctém století se v řadě latinských děl začaly objevovat recepty na výrobu aqua ardens („hořící voda“, tj. Alkohol) destilací vína se solí, a na konci třináctého století se stal široce rozšířeným známá látka mezi západoevropskými chemiky. Jeho léčivé vlastnosti zkoumali Arnald z Villanova (1240–1311 n. L.) A Jan z Rupescissy (asi 1310–1366), druhý z nich jej považoval za látku chránící život, schopnou zabránit všem chorobám ( aqua vitae nebo „ voda života “, nazývaný také Janem kvintesencí vína).
Nomenklatura
Etymologie
Slovo „alkohol“ pochází z arabského kohl ( arabsky : الكحل , romanized : al-kuḥl ), prášku používaného jako oční linka . Al- je arabský určitý člen , což odpovídá v angličtině. Alkohol byl původně použit pro velmi jemný prášek vyrobený sublimací přírodního minerálu stibnite za vzniku trisulfidu antimonu Sb
2S
3. Byla považována za esenci nebo „ducha“ tohoto minerálu. Používal se jako antiseptikum , oční linka a kosmetika . Význam alkoholu byl rozšířen na destilované látky obecně a poté se zúžil na ethanol, kdy „lihoviny“ byly synonymem pro tvrdý alkohol .
Bartholomew Traheron ve svém překladu Jana z Vigo z roku 1543 uvádí slovo jako termín používaný „barbarskými“ autory pro „jemný prášek“. Vigo napsal: „barbarští auktoři používají alkohol, nebo (jak to považuji za něco, co zesiluje) alkohol, pro nejjemnější poudre“.
Lexicon Chymicum z roku 1657 od Williama Johnsona glosuje slovo jako „antimonium sive stibium“. V širším slova smyslu se začalo mluvit o jakékoli tekutině získané destilací, včetně „alkoholu vína“, destilované esence vína. Libavius v Alchymii (1594) označuje „vini alkohol vel vinum alcalisatum“. Johnson (1657) glosuje alkohol vini jako „quando omnis superfluitas vini a vino separatur, ita ut accensum ardeat donec totum Consaturatur, nihilque fæcum aut phlegmatis in fundo remaneat“. V 18. století se význam slova omezil na „duch vína“ (chemická látka dnes známá jako ethanol ) a po roce 1850 byla rozšířena na třídu látek takzvaných „alkoholů“ v moderní chemii.
Termín ethanol byl vynalezen v roce 1892, mísením „ ethanu “ s „-ol“ zakončením „alkoholu“, který byl zobecněn jako libfix .
Systematická jména
Nomenklatura IUPAC se používá ve vědeckých publikacích a tam, kde je důležitá přesná identifikace látky, zejména v případech, kdy relativní složitost molekuly nevytváří tak systematický název. Při pojmenovávání jednoduchých alkoholů ztrácí název alkanového řetězce koncovku e a přidává příponu -ol , např . Jako v „ethanolu“ z názvu alkanového řetězce „ethan“. V případě potřeby je poloha hydroxylové skupiny indikována číslem mezi alkanovým názvem a -ol : propan-1-olem pro CH
3CH
2CH
2OH , propan-2-ol pro CH
3CH (OH) CH
3. Pokud je přítomna skupina s vyšší prioritou (jako je aldehyd , keton nebo karboxylová kyselina ), pak se použije předpona hydroxy- , např. Jako v 1-hydroxy-2-propanonu ( CH
3C (O) CH
2OH ).
V případech, kdy se funkční skupina OH vázány k sp 2 uhlíkem na aromatickém kruhu je molekula známá jako fenol , a je pojmenován podle pravidel IUPAC pro pojmenování fenoly.
Společné názvy
V jiných méně formálních kontextech, alkohol je často nazýván s názvem odpovídající alkylovou skupinu následuje slovo „alkohol“, například, methyl alkohol, ethyl alkoholu. Propylalkoholem může být n -propylalkohol nebo isopropylalkohol , v závislosti na tom, zda je hydroxylová skupina vázána na koncovém nebo středním uhlíku na přímém propanovém řetězci. Jak je popsáno pod systematickým pojmenováním, pokud má přednost jiná skupina na molekule, alkoholová část je často indikována pomocí předpony „hydroxy-“.
Alkoholy jsou poté rozděleny na primární, sekundární ( sek- , s- ) a terciární ( terc.- , t- ) podle počtu atomů uhlíku spojených s atomem uhlíku, který nese hydroxylovou funkční skupinu . (Příslušné číselné shorthands 1 °, 2 ° a 3 ° jsou také někdy používány v neformálním prostředí.) Primární alkoholy mají obecné vzorce RCH 2 OH. Nejjednodušší primární alkohol je methanol (CH 3 OH), ve kterém R = H, a další je ethanol, ve kterém R = CH 3 je methylová skupina . Sekundární alkoholy jsou ty, které ve tvaru RR'CHOH, z nichž nejjednodušší je 2-propanol (R = R '= CH 3 ). Pro terciárními alkoholy obecný tvar je RR'R "COH. Nejjednodušším příkladem je terc-butanol (2-methylpropan-2-ol), pro které každý z R, R‘, a R" je CH 3 . V těchto zkratkách R, R 'a R "představují substituenty , alkylové nebo jiné připojené, obecně organické skupiny.
V archaické nomenklatuře lze alkoholy pojmenovat jako deriváty methanolu s použitím „-karbinolu“ jako konce. Například, (CH 3 ) 3 COH může být jmenován trimethylcarbinol.
| Typ | Vzorec | Název IUPAC | Běžné jméno |
|---|---|---|---|
|
Jednosytné alkoholy |
CH 3 OH | Methanol | Alkohol ze dřeva |
| C 2 H 5 OH | Ethanol | Alkohol | |
| C 3 H 7 OH | Propan-2-ol | Isopropylalkohol, třecí alkohol |
|
| C 4 H 9 OH | Butan-1-ol | Butanol, butylalkohol |
|
| C 5 H 11 OH | Pentan-1-ol | Pentanol, amylalkohol |
|
| C 16 H 33 OH | Hexadecan-1-ol | Cetyl alkohol | |
|
Vícesytné alkoholy |
C 2 H 4 (OH) 2 | Ethan-1,2-diol | Ethylenglykol |
| C 3 H 6 (OH) 2 | Propan-1,2-diol | Propylenglykol | |
| C 3 H 5 (OH) 3 | Propan-1,2,3-triol | Glycerol | |
| C 4 H 6 (OH) 4 | Butan-1,2,3,4-tetraol |
Erythritol , Threitol |
|
| C 5 H 7 (OH) 5 | Pentan-1,2,3,4,5-pentol | Xylitol | |
| C 6 H 8 (OH) 6 | hexan-1,2,3,4,5,6-hexol |
Mannitol , Sorbitol |
|
| C 7 H 9 (OH) 7 | Heptan-1,2,3,4,5,6,7-heptol | Volemitol | |
|
Nenasycené alifatické alkoholy |
C 3 H 5 OH | Prop-2-en-1-ol | Allylalkohol |
| C 10 H 17 OH | 3,7-Dimethylocta-2,6-dien-1-ol | Geraniol | |
| C 3 H 3 OH | Prop-2-yn-1-ol | Propargylalkohol | |
|
Alicyklické alkoholy |
C 6 H 6 (OH) 6 | Cyklohexan-1,2,3,4,5,6-hexol | Inositol |
| C 10 H 19 OH | 5-Methyl-2- (propan-2-yl) cyklohexan-1-ol | Mentol |
Aplikace

Alkoholy mají dlouhou historii nesčetných použití. Pro jednoduché monoalkoholy, na které se tento článek zaměřuje, jsou nejdůležitější průmyslové alkoholy následující:
- methanol, hlavně pro výrobu formaldehydu a jako přísada do paliva
- ethanol, zejména pro alkoholické nápoje, aditiva do paliv, rozpouštědla
- 1-propanol, 1-butanol a isobutylalkohol pro použití jako rozpouštědlo a prekurzor rozpouštědel
- Alkoholy C6 – C11 používané pro změkčovadla , např. V polyvinylchloridu
- mastný alkohol (C12 – C18), prekurzory detergentů
Metanol je nejběžnějším průmyslovým alkoholem, v roce 1980 se ho vyrábí asi 12 milionů tun/rok. Kombinovaná kapacita ostatních alkoholů je přibližně stejná, distribuovaná zhruba stejně.
Toxicita
Pokud jde o akutní toxicitu, jednoduché alkoholy mají nízkou akutní toxicitu. Dávky několika mililitrů jsou tolerovány. Pro pentanoly , hexanoly , oktanoly a delší alkoholů, LD 50 v rozmezí od 2-5 g / kg (potkani, orální). Methanol a ethanol jsou méně akutně toxické. Všechny alkoholy mírně dráždí pokožku.
Metabolismus methanolu (a ethylenglykolu) je ovlivněn přítomností ethanolu, který má vyšší afinitu k jaterní alkoholové dehydrogenáze . Tímto způsobem bude methanol vyloučen neporušený močí.
Fyzikální vlastnosti
Hydroxylová skupina obecně činí alkoholy polárními . Tyto skupiny mohou tvořit vodíkové vazby mezi sebou navzájem a s většinou ostatních sloučenin. Díky přítomnosti polárních OH jsou alkoholy rozpustnější ve vodě než jednoduché uhlovodíky. Methanol, ethanol a propanol jsou ve vodě mísitelné . Butanol se čtyřmi uhlíkovými řetězci je středně rozpustný.
Kvůli vodíkovým můstkům mívají alkoholy vyšší teploty varu než srovnatelné uhlovodíky a ethery . Teplota varu ethanolu alkoholu je 78,29 ° C, ve srovnání s 69 ° C pro uhlovodíkový hexan a 34,6 ° C pro diethylether .
Výskyt v přírodě
Jednoduché alkoholy se v přírodě nacházejí široce. Ethanol je nejvýznamnější, protože je produktem fermentace, hlavní cesty výroby energie. Ostatní jednoduché alkoholy se tvoří pouze ve stopových množstvích. Složitější alkoholy jsou však všudypřítomné, což se projevuje v cukrech, některých aminokyselinách a mastných kyselinách.
Výroba
Zieglerovy a oxo procesy
V Zieglerově procesu se lineární alkoholy vyrábějí z ethylenu a triethylaluminia, po nichž následuje oxidace a hydrolýza. Je ukázána idealizovaná syntéza 1-oktanolu :
- Al (C 2 H 5 ) 3 + 9 C 2 H 4 → Al (C 8 H 17 ) 3
- Al (C 8 H 17 ) 3 + 3 O + 3 H 2 O → 3 HOC 8 H 17 + Al (OH) 3
Tento proces generuje řadu alkoholů, které jsou odděleny destilací .
Hydroformylací alkenů s následnou hydrogenací vzniká mnoho vyšších alkoholů . Při aplikaci na koncový alken, jak je běžné, obvykle získáme lineární alkohol:
- RCH = CH 2 + H 2 + CO → RCH 2 CH 2 CHO
- RCH 2 CH 2 CHO + 3 H 2 → RCH 2 CH 2 CH 2 OH
Takové způsoby poskytují mastné alkoholy , které jsou užitečné pro detergenty.
Hydratační reakce
Některé nízkomolekulární alkoholy průmyslového významu se vyrábějí přidáním vody k alkenům. Ethanol, isopropanol, 2-butanol a terc-butanol se vyrábějí touto obecnou metodou. Jsou použity dvě implementace, přímé a nepřímé metody. Přímá metoda zabraňuje tvorbě stabilních meziproduktů, obvykle za použití kyselých katalyzátorů. Při nepřímé metodě se alken převede na ester sulfátu , který se následně hydrolyzuje. Přímá hydratace pomocí ethylenu ( hydratace ethylenu ) nebo jiných alkenů z krakování frakcí destilované ropy .
Hydratace se také průmyslově používá k výrobě diol ethylenglykolu z ethylenoxidu .
Biologické cesty
Ethanol se získá fermentací za použití glukózy vyrobené z cukru od hydrolýzy ze škrobu , za přítomnosti kvasinek a teplotě nižší než 37 ° C za vzniku ethanolu. Takový proces může například probíhat přeměnou sacharózy enzymem invertázou na glukózu a fruktózu , poté přeměnou glukózy enzymatickou komplexní zymázou na ethanol a oxid uhličitý.
Několik druhů benigních bakterií ve střevě používá kvašení jako formu anaerobního metabolismu . Tato metabolická reakce produkuje ethanol jako odpadní produkt. Lidská těla tedy obsahují určité množství alkoholu endogenně produkovaného těmito bakteriemi. Ve vzácných případech to může stačit ke vzniku „ syndromu auto-pivovaru “, při kterém se produkuje opojné množství alkoholu.
Butanol lze podobně jako ethanol vyrábět fermentačními procesy. Je známo, že kvasinky Saccharomyces produkují tyto vyšší alkoholy při teplotách nad 24 ° C. Bakterie Clostridium acetobutylicum se může živit celulózou a produkovat butanol v průmyslovém měřítku.
Střídání
Primární alkylhalogenidy reagují s vodným NaOH nebo KOH hlavně na primární alkoholy v nukleofilní alifatické substituci . (Sekundární a zejména terciární alkylhalogenidy poskytnou místo toho eliminační (alkenový) produkt). Grignardova činidla reagují s karbonylovými skupinami na sekundární a terciární alkoholy. Související reakce jsou Barbierova reakce a Nozaki-Hiyamova reakce .
Snížení
Aldehydy nebo ketony jsou sníženy s tetrahydroboritanem sodným nebo lithiumaluminiumhydridem (po okyselení reakční směsi). Další redukcí aluminiumizopropyláty je redukce Meerwein-Ponndorf-Verley . Noyori asymetrická hydrogenace je asymetrická redukce beta-keto-esterů.
Hydrolýza
Alkeny se zapojují do kyselinou katalyzované hydratační reakce s použitím koncentrované kyseliny sírové jako katalyzátoru, který obvykle poskytuje sekundární nebo terciární alkoholy. Hydroborace-oxidace a oxymerkurační-redukce alkenů jsou spolehlivější v organické syntéze. Alkeny reagují s NBS a vodou při reakci tvorby halohydrinu . Aminy lze převést na diazoniové soli , které se poté hydrolyzují.
Je ukázán vznik sekundárního alkoholu redukcí a hydratací:
Reakce
Deprotonace
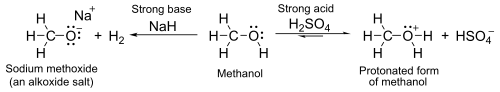
S pK A kolem 16-19 oni jsou obecně lehce slabší kyseliny než voda . Se silnými bázemi, jako je hydrid sodný nebo sodík , tvoří soli zvané alkoxidy , obecného vzorce R O - M + .
- 2 R-OH + 2 NaH → 2 RO - Na + + 2 H 2
- 2 R-OH + 2 Na → 2 RO - Na + + H 2
Kyselost alkoholů je silně ovlivněna solvatací . V plynné fázi jsou alkoholy kyselejší než ve vodě.
Nukleofilní substituce
Skupina OH není dobrou odstupující skupinou v nukleofilních substitučních reakcích, takže neutrální alkoholy při takových reakcích nereagují. Pokud je však kyslík nejprve protonován za vzniku R -OH 2 + , odstupující skupina ( voda ) je mnohem stabilnější a může dojít k nukleofilní substituci. Například terciární alkoholy reagují s kyselinou chlorovodíkovou za vzniku terciárních alkylhalogenidů , kde je hydroxylová skupina nahrazena atomem chloru unimolekulární nukleofilní substitucí . Pokud mají primární nebo sekundární alkoholy reagovat s kyselinou chlorovodíkovou , je zapotřebí aktivátor, jako je chlorid zinečnatý . Alternativně lze konverzi provést přímo pomocí thionylchloridu . [1]
Alkoholy mohou být rovněž převedeny na alkylbromidy pomocí kyseliny bromovodíkové nebo bromidu fosforitého , například:
- 3 R-OH + PBr 3 → 3 RBr + H 3 PO 3
Při deoxygenaci Barton -McCombie je alkohol při radikální substituční reakci deoxygenován na alkan pomocí tributylcínhydridu nebo komplexu trimethylboran -voda .
Dehydratace
Mezitím má atom kyslíku osamocené páry nespojených elektronů, které jej činí slabě zásaditým v přítomnosti silných kyselin, jako je kyselina sírová . Například s methanolem:
Po zpracování silnými kyselinami procházejí alkoholy eliminační reakcí E1 za vzniku alkenů . Reakce se obecně řídí Zaitsevovým pravidlem , které říká, že vzniká nejstabilnější (obvykle nejvíce substituovaný) alken. Terciární alkoholy se snadno eliminují těsně nad pokojovou teplotou, ale primární alkoholy vyžadují vyšší teplotu.
Toto je diagram kyselinou katalyzované dehydratace ethanolu za vzniku ethylenu :
Řízenější eliminační reakce vyžaduje tvorbu xanthátového esteru .
Protonolýza
Terciární alkoholy reagují se silnými kyselinami za vzniku karbokationtů. Reakce souvisí s jejich dehydratací, např. Isobutylenem z terc-butylalkoholu. Zvláštní druh dehydratační reakce zahrnuje trifenylmethanol a zejména jeho deriváty substituované aminy. Při působení kyseliny tyto alkoholy ztrácejí vodu za vzniku stabilních karbokationtů, což jsou komerční barviva.

Esterifikace
Alkohol a karboxylové kyseliny reagují při takzvané Fischerově esterifikaci . Reakce obvykle vyžaduje katalyzátor , jako je koncentrovaná kyselina sírová:
- R-OH + R'-CO 2 H → R'-CO 2 R + H 2 O
Podobným způsobem se připravují i jiné typy esterů- například tosyl (tosylátové) estery se vyrábějí reakcí alkoholu s p- toluensulfonylchloridem v pyridinu.
Oxidace
Primární alkoholy (R-CH 2 OH) může být oxidován buď aldehydy (R-CHO) nebo karboxylové kyseliny (R-CO 2 H). Oxidace sekundárních alkoholů (R 1 R 2 CH-OH), obvykle končí v ketonu (R 1 R 2 C = O) fáze. Terciární alkoholy (R 1 R 2 R 3 C-OH) jsou odolné vůči oxidaci.
Přímá oxidace primárních alkoholů na karboxylové kyseliny normálně probíhá přes odpovídající aldehyd, který je transformován přes aldehydový hydrát (R-CH (OH) 2 ) reakcí s vodou, než může být dále oxidován na karboxylovou kyselinu.

Činidla užitečná pro transformaci primárních alkoholů na aldehydy jsou obvykle také vhodná pro oxidaci sekundárních alkoholů na ketony . Patří sem Collinsovo činidlo a Dess-Martinův periodinan . Přímou oxidaci primárních alkoholů na karboxylové kyseliny lze provést za použití manganistanu draselného nebo Jonesova činidla .
Viz také
Poznámky
Reference
- Metcalf, Allan A. (1999). Svět v tolika slovech . Houghton Mifflin. ISBN 0-395-95920-9.