Alkane - Alkane

V organické chemii je alkan nebo parafín (historický triviální název, který má také jiné významy ), acyklický nasycený uhlovodík . Jinými slovy, alkan, se skládá z vodíku a uhlíku atomů uspořádaných ve stromové struktuře, ve které jsou všechny vazby uhlík-uhlík jsou jedno . Alkany mají obecný chemický vzorec C n H 2 n +2 . Složitost alkanů se pohybuje od nejjednoduššího případu metanu (CH 4 ), kde n = 1 (někdy se mu říká rodičovská molekula), až po libovolně velké a složité molekuly, jako je pentacontan (C 50 H 102 ) nebo 6-ethyl-2- methyl-5- (1-methylethyl) oktan, An izomer z tetradekanu (C 14 H 30 ).
Mezinárodní unie pro čistou a aplikovanou chemii (IUPAC) definuje alkany jako „acyklický rozvětvený nebo nerozvětvený uhlovodíky, které mají obecný vzorec C n H 2 n +2 , a proto se skládá pouze z atomů vodíku a nasycené atomy uhlíku.“ Nicméně, některé zdroje používat termín pro označení jakékoliv nasycený uhlovodík, včetně těch, které jsou buď monocyklické (tj cykloalkany ) nebo polycyklický, přestože jejich s výrazným obecný vzorec (tj cykloalkany jsou C n H 2 N ).
V alkanu je každý atom uhlíku sp 3 -hybridizován 4 sigma vazbami (buď C – C nebo C – H ), a každý atom vodíku je spojen s jedním z atomů uhlíku (ve vazbě C – H). Nejdelší řada spojených atomů uhlíku v molekule je známá jako její uhlíková kostra nebo uhlíková páteř. Počet atomů uhlíku lze považovat za velikost alkanu.
Jednou skupinou vyšších alkanů jsou vosky , pevné látky při standardní okolní teplotě a tlaku (SATP), u nichž je počet atomů uhlíku v uhlíkovém řetězci větší než přibližně 17. S jejich opakovanými jednotkami –CH 2 tvoří alkany homologní řada organických sloučenin, ve kterých se členy liší v molekulové hmotnosti násobky 14,03 u (celková hmotnost každé takové jednotky methylenového můstku , která obsahuje jeden atom uhlíku o hmotnosti 12,01 u a dva atomy vodíku o hmotnosti ~ 1,01 u každý) .
Metan je produkován methanogenními bakteriemi a některé alkany s dlouhým řetězcem fungují jako feromony u některých druhů zvířat nebo jako ochranné vosky v rostlinách a houbách. Přesto většina alkanů nemá příliš velkou biologickou aktivitu . Mohou být považovány za molekulární stromy, na které lze zavěsit aktivnější/reaktivní funkční skupiny biologických molekul.
Alkany mají dva hlavní komerční zdroje: ropu (ropu) a zemní plyn .
Alkylová skupina je alkan bázi molekulární fragment, který nese jednu otevřenou valencí pro lepení. Obvykle jsou zkráceny se symbolem pro jakoukoli organylovou skupinu, R, ačkoli Alk se někdy používá ke specifické symbolizaci alkylové skupiny (na rozdíl od alkenylové skupiny nebo arylové skupiny).
Struktura a klasifikace
Obvykle je vzdálenost CC jednoduché vazby 1,53 Å. Nasycené uhlovodíky mohou být lineární, rozvětvené nebo cyklické . Třetí skupině se někdy říká cykloalkany . Velmi komplikované struktury jsou možné kombinací lineárních, větvených, cyklických alkanů.
Izomerismus
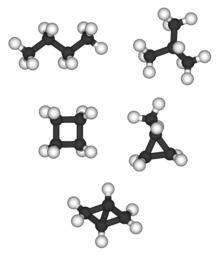
Bicyklo [1.1.0] butan je jediný C 4 H 6 alkan a nemá alkan izomer; tetrahedrane (viz níže), je jediný C 4 H 4 alkan, a proto nemá žádné alkan izomer.
Alkany s více než třemi atomy uhlíku mohou být uspořádány různými způsoby za vzniku strukturních izomerů . Nejjednodušší izomer alkanu je ten, ve kterém jsou atomy uhlíku uspořádány v jednom řetězci bez větví. Tento izomer se někdy nazývá n -izomer ( n pro „normální“, i když to nemusí být nutně nejběžnější). Řetězec atomů uhlíku však může být také rozvětvený v jednom nebo více bodech. Počet možných izomerů rychle roste s počtem atomů uhlíku. Například pro acyklické alkany:
- C 1 : pouze metan
- C 2 : Pouze ethan
- C 3 : Pouze propan
- Izomery C 4 : 2: butan a isobutan
- Izomery C 5 : 3: pentan , izopentan a neopentan
- Izomery C 6 : 5: hexan , 2-methylpentan , 3-methylpentan , 2,2-dimethylbutan a 2,3-dimethylbutan
- Izomery C 7 : 9: heptan , methylhexan (2 izomery), dimethylpentan (4 izomery), 3-ethylpentan , 2,2,3-trimethylbutan
- Izomery C 8 : 18: oktan , 2-methylheptan , 3-methylheptan , 2,3-dimethylhexan , 3,4-dimethylhexan , 2,3,4-trimethylpentan , 3,3-dimethylhexan , 2,2-trimethylpentan , 2, 4-dimethylhexan , 2,2,4-trimethylpentan , 2,3,3-trimethylpentan , 3,3,4-trimethylpentan , 3,4,4-trimethylpentan , 2,4,4-trimethylpentan , (5 izomerů)
- C 9 : 35 izomery
- C 10 : 75 izomerů
- C 12 : 355 izomerů
- C 32 : 27 711 253 769 izomerů
- C 60 : 22 158 734 535 770 411 074 184 izomerů, z nichž mnohé nejsou stabilní.
Rozvětvené alkany mohou být chirální . Například 3-methylhexan a jeho vyšší homologové jsou chirální kvůli svému stereogennímu centru na atomu uhlíku číslo 3. Výše uvedený seznam obsahuje pouze rozdíly v konektivitě, nikoli stereochemii. Kromě alkanových izomerů může řetězec atomů uhlíku tvořit jeden nebo více kruhů. Takové sloučeniny se nazývají cykloalkany a jsou také vyloučeny z výše uvedeného seznamu, protože změnou počtu kruhů se změní molekulární vzorec . Například cyklobutan a methylcyklopropan jsou navzájem isomery (C 4 H 8 ), ale nejsou to izomery butanu (C 4 H 10 ).
Nomenklatura
Podle názvosloví IUPAC (systematický způsob pojmenovávání sloučenin) pro alkany je založen na identifikaci uhlovodíkové řetězce. Nerozvětvené, nasycené uhlovodíkové řetězce jsou pojmenovány systematicky s řeckou číselnou předponou označující počet uhlíků a příponou „-ane“.
V roce 1866 navrhl August Wilhelm von Hofmann systematizaci nomenklatury použitím celé posloupnosti samohlásek a, e, i, o a u k vytvoření přípon -ane, -ene, -ine (nebo -yne), -one, -une, pro na uhlovodíky, C n H 2 n + 2 , C n H 2 n , C n H 2 n -2 , C n H 2 n -4 , C n H 2 n -6 . V moderní nomenklatuře první tři konkrétně pojmenovávají uhlovodíky s jednoduchou, dvojnou a trojnou vazbou; zatímco „-one“ nyní představuje keton .
Lineární alkany
Alkany s přímým řetězcem jsou někdy označeny předponou „n-“ nebo „ n- “ (pro „normální“), pokud existuje nelineární izomer . Ačkoli to není nezbytně nutné a není to součástí systému pojmenování IUPAC, použití je stále běžné v případech, kdy je třeba zdůraznit nebo odlišit izomery s lineárním a rozvětveným řetězcem, např. „ N- butan “ než jednoduše „butan“, aby se odlišil od isobutanu . Alternativní názvy pro tuto skupinu používané v ropném průmyslu jsou lineární parafiny nebo n -parafiny .
Prvních šest členů řady (z hlediska počtu atomů uhlíku) je pojmenováno následovně:
- metan
- CH 4 - jeden uhlík a 4 vodík
- etan
- C 2 H 6 - dva uhlíky a 6 vodík
- propan
- C 3 H 8 - tři uhlíky a 8 vodík
- butan
- C 4 H 10 - čtyři uhlíky a 10 vodík
- pentan
- C 5 H 12 - pět uhlíků a 12 vodíku
- hexan
- C 6 H 14 - šest uhlíku a 14 vodíku
První čtyři názvy byly odvozeny od methanolu , etheru , kyseliny propionové a kyseliny máselné . Alkany s pěti nebo více atomy uhlíku jsou pojmenovány přidáním přípony -ane k příslušné předponě numerického multiplikátoru s elikací jakékoli koncové samohlásky ( -a nebo -o ) ze základního numerického výrazu. Proto pentan , C 5 H 12 ; hexan , C 6 H 14 ; heptan , C 7 H 16 ; oktan , C 8 H 18 ; atd. Číselná předpona je obecně řecká, nicméně alkany s počtem atomů uhlíku končícím na devět, například nonan , používají latinskou předponu non- . Úplnější seznam najdete v seznamu alkanů s přímým řetězcem .
Rozvětvené alkany
Jednoduché rozvětvené alkany mají často společný název pomocí předpony, která je odlišuje od lineárních alkanů, například n -pentan , izopentan a neopentan .
K vytvoření systematického názvu lze použít konvence pojmenování IUPAC.
Klíčové kroky při pojmenovávání složitějších rozvětvených alkanů jsou následující:
- Identifikujte nejdelší souvislý řetězec atomů uhlíku
- Pojmenujte tento nejdelší kořenový řetězec pomocí standardních pravidel pojmenování
- Pojmenujte každý postranní řetězec změnou přípony názvu alkanu z „-ane“ na „-yl“
- Očíslete nejdelší souvislý řetězec, abyste získali nejnižší možný počet postranních řetězců
- Očíslujte a pojmenujte postranní řetězce před názvem kořenového řetězce
- Pokud existuje více postranních řetězců stejného typu, označte je předponami jako „di-“ a „tri-“ a každý očíslujte.
- Přidejte názvy postranních řetězců v abecedním pořadí (bez ohledu na předpony „di-“ atd.) Před názvem kořenového řetězce
| Běžné jméno | n -pentan | isopentan | neopentan |
|---|---|---|---|
| Název IUPAC | pentan | 2-methylbutan | 2,2-dimethylpropan |
| Struktura |  |

|
Nasycené cyklické uhlovodíky
Ačkoli je tato třída uhlovodíků technicky odlišná od alkanů, někteří ji označují jako „cyklické alkany“. Jak vyplývá z jejich popisu, obsahují jeden nebo více prstenů.
Jednoduché cykloalkany mají předponu „cyklo-“, aby se odlišily od alkanů. Cykloalkany jsou pojmenovány podle svých acyklických protějšků s ohledem na počet atomů uhlíku v jejich páteřích, např. Cyklopentan (C 5 H 10 ) je cykloalkan s 5 atomy uhlíku stejně jako pentan (C 5 H 12 ), ale jsou spojeny v pětičlenném kruhu. Podobným způsobem propan a cyklopropan , butan a cyklobutan atd.
Substituované cykloalkany jsou pojmenovány podobně jako substituované alkany - je uveden cykloalkanový kruh a substituenty jsou podle jejich polohy na kruhu, přičemž číslování určuje pravidla priority Cahn – Ingold – Prelog .
Triviální/běžné názvy
Triviální ( nesystematický ) název pro alkany je „parafiny“. Alkany jsou společně známé jako „parafínová řada“. Triviální názvy sloučenin jsou obvykle historickými artefakty. Byly vytvořeny před vývojem systematických názvů a byly zachovány kvůli známému použití v průmyslu. Cykloalkany se také nazývají nafteny.
Alkany s rozvětveným řetězcem se nazývají izoparafiny . "Parafín" je obecný termín a často nerozlišuje mezi čistými sloučeninami a směsmi izomerů , tj. Sloučeninami stejného chemického vzorce , např. Pentan a isopentan .
- V IUPAC
V systému IUPAC jsou zachovány následující triviální názvy:
- Non-IUPAC
Občas se používají některé triviální názvy, které nejsou podle IUPAC:
Fyzikální vlastnosti
Všechny alkany jsou bezbarvé. Alkany s nejnižší molekulovou hmotností jsou plyny, mezimolekulární jsou kapaliny a nejtěžší jsou voskovité pevné látky.
Tabulka alkanů
| Alkane | Vzorec | Bod varu [° C] | Teplota tání [° C] | Hustota [kg/m 3 ] (při 20 ° C ) | Izomery |
| Metan | CH 4 | -162 | −182 | 0,656 (plyn) | 1 |
| Etan | C 2 H 6 | −89 | −183 | 1,26 (plyn) | 1 |
| Propan | C 3 H 8 | −42 | −188 | 2,01 (plyn) | 1 |
| Butan | C 4 H 10 | 0 | −138 | 2,48 (plyn) | 2 |
| Pentan | C 5 H 12 | 36 | -130 | 626 (kapalina) | 3 |
| Hexan | C 6 H 14 | 69 | -95 | 659 (kapalina) | 5 |
| Heptan | C 7 H 16 | 98 | −91 | 684 (kapalina) | 9 |
| Oktan | C 8 H 18 | 126 | −57 | 703 (kapalina) | 18 |
| Nonane | C 9 H 20 | 151 | −54 | 718 (kapalina) | 35 |
| Dekan | C 10 H 22 | 174 | −30 | 730 (kapalina) | 75 |
| Undecane | C 11 H 24 | 196 | −26 | 740 (kapalina) | 159 |
| Dodekan | C 12 H 26 | 216 | −10 | 749 (kapalina) | 355 |
| Tridecane | C 13 H 28 | 235 | -5,4 | 756 (kapalina) | 802 |
| Tetradekan | C 14 H 30 | 253 | 5.9 | 763 (kapalina) | 1858 |
| Pentadekan | C 15 H 32 | 270 | 10 | 769 (kapalina) | |
| Hexadecane | C 16 H 34 | 287 | 18 | 773 (kapalina) | |
| Heptadecane | C 17 H 36 | 303 | 22 | 777 (pevný) | |
| Octadecane | C 18 H 38 | 317 | 28 | 781 (pevný) | |
| Nonadekan | C 19 H 40 | 330 | 32 | 785 (pevný) | |
| Icosane | C 20 H 42 | 343 | 37 | 789 (pevný) | |
| Triakontan | C 30 H 62 | 450 | 66 | 810 (pevný) | |
| Tetracontan | C 40 H 82 | 525 | 82 | 817 (pevný) | |
| Pentacontane | C 50 H 102 | 575 | 91 | 824 (pevný) | |
| Hexacontane | C 60 H 122 | 625 | 100 | 829 (pevný) | |
| Heptakontan | C 70 H 142 | 653 | 109 | 869 (pevný) |
Bod varu
Alkané zažívají intermolekulární van der Waalsovy síly . Silnější intermolekulární van der Waalsovy síly způsobují vyšší teploty varu alkanů.
Pro sílu van der Waalsových sil existují dva determinanty:
- počet elektronů obklopujících molekulu , který se zvyšuje s molekulovou hmotností alkanu
- povrchová plocha molekuly
Podle standardních podmínek , z CH 4 až C 4 H 10 alkany jsou plynné; od C 5 H 12 do C 17 H 36 jsou to kapaliny; a po C 18 H 38 jsou pevné látky. Protože teplota varu alkanů je primárně určena hmotností, nemělo by být překvapením, že bod varu má téměř lineární vztah s velikostí ( molekulovou hmotností ) molekuly. Obecně platí, že teplota varu stoupne o 20–30 ° C pro každý uhlík přidaný do řetězce; toto pravidlo platí pro jiné homologní řady.
Alkan s přímým řetězcem bude mít bod varu vyšší než alkan s rozvětveným řetězcem v důsledku větší povrchové plochy v kontaktu, tedy větších van der Waalsových sil, mezi sousedními molekulami. Srovnejte například isobutan (2-methylpropan) a n-butan (butan), které se vaří při teplotě -12 a 0 ° C, a 2,2-dimethylbutan a 2,3-dimethylbutan, které se vaří při 50 a 58 ° C, v daném pořadí .
Na druhé straně cykloalkany mívají vyšší teploty varu než jejich lineární protějšky kvůli uzamčeným konformacím molekul, které dávají rovinu mezimolekulárního kontaktu.
Teploty tání
Tyto body tání těchto alkanů následovat podobný trend teploty varu ze stejného důvodu, jak je uvedeno výše. To znamená, že (všechny ostatní věci jsou stejné) čím větší je molekula, tím vyšší je teplota tání. Mezi body varu a body tání je jeden podstatný rozdíl. Pevné látky mají pevnější a pevnější strukturu než kapaliny. Tato tuhá struktura vyžaduje energii k rozbití. Proto lépe sestavené pevné struktury budou vyžadovat více energie k rozpadu. U alkanů je to vidět z výše uvedeného grafu (tj. Modrá čára). Alkany s lichými čísly mají nižší trend v bodech tání než sudé alkany. Důvodem je, že i očíslované alkany se v pevné fázi dobře sbalí a vytvoří dobře organizovanou strukturu, která k rozpadu vyžaduje více energie. Liché alkany se sbalí méně dobře, a proto „volnější“ organizovaná pevná struktura balení vyžaduje méně energie k rozbití. Vizualizaci krystalových struktur viz.
Teploty tání alkanů s rozvětveným řetězcem mohou být buď vyšší nebo nižší než teploty tání odpovídajících alkanů s přímým řetězcem, opět v závislosti na schopnosti příslušného alkanu dobře se sbalit v pevné fázi.
Vodivost a rozpustnost
Alkany nevedou elektřinu v žádném případě, ani nejsou výrazně polarizována pomocí elektrického pole . Z tohoto důvodu netvoří vodíkové vazby a jsou nerozpustné v polárních rozpouštědlech, jako je voda. Vzhledem k tomu, že vodíkové vazby mezi jednotlivými molekulami vody jsou vyrovnány od molekuly alkanu, koexistence alkanu a vody vede ke zvýšení molekulárního řádu (snížení entropie ). Protože neexistuje žádná významná vazba mezi molekulami vody a molekulami alkanu, druhý termodynamický zákon naznačuje, že toto snížení entropie by mělo být minimalizováno minimalizací kontaktu mezi alkanem a vodou: Alkany jsou údajně hydrofobní , protože jsou nerozpustné ve vodě.
Jejich rozpustnost v nepolárních rozpouštědlech je relativně vysoká, což je vlastnost, která se nazývá lipofilita . Alkany jsou například mezi sebou mísitelné ve všech poměrech.
Hustota alkanů se obvykle zvyšuje s počtem atomů uhlíku, ale zůstává menší než u vody. Alkany tedy tvoří svrchní vrstvu ve směsi alkan - voda.
Molekulární geometrie

Molekulární struktura alkanů přímo ovlivňuje jejich fyzikální a chemické vlastnosti. To je odvozeno z elektronové konfigurace z uhlíku , který má čtyři valenční elektrony . Atomy uhlíku v alkanech jsou popsány jako hybridy sp 3 , to znamená, že pro dobrou aproximaci jsou valenční elektrony v orbitálech směřujících do rohů čtyřstěnu, které jsou odvozeny z kombinace orbitálu 2s a tří 2p orbitaly. Geometricky je úhel mezi vazbami cos −1 ( -1/3) ≈ 109,47 °. To je přesné pro případ metanu, zatímco větší alkany obsahující kombinaci vazeb C – H a C – C mají obecně vazby, které jsou v rozmezí několika stupňů této idealizované hodnoty.
Délky vazby a úhly vazby
Alkan má pouze jednoduché vazby C – H a C – C. První z nich je důsledkem překrývání orbitálu sp 3 uhlíku s orbitálem 1 s vodíku; druhý překrytím dvou orbitálů sp 3 na sousedních atomech uhlíku. Délky vazeb množství 1,09 x 10 -10 m pro C-H vazby a 1,54 x 10 -10 m pro C-C vazbou.
Prostorové uspořádání vazeb je podobné jako u čtyř orbitálů sp 3 - jsou uspořádány čtyřstěnově a svírají mezi sebou úhel 109,47 °. Strukturní vzorce, které představují vazby jako navzájem kolmé, ačkoliv jsou běžné a užitečné, geometrii přesně nevystihují.
Konformace
Strukturní vzorec a úhly vazeb obvykle nepostačují k úplnému popisu geometrie molekuly. Pro každou vazbu uhlík -uhlík existuje další stupeň volnosti : torzní úhel mezi atomy nebo skupinami vázanými k atomům na každém konci vazby. Prostorové uspořádání popsané torzními úhly molekuly je známé jako její konformace .

Ethan tvoří nejjednodušší případ studia konformace alkanů, protože existuje pouze jedna vazba C -C. Pokud se člověk podívá dolů na osu vazby C – C, uvidí takzvanou Newmanovu projekci . Atomy vodíku na předních i zadních atomech uhlíku mají mezi sebou úhel 120 °, což je důsledkem projekce základny čtyřstěnu na rovnou rovinu. Torzní úhel mezi daným atomem vodíku připojeným k přednímu uhlíku a daným atomem vodíku připojeným k zadnímu uhlíku se však může volně měnit mezi 0 ° a 360 °. To je důsledek volné rotace kolem jednoduché vazby uhlík -uhlík. Navzdory této zjevné volnosti jsou důležité pouze dvě omezující konformace: zastíněná konformace a střídavá konformace .
Tyto dvě konformace se liší energií: rozložená konformace je o 12,6 kJ/mol (3,0 kcal/mol) energeticky nižší (stabilnější) než zastínená konformace (nejméně stabilní).
Tento rozdíl v energii mezi oběma konformacemi, známými jako torzní energie , je ve srovnání s tepelnou energií molekuly ethanu při okolní teplotě nízký. Kolem vazby C – C existuje neustálá rotace. Doba potřebná pro ethane molekulu pro přechod z jednoho odstupňované konformaci k příští, ekvivalentní k rotaci jednoho CH 3 skupině o 120 ° vzhledem k druhé, je v řádu 10 -11 sekund.
Případ vyšších alkanů je složitější, ale vychází z podobných principů, přičemž antipiperiplanární konformace je vždy nejpreferovanější kolem každé vazby uhlík -uhlík. Z tohoto důvodu jsou alkany obvykle zobrazeny v klikatém uspořádání v diagramech nebo v modelech. Skutečná struktura se bude od těchto idealizovaných forem vždy poněkud lišit, protože rozdíly v energii mezi konformacemi jsou malé ve srovnání s tepelnou energií molekul: Alkanové molekuly nemají žádnou pevnou strukturní formu, ať už modely naznačují cokoli.
Spektroskopické vlastnosti
Prakticky všechny organické sloučeniny obsahují vazby uhlík -uhlík a uhlík -vodík, a tak ukazují některé rysy alkanů v jejich spektrech. Alkany jsou pozoruhodné tím, že nemají žádné další skupiny, a proto absencí dalších charakteristických spektroskopických znaků funkční skupiny, jako je –OH , –CHO , –COOH atd.
Infračervená spektroskopie
Režim natahování uhlík -vodík poskytuje silnou absorpci mezi 2850 a 2960 cm −1 , zatímco režim natahování uhlík -uhlík pohlcuje mezi 800 a 1300 cm −1 . Režimy ohýbání uhlík -vodík závisí na povaze skupiny: methylové skupiny vykazují pásy při 1450 cm −1 a 1375 cm −1 , zatímco methylenové skupiny vykazují pásy při 1465 cm −1 a 1450 cm −1 . Uhlíkové řetězce s více než čtyřmi atomy uhlíku vykazují slabou absorpci kolem 725 cm −1 .
NMR spektroskopie
Protonové rezonance alkanů se obvykle nacházejí při δ H = 0,5–1,5. Rezonance uhlíku-13 závisí na počtu atomů vodíku připojených k uhlíku: δ C = 8–30 (primární, methyl, –CH 3 ), 15–55 (sekundární, methylen, –CH 2- ), 20–60 (terciární, methynový, C – H) a kvartérní. Rezonance kvartérních atomů uhlíku na 13 je charakteristicky slabá, kvůli nedostatku jaderného Overhauserova efektu a dlouhé relaxační době , a může být vynechána u slabých vzorků nebo vzorků, které nebyly dostatečně dlouho spuštěny.
Hmotnostní spektrometrie
Alkany mají vysokou ionizační energii a molekulární ionty jsou obvykle slabé. Fragmentační vzor může být obtížně interpretovatelný, ale v případě alkanů s rozvětveným řetězcem je uhlíkový řetězec přednostně štěpen na terciárních nebo kvartérních uhlících kvůli relativní stabilitě výsledných volných radikálů . Výsledný fragment ze ztráty jediné methylové skupiny ( M - 15), je často přítomen, a jiné fragmenty jsou často umístěny intervaly čtrnácti jednotek hmotnosti, což odpovídá sekvenční ztrátě CH 2 skupin.
Chemické vlastnosti
Alkany reagují s většinou chemických sloučenin jen slabě. Tyto disociační konstanta kyseliny (p K ) hodnoty všech alkanů se odhaduje na rozmezí od 50 do 70 ° C, v závislosti na způsobu extrapolace, a proto jsou velmi slabé kyseliny, které jsou v podstatě inertní k bází (viz: uhlíku kyselin ). Jsou to také extrémně slabé zásady, které nepodléhají žádné pozorovatelné protonaci v čisté kyselině sírové ( H 0 ~ –12), ačkoli je známo , že superkyseliny, které jsou přinejmenším milionkrát silnější, je protonují za vzniku hyperkoordinovaných iontů alkania (viz: methaniový ion ) . Podobně vykazují reaktivitu pouze s nejsilnějšími elektrofilními činidly (např. Dioxirany a soli obsahující kation NF 4 + ). Díky svým silně C-H vazbám (~ 100 kcal/mol) a C-C vazbám (~ 90 kcal/mol, ale obvykle méně stericky přístupným) jsou také relativně nereaktivní vůči volným radikálům, ačkoli mnoho radikálů s nedostatkem elektronů bude reagovat s alkany v nepřítomnosti dalších elektronově bohatých vazeb (viz níže). Tato setrvačnost je zdrojem termínu parafiny (s významem zde "postrádající afinitu"). V ropy alkanové molekuly zůstaly chemicky nezměněn po miliony let.
Volné radikály , molekuly s nepárovými elektrony, hrají velkou roli ve většině reakcí alkanů, jako je krakování a reformace, kdy se alkany s dlouhým řetězcem přeměňují na alkany s kratším řetězcem a alkany s přímým řetězcem na izomery s rozvětveným řetězcem. Kromě toho jsou možné redoxní reakce alkanů zahrnující meziprodukty volných radikálů, zejména s kyslíkem a halogeny, protože atomy uhlíku jsou v silně redukovaném stavu; v případě metanu je uhlík ve svém nejnižším možném oxidačním stavu (−4). Reakce s kyslíkem (je -li přítomna v dostatečném množství k uspokojení stechiometrie reakce ) vede ke spalování bez kouře za vzniku oxidu uhličitého a vody. U halogenů dochází k halogenačním reakcím volných radikálů , což vede k produkci haloalkanů . Kromě toho bylo prokázáno, že alkany interagují s určitými komplexy přechodných kovů a váží se na ně v reakcích aktivace vazby C -H .
U vysoce rozvětvených alkanů se úhel vazby může výrazně lišit od optimální hodnoty (109,5 °) pro uložení objemných skupin. Taková zkreslení způsobují napětí v molekule, známé jako sterická překážka nebo kmen. Kmen podstatně zvyšuje reaktivitu.
Obecně a možná překvapivě však platí, že když větvení není dostatečně rozsáhlé na to, aby vedlo k velmi nepříznivým interakcím 1,2- a 1,3-alkyl-alkylesterů (v hodnotě ~ 3,1 kcal/mol a ~ 3,7 kcal/mol v případě zatmění konformací butanu, respektive pentanu), jsou rozvětvené alkany ve skutečnosti termodynamicky stabilnější než jejich lineární (nebo méně rozvětvené) izomery. Například vysoce rozvětvený 2,2,3,3 -tetramethylbutan je asi o 1,9 kcal/mol stabilnější než jeho lineární izomer, n -oktan. Vzhledem k jemnosti tohoto účinku byly přesné důvody tohoto pravidla v chemické literatuře energicky diskutovány a dosud nejsou vyřešeny. Jako možnosti bylo pokročeno několik vysvětlení, včetně stabilizace rozvětvených alkanů elektronovou korelací, destabilizace lineárních alkanů sterickou repulzí, stabilizace neutrální hyperkonjugací a/nebo elektrostatické efekty. Spor souvisí s otázkou, zda je tradiční vysvětlení hyperkonjugace primárním faktorem ovlivňujícím stabilitu alkylových radikálů.
Reakce s kyslíkem (spalovací reakce)
Všechny alkany reagují s kyslíkem při spalovací reakci, přestože je stále obtížnější je zapálit, jak se zvyšuje počet atomů uhlíku. Obecná rovnice pro úplné spalování je:
- C n H 2 n +2 + (3/2n + 1/2) O 2 → ( n + 1) H 2 O + n CO 2
- nebo C n H 2 n +2 + (3 n + 1/2) O 2 → ( n + 1) H 2 O + n CO 2
Při nedostatku kyslíku může vzniknout oxid uhelnatý nebo dokonce saze , jak je uvedeno níže:
Například metan :
- 2 CH 4 + 3 O 2 → 4 H 2 O + 2 CO
- CH 4 + O 2 → 2 H 2 O + C
Podrobná data najdete v tabulce alkanického tepla tvorby . Standardní Změna entalpie spalování , Δ c H ⊖ , pro alkany se zvýší o asi 650 kJ / mol na CH 2 skupinu. Alkany s rozvětveným řetězcem mají nižší hodnoty Δ c H ⊖ než alkany s přímým řetězcem se stejným počtem atomů uhlíku, a proto je lze považovat za poněkud stabilnější.
Reakce s halogeny
Alkany reagují s halogeny v takzvané volné radikálové halogenační reakci. Atomy vodíku v alkanu jsou postupně nahrazovány atomy halogenu. Volné radikály jsou reaktivní druhy, které se účastní reakce, což obvykle vede ke směsi produktů. Reakce je vysoce exotermická s halogenfluorem a může vést k výbuchu.
Tyto reakce jsou důležitou průmyslovou cestou k halogenovaným uhlovodíkům. Existují tři kroky:
- Iniciace halogenových radikálů vzniká homolýzou . Obvykle je zapotřebí energie ve formě tepla nebo světla.
- Poté dochází k řetězové reakci nebo šíření - halogenový radikál odebírá vodík z alkanu za vzniku alkylového radikálu. To reaguje dále.
- Ukončení řetězce, kde se radikály rekombinují.
Experimenty ukázaly, že veškerá halogenace produkuje směs všech možných izomerů, což naznačuje, že všechny atomy vodíku jsou náchylné k reakci. Vyrobená směs však není statistickou směsí: Sekundární a terciární atomy vodíku jsou přednostně nahrazovány kvůli větší stabilitě sekundárních a terciárních volných radikálů. Příkladem je monobromace propanu:
Praskání
Cracking rozbije větší molekuly na menší. To lze provést tepelnou nebo katalytickou metodou. Proces tepelného krakování sleduje homolytický mechanismus s tvorbou volných radikálů . Proces katalytického krakování zahrnuje přítomnost kyselých katalyzátorů (obvykle pevných kyselin, jako je oxid křemičitý-oxid hlinitý a zeolity ), které podporují heterolytické (asymetrické) lámání vazeb za vzniku dvojic iontů opačných nábojů, obvykle karbokationtu a velmi nestabilního hydridového aniontu . Volné radikály a kationty lokalizované na uhlíku jsou vysoce nestabilní a podléhají procesům přeskupení řetězce, štěpení C-C v poloze beta (tj. Praskání) a intra- a intermolekulárnímu přenosu vodíku nebo přenosu hydridů . V obou typech procesů jsou odpovídající reaktivní meziprodukty (radikály, ionty) trvale regenerovány, a proto probíhají mechanismem samoregulačního řetězce. Řetězec reakcí je nakonec ukončen radikálovou nebo iontovou rekombinací.
Izomerizace a reformace
Dragan a jeho kolega byli první, kdo informoval o izomerizaci alkanů. Izomerizace a reformace jsou procesy, při kterých se alkany s přímým řetězcem zahřívají v přítomnosti platinového katalyzátoru. Při izomerizaci se z alkanů stávají izomery s rozvětveným řetězcem. Jinými slovy, neztrácí žádné uhlíky ani vodíky, přičemž si zachovává stejnou molekulovou hmotnost. Při reformaci se z alkanů stávají cykloalkany nebo aromatické uhlovodíky , které jako vedlejší produkt uvolňují vodík. Oba tyto procesy zvyšují oktanové číslo látky. Butan je nejběžnějším alkanem, který se podrobuje procesu izomerizace, protože vytváří mnoho rozvětvených alkanů s vysokými oktanovými čísly.
Jiné reakce
Alkany budou reagovat s párou v přítomnosti niklového katalyzátoru za vzniku vodíku . Alkany lze chlorsulfonovat a nitrovat , ačkoli obě reakce vyžadují zvláštní podmínky. Fermentace alkanů na karboxylové kyseliny je nějaké technický význam. V Reed reakčních , oxidu siřičitého , chlóru a světlo jejich převod z uhlovodíků na sulfonylchloridy . Nukleofilní abstrakci lze použít k oddělení alkanu od kovu. Alkylové skupiny mohou být přeneseny z jedné sloučeniny do druhé transmetalačními reakcemi. Protonátové alkany může směs pentafluoridu antimonitého (SbF 5 ) a kyseliny fluorosulfonové (HSO 3 F), nazývaná magická kyselina .
Výskyt
Výskyt alkanů ve vesmíru

Alkany tvoří malou část atmosféry vnějších plynných planet, jako je Jupiter (0,1% metan, 2 ppm ethan), Saturn (0,2% metan, 5 ppm ethan), Uran (1,99% metan, 2,5 ppm ethan) a Neptun ( 1,5% methanu, 1,5 ppm ethanu). Titan (1,6% metan), satelit Saturnu, byl zkoumán sondou Huygens , která ukázala, že atmosféra Titanu periodicky prší tekutý metan na povrch měsíce. Také na Titanu mise Cassini zobrazila sezónní metan/etanová jezera poblíž polárních oblastí Titanu. Metan a etan byly také detekovány v ocasu komety Hyakutake . Chemická analýza ukázala, že množství ethanu a metanu bylo zhruba stejné, z čehož se předpokládá, že jeho led se vytvořil v mezihvězdném prostoru, daleko od Slunce, který by tyto těkavé molekuly odpařil. Alkany byly také detekovány v meteoritech, jako jsou uhlíkaté chondrity .
Výskyt alkanů na Zemi
V zemské atmosféře se vyskytují stopy metanového plynu (asi 0,0002% nebo 1745 ppb), produkované především methanogenními mikroorganismy, jako je Archaea ve střevech přežvýkavců.
Nejdůležitějšími komerčními zdroji pro alkany jsou zemní plyn a ropa . Zemní plyn obsahuje především metan a etan, s trochou propanu a butanu : ropa je směsí kapalných alkanů a dalších uhlovodíků . Tyto uhlovodíky vznikly, když mořští živočichové a rostliny (zooplankton a fytoplankton) uhynuli a potopili se na dno starověkých moří a byly pokryty sedimenty v anoxickém prostředí a přeměněny po mnoho milionů let při vysokých teplotách a vysokém tlaku do dnešní podoby. Zemní plyn proto vyplynul například z následující reakce:
- C 6 H 12 O 6 → 3 CH 4 + 3 CO 2
Tato ložiska uhlovodíků, shromážděná v porézních horninách uvězněných pod nepropustnými horninami, zahrnují komerční ropná pole . Vznikly po miliony let a jakmile jsou vyčerpány, nelze je snadno nahradit. Vyčerpání těchto zásob uhlovodíků je základem energetické krize .
Metan je také přítomen v takzvaném bioplynu , který produkují zvířata a rozpadající se hmota, což je možný obnovitelný zdroj energie .
Alkany mají nízkou rozpustnost ve vodě, takže obsah v oceánech je zanedbatelný; avšak při vysokých tlacích a nízkých teplotách (například na dně oceánů) může metan kokrystalizovat s vodou za vzniku pevného methan-klatrátu (hydrát metanu). I když to v současné době nelze komerčně využít, množství hořlavé energie známých polí metan -klatrátu přesahuje energetický obsah veškerého dohromady uloženého ložiska zemního plynu a ropy. Metan extrahovaný z methanklatrátu je proto kandidátem pro budoucí paliva.
Biologický výskyt
Acyklické alkany se v přírodě vyskytují různými způsoby.
- Bakterie a archea
Některé typy bakterií mohou metabolizovat alkany: upřednostňují sudé uhlíkové řetězce, protože je lze snadněji degradovat než liché řetězce.
Na druhé straně určité archea , methanogeny , produkují velké množství metanu metabolizací oxidu uhličitého nebo jiných oxidovaných organických sloučenin. Energie se uvolňuje oxidací vodíku :
- CO 2 + 4 H 2 → CH 4 + 2 H 2 O
Methanogeny jsou také producenty bahenního plynu v mokřadech . Produkce metanu u skotu a dalších býložravců , kteří mohou uvolnit 30 až 50 galonů denně, a termitů , je také způsobena methanogeny. Produkují také tento nejjednodušší ze všech alkanů ve střevech lidí. Methanogenní archea jsou tedy na konci uhlíkového cyklu s tím, že uhlík se uvolňuje zpět do atmosféry poté, co byl fixován fotosyntézou . Je pravděpodobné, že podobně vznikla i naše současná ložiska zemního plynu.
- Houby a rostliny
Alkany také hrají roli, i když jen malou roli, v biologii tří eukaryotických skupin organismů: hub , rostlin a zvířat. Některé specializované kvasinky, např. Candida tropicale , Pichia sp., Rhodotorula sp., Mohou využívat alkany jako zdroj uhlíku nebo energie. Houba Amorphotheca resinae preferuje v leteckém palivu alkany s delším řetězcem a může způsobit vážné problémy letadlům v tropických oblastech.
V rostlinách se pevné alkany s dlouhým řetězcem nacházejí v rostlinné kutikule a epikutikulárním vosku mnoha druhů, ale jen zřídka jsou hlavními složkami. Chrání rostlinu před ztrátou vody, brání vyplavování důležitých minerálů deštěm a chrání před bakteriemi, houbami a škodlivým hmyzem. Uhlíkové řetězce v rostlinných alkanech jsou obvykle liché, mají délku 27 až 33 atomů uhlíku a jsou vyráběny rostlinami dekarboxylací sudých číslovaných mastných kyselin . Přesné složení vrstvy vosku závisí nejen na druhu, ale mění se také podle ročního období a faktorů prostředí, jako jsou světelné podmínky, teplota nebo vlhkost.
Těkavější alkany s krátkým řetězcem jsou také produkovány a nacházejí se v rostlinných tkáních. Jeffrey borovice je známý pro výrobu mimořádně vysoké hladiny n - heptanu ve své pryskyřice, a proto se jeho destilát označené jako nulový bod pro jednu oktanovým číslem . O květinových vůních je také dlouho známo, že obsahují těkavé alkanové složky, a n - nonan je významnou složkou vůně některých růží . Emise plynných a těkavých alkanů, jako je ethan , pentan a hexan rostlinami, byly rovněž dokumentovány na nízkých úrovních, i když nejsou obecně považovány za hlavní složku biogenního znečištění ovzduší.
Jedlé rostlinné oleje také typicky obsahují malé frakce biogenních alkanů se širokým spektrem uhlíkových čísel, převážně 8 až 35, obvykle vrcholí v nízkých až horních 20. letech, s koncentracemi až desítky miligramů na kilogram (díly na milion hmotnosti) a někdy přes sto za celkový podíl alkanu.
- Zvířata
Alkany se nacházejí v živočišných produktech, i když jsou méně důležité než nenasycené uhlovodíky. Jedním z příkladů je Olej ze žraločích jater, což je přibližně 14% pristan (2,6,10,14-tetramethylpentadecane, C 19 H 40 ). Jsou důležité jako feromony , chemické poslové materiály, na nichž je hmyz závislý na komunikaci. U některých druhů, např. Nosný brouk Xylotrechus colonus , se tělesným kontaktem přenáší pentacosan (C 25 H 52 ), 3-methylpentaicosan (C 26 H 54 ) a 9-methylpentaicosan (C 26 H 54 ). S dalšími, jako jsou tsetse fly Glossina morsitans morsitans , feromon obsahuje čtyři alkany 2-methylheptadecane (C 18 H 38 ), 17,21-dimethylheptatriacontane (C 39 H 80 ), 15,19-dimethylheptatriacontane (C 39 H 80 ) a 15,19,23-trimethylheptatriacontane (C 40 H 82 ), a na delší vzdálenosti působí čichem. Včely tančící včely produkují a uvolňují dva alkany, trikosan a pentacosan.
Ekologické vztahy

Jedním příkladem, ve kterém hrají roli jak rostlinné, tak živočišné alkany, je ekologický vztah mezi včelkou písečnou ( Andrena nigroaenea ) a ranou orchidejí ( Ophrys sphegodes ); druhý je závislý na opylení na prvním. Včely písečné používají feromony k identifikaci partnera; v případě A. nigroaenea samice emitují směs trikosanu (C 23 H 48 ), pentacosanu (C 25 H 52 ) a heptacosanu (C 27 H 56 ) v poměru 3: 3: 1 a samce přitahují konkrétně tímto zápachem. Orchidej využívá výhody tohoto páření, aby přiměla včelí samce sbírat a šířit svůj pyl; části jeho květu nejen připomínají vzhled včel písečných, ale také produkují velké množství tří alkanů ve stejném poměru jako samice písečných včel. Výsledkem je, že mnoho samců láká ke květům a pokouší se kopulovat se svým imaginárním partnerem: ačkoli toto úsilí není korunováno úspěchem včel, umožňuje orchideji přenášet svůj pyl, který bude rozptýlen po odchodu frustrovaný muž do jiných květů.
Výroba
Rafinace ropy
Jak již bylo řečeno, nejdůležitějším zdrojem alkanů je zemní plyn a ropa . Alkany jsou odděleny v ropné rafinerii od frakční destilací a zpracovány do mnoha produktů.
Fischer – Tropsch
Fischer-Tropschova je metoda pro syntézu kapalných uhlovodíků, včetně alkanů, od oxidu uhelnatého a vodíku. Tato metoda se používá k výrobě náhražek ropných destilátů .
Laboratorní příprava
V laboratoři je obvykle malá potřeba syntetizace alkanů, protože jsou obvykle komerčně dostupné. Alkany jsou také obecně nereaktivní chemicky nebo biologicky a neprocházejí čistě interkonverzemi funkčních skupin . Když jsou alkany vyráběny v laboratoři, je to často vedlejší produkt reakce. Například použití n -butyllithia jako silné báze poskytne jako vedlejší produkt konjugovanou kyselinu, n -butan:
- C 4 H 9 Li + H 2 O → C 4 H 10 + LiOH
Někdy však může být žádoucí provést část molekuly na funkčnost podobnou alkanu ( alkylová skupina) pomocí výše uvedených nebo podobných metod. Například ethylová skupina je alkylová skupina; když je toto připojeno k hydroxylové skupině, získá se ethanol , který není alkanem. K tomu, nejznámější metody jsou hydrogenace z alkenů :
- RCH = CH 2 + H 2 → RCH 2 CH 3 (R = alkyl )
Alkany nebo alkylové skupiny lze také připravit přímo z alkylhalogenidů v reakci Corey -House -Posner -Whitesides . Bartoň-McCombie deoxygenací odstraní hydroxylové skupiny z alkoholů, např
a Clemmensenova redukce odstraní karbonylové skupiny z aldehydů a ketonů za vzniku alkanů nebo alkylem substituovaných sloučenin, např .:
Příprava alkanů z jiných organických sloučenin
Alkany lze připravit z různých organických sloučenin, mezi které patří alkeny, alkiny, halogenalkany, alkoholy, aldehydy a ketony a karboxylové kyseliny.
Z alkenů a alkynů
Když jsou alkeny a alkiny podrobeny hydrogenační reakci jejich zpracováním vodíkem v přítomnosti palladiového nebo platinového nebo niklového katalyzátoru, produkují alkany. V této reakci se dává přednost práškovému katalyzátoru pro zvětšení povrchu, takže se zvyšuje adsorpce vodíku na katalyzátoru. V této reakci se vodík naváže na katalyzátor za vzniku vazby vodík-katalyzátor, která vede k oslabení vazby HH, což vede k přidání vodíku na alkeny a alkiny. Reakce je exotermická, protože produkt alkan je stabilní, protože má více sigma vazeb než reaktantové alkeny a alkiny v důsledku přeměny pi vazby na sigma vazby.
Od haloalkanů
Alkany lze vyrábět z halogenalkanů různými způsoby.
Wurtzova reakce
Když se na halogenalkan působí sodíkem v suchém etheru, získá se alkan s dvojnásobným počtem atomů uhlíku. Tato reakce probíhá meziproduktem volných radikálů a má možnost tvorby alkenu v případě terciárních haloalkanů a vicinálních dihalogenidů.
2 R − X + 2 Na → R − R + 2 Na + X. (V přítomnosti suchého etheru
Corey-House-syntéza
Když je haloalkan ošetřen dialkyl lithium kupritem, který je jinak známý jako Gilmanovo činidlo, získá se jakýkoli vyšší alkan. Např.
Li + [R – Cu – R] - + R'– X → R – R ' + "RCu" + Li + X
Reakce s hydridem kovu
Když se na halogenalkany působí hydridem kovu, např. Hydridem sodným a lithiumaluminiumhydridem.
Franklandova reakce
Když se na halogenalkan působí zinkem v esteru, získá se alkan.
Fittigova reakce
Když se na arylhalogenid působí sodíkem v suchém etheru, vzniká bifenyl.
Ullmannova biarylová syntéza
Když je arylhalogenid ošetřen mědí, vytváří bifenyl.
Wurtz-Fittigova reakce
Když je arylhalogenid ošetřen halogenalkanem, získáme alkylbenzen.
Aplikace
Aplikace alkanů závisí na počtu atomů uhlíku. První čtyři alkany se používají hlavně k vytápění a vaření a v některých zemích k výrobě elektřiny. Metan a etan jsou hlavními složkami zemního plynu; jsou normálně skladovány jako plyny pod tlakem. Je však snazší je přepravovat jako kapaliny: To vyžaduje stlačení i chlazení plynu.
Propan a butan jsou plyny za atmosférického tlaku, které lze zkapalnit za poměrně nízkých tlaků a jsou běžně známé jako zkapalněný ropný plyn (LPG). Propan se používá v plynových hořácích na propan a jako palivo pro silniční vozidla, butan v ohřívačích prostoru a jednorázových zapalovačích cigaret. Oba se používají jako pohonné látky v aerosolových sprejích .
Od pentanu po oktan jsou alkany vysoce těkavé kapaliny. Používají se jako paliva ve spalovacích motorech , protože se snadno odpařují při vstupu do spalovací komory, aniž by vytvářely kapičky, což by narušilo rovnoměrnost spalování. Výhodné jsou alkany s rozvětveným řetězcem, protože jsou mnohem méně náchylné k předčasnému vznícení, které způsobuje klepání , než jejich homology s přímým řetězcem. Tato náchylnost k předčasnému vznícení se měří oktanovým číslem paliva, kde 2,2,4-trimethylpentan ( izooktan ) má libovolnou hodnotu 100 a heptan má hodnotu nula. Kromě jejich použití jako paliva jsou střední alkany také dobrým rozpouštědlem pro nepolární látky.
Alkany od nonanu po například hexadekan (alkan s šestnácti atomy uhlíku) jsou kapaliny s vyšší viskozitou , stále méně vhodné pro použití v benzínu. Místo toho tvoří hlavní část nafty a leteckého paliva . Dieselová paliva se vyznačují jejich cetanovým číslem , přičemž cetan je starý název pro hexadekan. Vyšší teploty tání těchto alkanů však mohou způsobovat problémy při nízkých teplotách a v polárních oblastech, kde se palivo stává příliš hustým na správné proudění.
Alkany od hexadekanu směrem nahoru tvoří nejdůležitější součásti topného oleje a mazacího oleje . Ve druhé funkci fungují současně jako antikorozní činidla, protože jejich hydrofobní povaha znamená, že voda nemůže dosáhnout kovového povrchu. Mnoho pevných alkanů nachází využití jako parafín , například ve svíčkách . To by však nemělo být zaměňováno s pravým voskem , který se skládá převážně z esterů .
Alkany s délkou řetězce přibližně 35 nebo více atomů uhlíku se nacházejí v bitumenu , který se používá například při povrchových úpravách silnic. Nicméně vyšší alkanes mají malou hodnotu a jsou obvykle rozděleny do nižší alkany by praskání .
Některé syntetické polymery, jako je polyethylen a polypropylen, jsou alkany s řetězci obsahujícími stovky nebo tisíce atomů uhlíku. Tyto materiály se používají v nesčetných aplikacích a každoročně se vyrábějí a používají miliardy kilogramů těchto materiálů.
Transformace prostředí
Alkany jsou chemicky velmi inertní nepolární molekuly, které nejsou příliš reaktivní jako organické sloučeniny. Tato inertnost přináší vážné ekologické problémy, pokud jsou uvolňovány do životního prostředí. Vzhledem k nedostatku funkčních skupin a nízké rozpustnosti ve vodě vykazují alkany špatnou biologickou dostupnost pro mikroorganismy.
Existují však některé mikroorganismy, které mají metabolickou kapacitu využívat n -alkany jako zdroje uhlíku i energie. Některé druhy bakterií se specializují na degradaci alkanů; tyto jsou označovány jako uhlovodíkové bakterie.
Nebezpečí
Metan je hořlavý, výbušný a nebezpečný při vdechování; protože je to bezbarvý plyn bez zápachu, je třeba věnovat zvláštní pozornost metanu. Ethan je také extrémně hořlavý, výbušný a nebezpečný při vdechování. Oba mohou způsobit udušení. Také propan je hořlavý a výbušný a při vdechnutí může způsobit ospalost nebo bezvědomí. Butan představuje stejná rizika jako propan.
Alkany také představují hrozbu pro životní prostředí. Rozvětvené alkany mají nižší biologickou rozložitelnost než nerozvětvené alkany. Metan je považován za skleníkový plyn, který je pro životní prostředí nejnebezpečnější, i když množství metanu v atmosféře je relativně nízké.