Antigenní variace - Antigenic variation
Antigenní variace nebo antigenní alterace se týká mechanismu, kterým infekční agens , jako je prvok , bakterie nebo virus, mění proteiny nebo uhlohydráty na svém povrchu, a tím se vyhýbá imunitní odpovědi hostitele , což z něj činí jeden z mechanismů úniku antigenu . Souvisí to s fázovými variacemi . Antigenní variace nejen umožňuje patogenu vyhnout se imunitní odpovědi u jeho aktuálního hostitele, ale také umožňuje reinfekci dříve infikovaných hostitelů. Imunita vůči reinfekci je založena na rozpoznání antigenů nesených patogenem, které jsou „zapamatovány“ získanou imunitní odpovědí . Pokud lze změnit dominantní antigen patogenu, patogen se pak může vyhnout získanému imunitnímu systému hostitele. Antigenní variace může nastat změnou různých povrchových molekul včetně proteinů a sacharidů . Antigenní variace může být důsledkem genové konverze , místně specifických inverzí DNA, hypermutace nebo rekombinace sekvenčních kazet. Výsledkem je, že i klonální populace patogenů exprimuje heterogenní fenotyp . Mnoho proteinů, o nichž je známo, že vykazují antigenní nebo fázové variace, souvisí s virulencí .
V bakteriích
Antigenní variabilitu v bakteriích nejlépe demonstrují druhy rodu Neisseria (zejména Neisseria meningitidis a Neisseria gonorrhoeae , gonococcus); druhy rodu Streptococcus a Mycoplasma . Tyto Neisseria druhy liší svou pili (proteinové polymery vyrobené z podjednotek nazývaných pilin , které hrají kritickou roli v ulpívání bakterií , a stimulují energickou odpověď hostitele imunitní) a streptokoky měnit jejich M-protein.
U bakterie Borrelia burgdorferi , původce Lyme choroby , může povrchový lipoprotein VlsE podstoupit rekombinaci, která vede k antigenní diverzitě. Bakterie nese plazmid, který obsahuje patnáct tichých vls kazet a jednu funkční kopii vlsE . Segmenty tichých kazet se rekombinují s genem vlsE a generují varianty povrchového lipoproteinového antigenu.
U prvoků
Antigenní variace využívá řada různých prvokových parazitů. Trypanosoma brucei a Plasmodium falciparum jsou jedny z nejlépe studovaných příkladů.
Trypanosoma brucei
Trypanosoma brucei , organismus, který způsobuje spavou nemoc ,
replikuje se extracelulárně v krevním oběhu infikovaných savců a je vystaven mnoha obranným mechanismům hostitele, včetně systému komplementu a vrozeného a adaptivního imunitního systému. Aby se parazit chránil, zdobí se hustým homogenním povlakem (~ 10^7 molekul) variantního povrchového glykoproteinu (VSG).
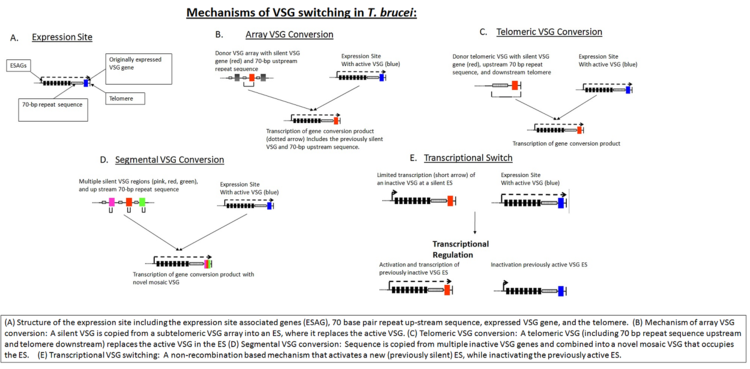
V raných stádiích invaze je plášť VSG dostatečný k ochraně parazita před imunitní detekcí. Hostitel nakonec identifikuje VSG jako cizí antigen a zahájí útok proti mikrobu. Genom parazita má však více než 1 000 genů, které kódují různé varianty VSG proteinu, umístěného na subtelomerické části velkých chromozomů nebo na intermediárních chromozomech. Tyto geny VSG se aktivují genovou konverzí v hierarchickém pořadí: nejprve se aktivují telomerické VSG, poté pole VSG a nakonec pseudogenní VSG. V daném okamžiku je vyjádřen pouze jeden VSG. Každý nový gen je postupně přepnut na expresní místo VSG (ES). Tento proces je částečně závislý na homologní rekombinaci DNA, která je částečně zprostředkována interakcí genu BRCA2 T. brucei s RAD51 (není to však jediný možný mechanismus, protože varianty BRCA2 stále vykazují určité přepínání VSG).
Kromě homologní rekombinace je při přepínání antigenu důležitá také transkripční regulace , protože T. brucei má více potenciálních expresních míst. Nový VSG lze vybrat buď transkripční aktivací dříve tichého ES, nebo rekombinací sekvence VSG do aktivního ES (viz obrázek „Mechanismy přepínání VSG u T. brucei “). Ačkoli biologické spouštěče, které vedou k přepnutí VSG, nejsou plně známy, matematické modelování naznačuje, že uspořádaný vzhled různých variant VSG je řízen alespoň dvěma klíčovými faktory odvozenými od parazitů: rozdílnou rychlostí aktivace VSG parazita a diferenciací parazita závislou na hustotě.
Plasmodium falciparum
Plasmodium falciparum , hlavní etiologický agens lidské malárie, má velmi složitý životní cyklus, který se vyskytuje jak u lidí, tak u komárů. Zatímco v lidském hostiteli, parazit tráví většinu svého životního cyklu v jaterních buňkách a erytrocytech (na rozdíl od T. brucei, který zůstává extracelulární). V důsledku svého převážně intracelulárního výklenku musí být parazitizované hostitelské buňky, které vykazují parazitické proteiny, upraveny tak, aby se zabránilo destrukci imunitní obranou hostitele. V případě Plasmodium se toho dosáhne prostřednictvím dvojího účelu membránového proteinu 1 erytrocytů Plasmodium falciparum erytrocytů (PfEMP1). PfEMP1 je kódován různorodou rodinou genů známou jako var rodina genů (celkem přibližně 60 genů). Rozmanitost genové rodiny je dále zvýšena řadou různých mechanismů, včetně výměny genetických informací v telomerických lokusech a meiotické rekombinace. Protein PfEMP1 slouží k sekvestraci infikovaných erytrocytů před destrukcí sleziny prostřednictvím adheze na endotel . Kromě toho je parazit schopen vyhnout se obranným mechanismům hostitele změnou var alely, která se používá ke kódování proteinu PfEMP1. Stejně jako T. brucei každý parazit exprimuje více kopií jednoho identického proteinu. Nicméně, na rozdíl od T. brucei , mechanismus, kterým var spínání se vyskytuje v P. falciparum je považován za čistě transkripční. Bylo prokázáno, že k přepínání varů dochází krátce po invazi erytrocytuparazitem P. falciparum . Fluorescenční in situ hybridizační analýza ukázala, že aktivace var alel je spojena se změněným umístěním genetického materiálu do odlišných „transkripčně permisivních“ oblastí.
U virů
Různé rodiny virů mají různé úrovně schopnosti měnit své genomy a přimět imunitní systém, aby nerozpoznal. Některé viry mají relativně neměnné genomy jako paramyxoviry, zatímco jiné jako chřipka mají rychle se měnící genomy, které brání naší schopnosti vytvářet dlouhodobé vakcíny proti této chorobě. Viry mají obecně mnohem vyšší rychlost mutace svých genomů než lidské nebo bakteriální buňky. Viry s kratšími genomy mají obecně vyšší rychlost mutace než delší genomy, protože mají rychlejší rychlost replikace. Klasicky se mělo za to, že viry s genomem RNA mají vždy vyšší rychlost antigenní variace než viry s genomem DNA, protože RNA polymerase chybí mechanismus pro kontrolu chyb v překladu, ale nedávná práce Duffy et al. ukazuje, že některé DNA viry mají stejně vysokou míru antigenní variace jako jejich protějšky RNA. Antigenní variace uvnitř virů lze rozdělit do 6 různých kategorií zvaných antigenní drift , shift , rift lift, sift a dárek
Antigenní trhlina: Rekombinace virového genu. K tomu dochází, když jsou opět dvě virové buňky, které infikují stejnou hostitelskou buňku. V tomto případě se viry rekombinují s kousky každého genu, čímž se vytvoří nový gen místo jednoduchého přepnutí genů. Rekombinace byla rozsáhle studována u kmenů ptačí chřipky, jak se genetika H5N1 v průběhu času měnila.
Antigenní drift: bodové mutace, ke kterým dochází nedokonalou replikací virového genomu. Všechny viry v průběhu času vykazují genetický drift, ale množství, které jsou schopné unášet, aniž by měly negativní dopad na jejich kondici, se mezi rodinami liší.
Antigenní posun: přeskupení virového genomu, ke kterému dochází, když je jedna hostitelská buňka infikována dvěma virovými buňkami. Jak virové buňky procházejí replikací, znovu seřadí a geny těchto dvou druhů se mísí a vytvářejí 256 nových variací viru. K tomu dochází při chřipce každých pár desítek let.
Antigenní prosévání: přímý přenos se zoonotickým kmenem viru. K tomu dochází, když je člověk infikován během přelévání.
Antigenic lift: Virový přenos genu odvozeného z hostitele. Některé viry kradou hostitelské geny a poté je začleňují do vlastního virového genomu a kódují geny, které jim někdy dodávají zvýšenou virulenci. Příkladem toho je vakcinie viru neštovic, která kódovala virový růstový faktor, který je velmi podobný lidskému růstovému faktoru a který je považován za ukradený z lidského genomu.
Antigenní dárek: Vyskytuje se, když lidé záměrně upravují genom viru buď v laboratoři, nebo za účelem výroby biologické zbraně.
Virus chřipky
Antigenní vlastnosti chřipkových virů jsou určeny jak hemaglutininem, tak neuraminidázou . Specifické hostitelské proteázy štěpí jeden peptid HA na dvě podjednotky HA1 a HA2. Virus se stává vysoce virulentní, pokud jsou aminokyseliny v místech štěpení lipofilní. Selekční tlak v prostředí vybírá pro antigenní změny antigenních determinantů HA, což zahrnuje místa procházející adaptivní evolucí a v antigenních místech podstupujících substituce, což v konečném důsledku vede ke změnám antigenicity viru. Glykosylace HA nekoreluje ani s antigenicitou, ani selekčním tlakem. Antigenní variace mohou být rozděleny do dvou typů, antigenní drift, který je výsledkem změny v několika aminokyselinách a antigenní posun, který je výsledkem získávání nových strukturních proteinů. Každý rok je vyžadována nová vakcína, protože virus chřipky má schopnost podstoupit antigenní drift. Antigenní posun nastává periodicky, když jsou geny pro strukturální proteiny získány od jiných zvířecích hostitelů, což má za následek náhlou dramatickou změnu virového genomu. Rekombinace mezi segmenty kódujícími hemaglutinin a neuraminidázu segmentů ptačího a lidského chřipkového viru vedla k celosvětové epidemii chřipky zvané pandemie, jako je asijská chřipka z roku 1957, kdy byly získány 3 geny z euroasijských ptačích virů a prošly přeskupením s 5 genovými segmenty cirkulujících lidské kmeny. Další příklad pochází z hongkongské chřipky z roku 1968, která získala 2 geny přeskupením virů ptačí ptáků euroasijských se 6 genovými segmenty z cirkulujících lidských kmenů.
Očkování proti chřipce
Po vakcinaci se plazmatické buňky (ASC) vylučující protilátky IgG+ rychle zvyšují a dosáhnou maximální hladiny v 7. dni, než se 14. den vrátí na minimální úroveň. B-buňky specifické pro chřipku dosahují svých maxim ve 14. – 21. Vylučované protilátky jsou specifické pro vakcinační virus. Kromě toho má většina izolovaných monoklonálních protilátek vazebné afinity proti HA a zbývající vykazují afinitu vůči NA, nukleoproteinu (NP) a dalším antigenům. Tyto vysoké afinitní lidské monoklonální protilátky mohou být produkovány do měsíce po očkování a vzhledem k jejich lidskému původu budou mít u lidí velmi malé, pokud vůbec nějaké, s protilátkou související vedlejší účinky. Mohou být potenciálně použity k vývoji pasivní protilátkové terapie proti přenosu viru chřipky.
Mapování antigenní evoluce
Schopnost antivirové protilátky inhibovat hemaglutinaci lze měřit a použít ke generování dvourozměrné mapy pomocí procesu zvaného antigenní kartografie, aby bylo možné vizualizovat vývoj antigenu. Tyto mapy mohou ukázat, jak mohou změny v aminokyselinách změnit vazbu protilátky na částici viru, a pomoci analyzovat strukturu genetické a antigenní evoluce. Nedávná zjištění ukazují, že v důsledku antigenní variace řízené protilátkou v jedné doméně místa H1 hemagglutininu Sa může vyústit kompenzační mutace v NA vedoucí k NA antigenní variaci. V důsledku toho se k inhibitorům NA vyvine rezistence na léčivo. Takový jev může maskovat evoluci evoluce NA v přírodě, protože rezistence na NA inhibitory může být důsledkem úniku HA řízeného protilátkami.
HIV-1
Hlavní výzvou při dlouhodobé kontrole infekce HIV-1 je únik imunity. Rozsah a frekvence, do jaké bude epitop zaměřen konkrétní alelou HLA, se liší od člověka k člověku. Navíc v důsledku imunodominance je CTL reakce jedince omezena na několik epitopů specifické alely HLA, i když je exprimováno šest alel HLA třídy 1. Ačkoli je CTL reakce v akutní fázi namířena proti omezenému počtu epitopů, epitopický repertoár se v důsledku úniku viru s časem zvyšuje. Koevoluce aminokyselin je navíc náročným problémem, který je třeba řešit. Například substituce v konkrétním místě má za následek sekundární nebo kompenzační mutaci v jiném místě. Neocenitelným objevem bylo, že když je aplikován selektivní tlak, lze předpovědět vzorec vývoje HIV-1. U jedinců, kteří exprimují ochrannou alelu HLA B*27, je první mutace, která se vyskytuje v Gag epitopu KK10, v poloze 6 z L na M a po několika letech dochází ke změně polohy 2 z R na K. Znalost předvídatelnosti únikových cest lze proto využít k návrhu imunogenů. Oblast gp120 HIV-1 Env, která je v kontaktu s CD4 , jeho primárním receptorem, je funkčně konzervovaná a náchylná k neutralizačním protilátkám, jako je monoklonální protilátka b12. Nedávná zjištění ukazují, že rezistence k neutralizaci pomocí b12 byla výsledkem substitucí, které se nacházely v oblasti blízké kontaktnímu povrchu CD4. Tímto způsobem se virus vyhne neutralizaci b12, aniž by ovlivnil jeho vazbu na CD4.
Flaviviry
Flaviviridae je rodina virů, která zahrnuje dobře známé viry, jako je západonilský virus a virus dengue . Rod Flavivirus má na svém povrchu prototypový obalový protein (E-protein), který slouží jako cíl pro viry neutralizující protilátky. E protein hraje roli ve vazbě na receptor a může hrát roli v obcházení imunitního systému hostitele. Má tři hlavní antigenní domény, konkrétně A, B a C, které odpovídají třem strukturálním doménám II, III a I. Strukturální doména III je domnělou doménou vázající receptor a protilátky proti ní neutralizují infekčnost flavivirů. Mutace, které vedou k antigenním rozdílům, lze vysledovat na biochemické povaze substitucí aminokyselin a také na umístění mutace v doméně III. Například substituce na různých aminokyselinách vedou k různým úrovním neutralizace protilátkami. Pokud mutace v kritické aminokyselině může dramaticky změnit neutralizaci protilátkami, pak je obtížné spoléhat se na WNV vakcíny a diagnostické testy. Jiné flaviviry, které způsobují horečku dengue, lupy nemocných a žlutou zimnici, unikají neutralizaci protilátek mutacemi v doméně III E proteinu.