Antitrombin - Antithrombin
Antitrombin (AT) je malá proteinová molekula, která inaktivuje několik enzymů koagulačního systému. Antitrombin je glykoprotein produkovaný játry a skládá se ze 432 aminokyselin. Obsahuje tři disulfidové vazby a celkem čtyři možná místa glykosylace . α-Antitrombin je dominantní forma antitrombinu nacházející se v krevní plazmě a má oligosacharid zabírající každé ze svých čtyř glykosylačních míst. Jediné místo glykosylace zůstává trvale obsazeno v minoritní formě antitrombinu, β-antitrombinu. Jeho aktivita je mnohonásobně zvýšena antikoagulačním lékem heparinem , který zvyšuje vazbu antitrombinu na faktor IIa (trombin) a faktor Xa .
Nomenklatura
Antitrombin je také nazýván Antitrombin III (AT III). Označení Antithrombin I až Antitrombin IV pochází z raných studií, které v padesátých letech provedli Seegers, Johnson a Fell.
Antitrombin I (AT I) se týká absorpce trombinu na fibrin poté, co trombin aktivoval fibrinogen . Antitrombin II (AT II) označuje kofaktor v plazmě, který spolu s heparinem interferuje s interakcí trombinu a fibrinogenu . Antitrombin III (AT III) označuje látku v plazmě, která inaktivuje trombin. Antitrombin IV (AT IV) označuje antitrombin, který se aktivuje během a krátce po srážení krve . Lékařsky významné jsou pouze AT III a případně AT I. AT III je obecně označován pouze jako "Antitrombin" a je to Antitrombin III, který je diskutován v tomto článku.
Struktura

Antitrombin má poločas v krevní plazmě přibližně 3 dny. Normální koncentrace antitrombinu v lidské krevní plazmě je vysoká přibližně 0,12 mg/ml, což odpovídá molární koncentraci 2,3 μM. Antitrombin byl izolován z plazmy velkého počtu druhů dalších pro člověka. Jak vyplývá z sekvenování proteinů a cDNA , kravské, ovčí, králičí a myší antitrombiny mají délku 433 aminokyselin, což je o jednu aminokyselinu delší než lidský antitrombin. Předpokládá se, že extra aminokyselina se vyskytuje v aminokyselinové poloze 6. Kravské, ovčí, králičí, myší a lidské antitrombiny sdílejí mezi 84 a 89% identitou aminokyselinové sekvence. Šest z aminokyselin tvoří tři intramolekulární disulfidové vazby , Cys 8-Cys128, Cys21-Cys95 a Cys248-Cys430. Všichni mají čtyři potenciální N-glykosylační místa. Ty se vyskytují u asparaginových (Asn) aminokyselin v číslech 96, 135, 155 a 192 u lidí a v podobných počtech aminokyselin u jiných druhů. Všechna tato místa jsou obsazena kovalentně připojenými postranními řetězci oligosacharidů v převládající formě lidského antitrombinu, a-antitrombinu, což má za následek molekulovou hmotnost pro tuto formu antitrombinu 58 200. Potenciální místo glykosylace na asparaginu 135 není obsazeno v malé formě (přibližně 10%) antitrombinu, β-antitrombinu (viz obrázek 1 ).
Rekombinantní antitrombiny s vlastnostmi podobnými vlastnostem normálního lidského antitrombinu byly vyrobeny za použití hmyzích buněk infikovaných bakulovirem a buněčných linií savců pěstovaných v buněčné kultuře . Tyto rekombinantní antitrombiny mají obecně odlišné glykosylační vzorce než normální antitrombin a obvykle se používají ve strukturních studiích antitrombinu. Z tohoto důvodu mnoho antitrombinových struktur uložených v proteinové datové bance a prezentovaných v tomto článku vykazuje variabilní glykosylační vzorce.
Antitrombin začíná v původním stavu, který má ve srovnání s latentním stavem vyšší volnou energii, na kterou se v průměru rozpadne po 3 dnech. Latentní stav má stejnou formu jako aktivovaný stav - tedy když inhibuje trombin. Jako takový je klasickým příkladem použitelnosti kinetické vs termodynamické kontroly skládání bílkovin.
Funkce
Antitrombin je serpin (inhibitor serinové proteázy), a je tedy strukturou podobný většině ostatních inhibitorů plazmatické proteázy , jako je alfa 1-antichymotrypsin , alfa 2-antiplasmin a heparinový kofaktor II .
Fyziologickými cílovými proteázami antitrombinu jsou proteázy kontaktní aktivační dráhy (dříve známé jako vnitřní dráha), konkrétně aktivované formy faktoru X (Xa), faktoru IX (IXa), faktoru XI (XIa), faktoru XII (XIIa) a ve větší míře faktor II (trombin) (IIa), a také aktivovaná forma faktoru VII (VIIa) z dráhy tkáňového faktoru (dříve známá jako vnější cesta). Inhibitor také inaktivuje kalikrein a plazmin , které se také podílejí na koagulaci krve. Inaktivuje však některé další serinové proteázy, které se nepodílejí na koagulaci, jako je trypsin a podjednotka C1s enzymu C1 zapojeného do klasické dráhy komplementu .
Inaktivace proteázy je důsledkem zachycení proteázy v ekvimolárním komplexu s antitrombinem, ve kterém je aktivní místo proteázového enzymu nedostupné pro jeho obvyklý substrát . Tvorba komplexu antitrombin-proteáza zahrnuje interakci mezi proteázou a specifickou reaktivní peptidovou vazbou v antitrombinu. V lidském antitrombinu je tato vazba mezi argininem (arg) 393 a serinem (ser) 394 (viz obrázek 2 a obrázek 3 ).
Předpokládá se, že proteázové enzymy se zachytí v neaktivních komplexech antitrombin-proteáza v důsledku jejich útoku na reaktivní vazbu. Ačkoli útok na podobnou vazbu v rámci normálního proteázového substrátu vede k rychlému proteolytickému štěpení substrátu, zahájení útoku na antitrombinovou reaktivní vazbu způsobí aktivaci antitrombinu a zachycení enzymu v mezistupni proteolytického procesu. V daném čase je trombin schopen štěpit reaktivní vazbu v antitrombinu a neaktivní komplex antitrombin a trombin se disociuje, ale doba, za kterou k tomu dojde, může být delší než 3 dny. Vazby P3-P4 a P1'-P2 'však mohou být rychle štěpeny neutrofilní elastázou , respektive bakteriálním enzymem termolysinem , což vede k neaktivním antitrombinům, které již nejsou schopné inhibovat trombinovou aktivitu.
Míra inhibice proteázové aktivity antitrombinem je výrazně zvýšena jeho další vazbou na heparin , stejně jako jeho inaktivace neutrofilní elastázou .
Antitrombin a heparin
Antitrombin inaktivuje fyziologických cílových enzymů, trombin, faktor Xa a faktor IXa se rychlostních konstant z 7-11 x 10 3 , 2,5 x 10 3 M -1 s -1 a 1 x 10 M -1 s -1 , resp. Míra inaktivace antitrombin-trombin se zvyšuje na 1,5-4 x 107 M −1 s −1 v přítomnosti heparinu, tj. Reakce je zrychlena 2000–4 000krát. Inhibice faktoru Xa je zrychlena pouze 500 až 1 000krát za přítomnosti heparinu a maximální rychlostní konstanta je 10krát nižší než inhibice trombinu. Zvýšení rychlosti inhibice antitrombinového faktoru IXa ukazuje přibližně 1 milionnásobné zvýšení v přítomnosti heparinu a fyziologických hladin vápníku .
AT-III se váže na specifickou sekvenci pentasacharidové sulfatace obsaženou v heparinovém polymeru
GlcNAc/NS (6S) -GlcA-GlcNS (3S, 6S) -IdoA (2S) -GlcNS (6S)
Po navázání na tuto pentasacharidovou sekvenci je inhibice proteázové aktivity zvýšena heparinem v důsledku dvou odlišných mechanismů. V jednom mechanismu závisí heparinová stimulace inhibice faktoru IXa a Xa na konformační změně v antitrombinu zahrnující smyčku reaktivního místa, a je tedy alosterická . V jiném mechanismu stimulace inhibice trombinu závisí na tvorbě ternárního komplexu mezi AT-III, trombinem a heparinem.
Allosterická aktivace

Zvýšená inhibice faktoru IXa a Xa vyžaduje minimální sekvenci heparin pentasacharidu. Konformační změny, ke kterým dochází v antitrombinu v reakci na vazbu pentasacharidu, jsou dobře zdokumentovány.
V nepřítomnosti heparinu jsou aminokyseliny P14 a P15 (viz obrázek 3 ) ze smyčky reaktivního místa vloženy do hlavního těla proteinu (konkrétně do horní části beta listu A). Tato funkce je společná s jinými serpiny, jako je heparinový kofaktor II , alfa 1-antichymotrypsin a MENT .
Konformační změna, která je pro inhibici faktoru IXa a Xa nejrelevantnější, zahrnuje aminokyseliny P14 a P15 v N-koncové oblasti smyčky reakčního místa (zakroužkováno na obrázku 4 model B ). Tato oblast byla nazvána pantovou oblastí. Konformační změna v kloubové oblasti v reakci na vazbu heparinu vede k vypuzení P14 a P15 z hlavního těla proteinu a bylo ukázáno, že zabráněním této konformační změně nedochází ke zvýšené inhibici faktoru IXa a Xa. Má se za to, že zvýšená flexibilita daná smyčce reaktivního místa v důsledku konformační změny kloubové oblasti je klíčovým faktorem při ovlivňování zvýšené inhibice faktoru IXa a Xa. Bylo vypočteno, že v nepřítomnosti pentasacharidu je pouze jedna ze každých 400 molekul antitrombinu (0,25%) v aktivní konformaci s vyloučenými aminokyselinami P14 a P15.
Nealosterická aktivace
Zvýšená inhibice trombinu vyžaduje minimální heparin pentasacharid plus nejméně dalších 13 monomerních jednotek. Předpokládá se, že je to způsobeno požadavkem, že antitrombin a trombin se musí vázat na stejný sousední heparinový řetězec. To lze vidět na sérii modelů uvedených na obrázku 5 .
Ve strukturách ukázaných na obrázku 5 je C-koncová část (strana P ') smyčky reaktivního místa ve srovnání s jinými neaktivovanými nebo heparinem aktivovanými antitrombinovými strukturami v rozšířené konformaci. P 'oblast antitrombinu je neobvykle dlouhá ve srovnání s P' oblastí jiných serpinů a v neaktivovaných nebo heparinem aktivovaných antitrombinových strukturách tvoří těsně vodíkem vázaný p-turn . P 'prodloužení nastává porušením všech vodíkových vazeb zapojených do β-otáčky .
Kloubovou oblast antitrombinu v komplexu z obrázku 5 nebylo možné modelovat kvůli její konformační flexibilitě a v této struktuře nejsou vidět aminokyseliny P9-P14. Tato konformační flexibilita naznačuje, že v komplexu může existovat rovnováha mezi antitrombinovou konformací vloženou do smyčky reaktivního místa P14 P15 a konformací vyloučenou smyčkou reaktivního místa P14 P15. Na podporu toho analýza umístění P15 Gly v komplexu na obrázku 5 (označeném v modelu B) ukazuje, že je vložen do beta listu A (viz model C).
Vliv glykosylace na aktivitu
α-Antitrombin a β-antitrombin se liší svou afinitou k heparinu. Rozdíl v disociační konstantě mezi těmito dvěma je u pentasacharidu znázorněného na obrázku 3 trojnásobný a u heparinu s plnou délkou větší než desetinásobek, přičemž p-antitrombin má vyšší afinitu. Předpokládá se, že vyšší afinita β-antitrombinu je způsobena zvýšenou rychlostí, s níž dochází k následným konformačním změnám v proteinu po počáteční vazbě heparinu. U a-antitrombinu se nepředpokládá, že by další glykosylace na Asn-135 interferovala s počáteční vazbou heparinu, ale spíše aby inhibovala jakékoli výsledné konformační změny.
Přestože je obsah α-antitrombinu přítomen pouze v 5–10%, vzhledem ke zvýšené afinitě k heparinu se má za to, že β-antitrombin je důležitější než α-antitrombin při kontrole trombogenních příhod vyplývajících z poškození tkáně. Inhibice trombinu po poranění aorty byla skutečně přičítána pouze β-antitrombinu.
Role v nemoci
Důkaz o důležité roli, kterou hraje antitrombin při regulaci normální koagulace krve, je prokázána korelací mezi dědičnými nebo získanými nedostatky antitrombinu a zvýšeným rizikem rozvoje trombotického onemocnění u každého postiženého jedince. Nedostatek antitrombinu se obvykle projeví, když pacient trpí opakující se žilní trombózou a plicní embolií .
Získaný nedostatek antitrombinu
Získaný nedostatek antitrombinu nastává v důsledku tří zřetelně odlišných mechanismů. Prvním mechanismem je zvýšené vylučování, ke kterému může dojít při selhání ledvin spojeném s proteinurickým nefrotickým syndromem . Druhý mechanismus vyplývá ze snížené produkce, jak je patrné u selhání jater nebo cirhózy nebo nezralých jater sekundárně po předčasném porodu . Třetí mechanismus vyplývá ze zrychlené spotřeby, která je nejvýraznější v důsledku traumatu vážného poranění, ale může být také pozorována v menším měřítku v důsledku intervencí, jako je velká operace nebo kardiopulmonální bypass .
Zděděný nedostatek antitrombinu
Incidence dědičného nedostatku antitrombinu byla v normální populaci odhadována mezi 1: 2000 a 1: 5000, přičemž první rodina trpící dědičným nedostatkem antitrombinu byla popsána v roce 1965. Následně bylo navrženo, aby klasifikace dědičného nedostatku antitrombinu byla označeny buď jako typ I nebo typ II, na základě funkčních a imunochemických antitrombinových analýz. Udržení adekvátní úrovně aktivity antitrombinu, která je alespoň 70% normální funkční úrovně, je zásadní pro zajištění účinné inhibice proteáz koagulace krve. Typicky v důsledku nedostatku antitrombinu typu I nebo typu II jsou funkční hladiny antitrombinu sníženy pod 50% normálu.
Nedostatek antitrombinu typu I.
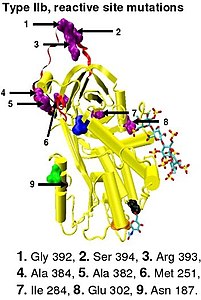
Nedostatek antitrombinu typu I je charakterizován poklesem aktivity antitrombinu i koncentrace antitrombinu v krvi postižených jedinců. Deficit typu I byl původně dále rozdělen na dvě podskupiny, Ia a Ib, na základě afinity k heparinu. Antitrombin jedinců podskupiny Ia vykazoval normální afinitu k heparinu, zatímco antitrombin jedinců podskupiny Ib vykazoval sníženou afinitu k heparinu. Následná funkční analýza skupiny případů 1b zjistila, že mají nejen sníženou afinitu k heparinu, ale také mnohočetné nebo „pleiotrofické“ abnormality ovlivňující reaktivní místo, vazebné místo pro heparin a koncentraci antitrombinu v krvi. V revidovaném systému klasifikace přijatém Vědeckým a normalizačním výborem Mezinárodní společnosti pro trombózu a hemostázu jsou případy typu Ib nyní označovány jako PE typu II, pleiotrofní účinek.
Většina případů nedostatku typu I je způsobena bodovými mutacemi , delecemi nebo menšími inzercemi v genu pro antitrombin. Tyto genetické mutace vedou k nedostatku typu I prostřednictvím řady mechanismů:
- Mutace mohou produkovat nestabilní antitrombiny, které buď nemusí být po dokončení biosyntézy správně exportovány do krve, nebo existují v krvi po kratší dobu, např. Delece 6 párů bází v kodonech 106–108.
- Mutace mohou ovlivnit zpracování mRNA genu pro antitrombin.
- Menší inzerce nebo delece mohou vést k mutacím posunu rámce a předčasnému ukončení antitrombinového genu.
- Bodové mutace mohou také vést k předčasnému generování terminačního nebo stop kodonu, např. Mutace kodonu 129, CGA → TGA ( UGA po transkripci), nahrazuje normální kodon pro arginin terminačním kodonem.
Nedostatek antitrombinu typu II
Nedostatek antitrombinu typu II je charakterizován normální hladinou antitrombinu, ale sníženou aktivitou antitrombinu v krvi postižených jedinců. Původně bylo navrženo, aby byl nedostatek typu II dále rozdělen do tří podskupin (IIa, IIb a IIc) podle toho, která funkční aktivita antitrombinu je snížena nebo zachována.
- Podskupina IIa - Snížená inaktivace trombinu, snížená inaktivace faktoru Xa a snížená afinita k heparinu.
- Podskupina IIb - Snížená deaktivace trombinu a normální afinita k heparinu.
- Podskupina IIc - Normální inaktivace trombinu, normální inaktivace faktoru Xa a snížená afinita k heparinu.
V revidovaném systému klasifikace, který znovu přijal Vědecký a normalizační výbor Mezinárodní společnosti pro trombózu a hemostázu, zůstává nedostatek antitrombinu typu II rozdělen do tří podskupin: již zmíněný PE typu II spolu s RS typu II, kde mutace ovlivňují reaktivní místo a HBS typu II, kde mutace ovlivňují vazebné místo antitrombinového heparinu. Pro účely mutační databáze antitrombinu sestavené členy podvýboru pro inhibitory srážení plazmy Vědeckého a normalizačního výboru Mezinárodní společnosti pro trombózu a hemostázu jsou případy typu IIa nyní klasifikovány jako PE typu II, případy typu IIb jako typ II RS a případy typu IIc jako typ II HBS.
Toponyma
V současné době je relativně snadné charakterizovat specifickou antitrombinovou genetickou mutaci. Avšak před použitím moderních charakterizačních technik vyšetřovatelé pojmenovali mutace pro město nebo město, kde bydlel jedinec trpící nedostatkem, tj. Antitrombinová mutace byla označena jako toponym . Moderní mutační charakterizace od té doby ukázala, že mnoho individuálních antitrombinových toponym je ve skutečnosti výsledkem stejné genetické mutace, například Antithrombin -Toyama je ekvivalentní Antihrombin -Kumamoto, -Amien, -Tours, -Paris -1, -Paris -2, -Alger, -Padua -2 a -Barcelona.
Lékařské využití
Antitrombin se používá jako proteinové terapeutikum, které lze purifikovat z lidské plazmy nebo produkovat rekombinantně (například Atryn, který se produkuje v mléce geneticky modifikovaných koz).
Antitrombin je schválen FDA jako antikoagulant pro prevenci sraženin před, během nebo po operaci nebo porodu u pacientů s dědičným nedostatkem antitrombinu.
Antitrombin byl studován u sepse ke snížení difúzní intravaskulární koagulace a dalších výsledků. Nebylo zjištěno, že by poskytoval nějaký užitek kriticky nemocným lidem se sepsí.
Štěpený a latentní antitrombin
Štěpení v reaktivním místě vede k zachycení trombinové proteázy s pohybem smyčky štěpeného reaktivního místa společně s navázanou proteázou tak, že smyčka vytvoří extra šestý pramen uprostřed beta listu A. Tento pohyb reaktivního místa smyčku lze také indukovat bez štěpení, přičemž výsledná krystalografická struktura je identická se strukturou fyziologicky latentní konformace inhibitoru-1 aktivátoru plasminogenu (PAI-1). Z tohoto důvodu se konformace antitrombinu, ve kterém je smyčka reaktivního místa začleněna neštěpená do hlavního těla proteinu, označuje jako latentní antitrombin. Na rozdíl od PAI-1 je přechod antitrombinu z normální nebo nativní konformace na latentní konformaci nevratný.
Nativní antitrombin lze převést na latentní antitrombin (L-antitrombin) samotným zahříváním nebo zahříváním v přítomnosti citrátu . Avšak bez extrémního zahřívání a při 37 ° C (tělesná teplota) se 10% veškerého antitrombinu cirkulujícího v krvi převede na L-antitrombin během 24 hodin. Struktura L-antitrombinu je znázorněna na obrázku 6 .
3-dimenzionální struktura nativního antitrombinu byla poprvé stanovena v roce 1994. Nečekaně protein krystalizoval jako heterodimer složený z jedné molekuly nativního antitrombinu a jedné molekuly latentního antitrombinu. Latentní antitrombin při tvorbě se okamžitě spojí s molekulou nativního antitrombinu za vzniku heterodimeru a analyticky lze detekovat teprve tehdy, když koncentrace latentního antitrombinu překročí 50% celkového antitrombinu. Latentní forma antitrombinu je nejen neaktivní vůči svým cílovým koagulačním proteázám, ale také jeho dimerizace s jinak aktivní nativní molekulou antitrombinu vede k deaktivaci nativních molekul. Fyziologický dopad ztráty aktivity antitrombinu buď prostřednictvím tvorby latentního antitrombinu, nebo následnou tvorbou dimeru je umocněn tím, že se preferuje dimerizace mezi β-antitrombinem aktivovaným heparinem a latentním antitrombinem na rozdíl od α-antitrombinu.
Byla také izolována forma antitrombinu, která je meziproduktem při konverzi mezi nativními a latentními formami antitrombinu a která se nazývá prelatentní antitrombin .
Antiangiogenní antitrombin
Angiogeneze je fyziologický proces zahrnující růst nových krevních cév z již existujících cév. Za normálních fyziologických podmínek je angiogeneze přísně regulována a je řízena rovnováhou angiogenních stimulátorů a angiogenních inhibitorů . Růst nádoru je závislý na angiogenezi a během vývoje nádoru je nutná trvalá produkce angiogenních stimulačních faktorů spolu se snížením množství angiogenních inhibičních faktorů, které nádorové buňky produkují. Štěpená a latentní forma antitrombinu u zvířecích modelů účinně inhibuje angiogenezi a růst nádoru. Bylo ukázáno, že prelatentní forma antitrombinu in vitro inhibuje angiogenezi, ale dosud nebyla testována na experimentálních zvířecích modelech.
Reference
Další čtení
- Panzer-Heinig, Sabine (2009). Antitrombin (III) - Stanovení pediatrických referenčních hodnot, význam pro DIC 1992 versus 2007 (práce). Medizinische Fakultät Charité - Universitätsmedizin Berlin.
externí odkazy
- Merops online databázi pro peptidáz a jejich inhibitorů: I04.018
- Antitrombin+III v Americké národní knihovně lékařských lékařských oborových nadpisů (MeSH)
- Umístění lidského genomu SERPINC1 a podrobnosti o genu SERPINC1 v prohlížeči genomu UCSC .