Umělá kost - Artificial bone
Umělá kost označuje materiál podobný kosti vytvořený v laboratoři, který lze použít v kostních štěpech , nahradit lidskou kost, která byla ztracena v důsledku těžkých zlomenin, nemocí atd.
Zlomenina kosti, která je úplným nebo částečným zlomením kosti, je velmi častým stavem, který má více než tři miliony případů v USA ročně. Lidské kosti mají schopnost regenerovat se cyklem resorpce a tvorby kostí. Buňka zodpovědná za resorpci kosti je osteoklast , zatímco buňka zodpovědná za tvorbu kosti je osteoblast. Jak již bylo řečeno, lidské tělo může regenerovat zlomeninu kosti. Pokud je však poškození kosti způsobeno nemocí nebo vážným zraněním, je pro tělo obtížné se samo opravit. Když lidské tělo není schopno regenerovat ztracenou kostní tkáň, přijdou chirurgové a nahradí chybějící kost pomocí autograftů, aloštěpů a syntetických štěpů (umělá kost). Při srovnání umělé kosti s autograftem a alograftem je méně invazivní a více biokompatibilní, protože se vyhýbá riziku neznámých virových infekcí.
Při navrhování implantovaných biomateriálů jsou klíčovými kritérii biokompatibilita , osteokonduktivita , vysoká pórovitost a kompatibilita biomechaniky. Umělá kost byla původně vyrobena z materiálů, jako jsou kovy a pevná keramika, které jsou dostatečně pevné, aby udržely zatížení v kosti. Tuhost těchto materiálů však představovala pro pacienty enormní zátěž a nebyla v souladu s kritérii pro implantaci biomateriálů. Umělé kosti vyrobené z kovu a keramiky mají z hlediska biokompatibility tendenci špatně fungovat, protože je obtížné přimíchat se do kostních tkání. Aby tedy lépe pomohli těm, kteří potřebují žít pohodlnější život, vyvinuli inženýři nové techniky k výrobě a navrhování lepší struktury a materiálu umělé kosti.
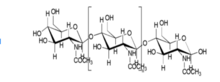
Dvě hlavní složky kosti jsou hydroxyapatit [Ca10 (PO4) 6 (OH) 2] a kolagenová vlákna. Hydroxyapatit, který je jednou z nejstabilnějších forem fosforečnanu vápenatého, tvoří asi 60 až 65 procent kosti. Zbytek kosti se skládá z materiálů včetně chondroitin sulfátu , keratansulfátu a lipidu . Rozšířený výzkum a znalosti týkající se organizace, struktury vlastností kolagenu a hydroxyapatitu vedly k mnoha vývojům v lešení na bázi kolagenu v inženýrství kostní tkáně. Struktura hydroxyapatitu je velmi podobná původní kosti a kolagen může působit jako molekulární kabely a dále zlepšovat biokompatibilitu implantátu.
Přehled
Demografie poranění kosti
Ve Spojených státech bylo každoročně hlášeno více než 6,5 milionu kostních defektů a více než 3 miliony případů poranění obličeje. Celosvětově se ročně provede více než 2,2 milionu zákroků kostního štěpu. Běžnými příčinami kostního štěpu jsou resekce nádoru, vrozené vývojové vady, trauma, zlomeniny, chirurgický zákrok, osteoporóza a artritida. Podle National Ambulatory Medical Care Survey (NAMCS), v roce 2010, tam bylo přibližně 63 milionů návštěv ortopedické chirurgie oddělení a asi 3,5 milionu návštěv pro zlomeniny na pohotovostních odděleních v USA Mezi 6,5 milionu zlomenin kostí nebo defektních případů, bylo hospitalizováno přibližně 887 679 lidí.
Aktuální oblasti kostního štěpu (typy kostí, kompozity)
Výzkum typů materiálů při roubování kostí se tradičně soustředil na produkci kompozitů organických polysacharidů ( chitin , chitosan , alginát ) a minerálů ( hydroxyapatit ). Alginátová lešení, složená ze zesítěných iontů vápníku, se aktivně zkoumají při regeneraci kůže, jater a kostí. Alginátova schopnost lešení a činí z něj nový polysacharid. Přestože mnoho minerálů může být upraveno pro složení kostí, hydroxyapatit zůstává dominantním materiálem, protože jeho síla a známý Jager-Fratzlův model lidské kosti poskytují již existující rámec pro rozestupy a výrobu.
Druhy materiálů
Materiály vhodné pro použití v umělých kostech musí být biokompatibilní, osteokonduktivní a mechanicky pevné. Hydroxyapatit se často používá ve studiích umělých kostí, protože má biokompatibilitu a osteokonduktivitu požadovanou pro účinný, dlouhotrvající kostní implantát, ale je poměrně křehký a dále vykazuje rychlost rozpouštění přibližně 10% hmotnostních za rok, což je výrazně pomalejší než rychlost růstu nově vytvořené kosti, což vyžaduje opatření ke zvýšení rychlosti jejího rozpouštění. Pro aplikace, které vyžadují materiál s lepší houževnatostí, lze použít nanostrukturovanou umělou perlu díky její vysoké pevnosti v tahu a Youngovu modulu . V mnoha případech použití jednoho druhu materiálu omezuje možnosti umělého kostního implantátu, takže se používají kompozity. Implantáty složené z chitosanu a hydroxyapatitu využívají výhod biokompatibility chitosanu a jeho schopnosti být tvarovány do složitých porézních tvarů a také osteokonduktivity hydroxyapatitu k vytvoření kompozitu, který obsahuje všechny tři vlastnosti. Jiné kompozity vhodné pro použití v umělé kosti jsou kompozity používající alginát, biopolymer známý svými vlastnostmi vytvářejícími lešení. Použití pro alginát v kompozitech zahrnuje chitosanové kompozity pro opravu kostní tkáně, kompozity z bioskla pro opravu nebo výměnu vadné nebo nemocné kosti nebo keramicko-kolagenové kompozity pro regeneraci kostí. Materiál použitý v umělém kostním implantátu nakonec závisí na typu vytvářeného implantátu a jeho použití.
3D tisk umělých kostí
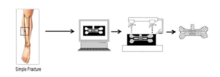
3D tisk se stává efektivním způsobem výroby umělých kostí. Nejprve je vytvořen model kosti pomocí rekonstrukce obrazů CAT skenu získaných od pacienta. Poté se umělé kostní materiály použijí jako „vlákno“ pro 3D tisk. Podle štěpů s rozlišením by byl 3D model kosti rozdělen do několika vrstev. Tiskárna by vytiskla vrstvu, pak další na poslední a nakonec vyrobila umělá kost. Většina nejnovějších studií ukazuje, že nanokrystaly hydroxyapatitu (HA) jsou ideálním materiálem pro 3D tištěné umělé kosti. Nanokrystaly HA jsou syntetizovány mokrou syntézou za použití fosforečnanu diamonného a chloridu vápenatého jako prekurzoru fosforu a vápníku. Kromě toho může polykaprolakton (PCL) v některých výzkumných zprávách se také používá k výrobě umělé kosti ve 3D tisku. Ve srovnání s opravou poškozených kostí by technologie 3D tisku mohla produkovat implantáty, které splňují personalizované potřeby opravy. Na druhé straně techniky 3D tisku produkují implantáty s několika nepříznivými účinky na pacienty. Hostitelské buňky různých klasifikací, jako jsou lymfocyty a erytrocyty, vykazují minimální imunologickou odpověď na vědecké ial štěpy.
Výhody
Vlastnosti materiálu
Účinné materiály pro náhradu kostí by měly vykazovat dobrou mechanickou pevnost spolu s adekvátní bioaktivitou. Bioaktivitu, která je často měřena z hlediska rychlosti rozpouštění a tvorby minerální vrstvy na povrchu implantátu in-vivo, lze zvýšit u biomateriálů, zejména hydroxyapatitu, úpravou složení a struktury dopingem. Jako alternativa k hydroxyaptatitovým systémům byly kompozity Chitosan důkladně studovány jako jeden materiál pro použití pro umělou kost. Chitosan může být sám o sobě snadno modifikován do složitých tvarů, které obsahují porézní struktury, což je vhodné pro růst buněk a osteokondukci. Chitosanová lešení jsou navíc biokompatibilní a biologicky rozložitelná, ale mají nízkou houževnatost a samotný materiál není osteokonduktivní. Hydroxyapatit na druhé straně má vynikající biokompatibilitu, ale brání mu jeho křehká povaha. Při použití s hydroxyapatitem jako kompozitem se houževnatost i osteokonduktivita výrazně zlepšují, což z kompozitu činí schůdnou možnost pro materiál pro umělou kost. Chitosan lze také použít s uhlíkovými nanotrubičkami, které mají vysoký Youngův modul (1,0–1,8 TPa), pevnost v tahu (30–200 GPa), prodloužení při přetržení (10–30%) a poměr stran (> 1 000). Uhlíkové nanotrubičky jsou velmi malé, chemicky a strukturně stabilní a bioaktivní. Kompozit tvořený uhlíkovými nanotrubičkami a chitosanem výrazně zlepšuje houževnatost chitosanu. Nanostrukturovaná umělá perleť je další možností pro vytváření umělé kosti. Přírodní perleť se skládá z uspořádání organických a anorganických vrstev podobných cihelám a maltě. To spolu s iontovým zesíťováním pevně složených molekul umožňuje perleti vysokou pevnost a houževnatost. Umělá perleť, která napodobovala jak strukturu, tak účinek iontových vazeb, měla pevnost v tahu podobnou přirozené perleti a také konečný Youngův modul podobný lamelární kosti. Z mechanického hlediska by tento materiál byl životaschopnou volbou pro umělou kost.
Úvaha o designu
Klinické výsledky
Před implementací návrhu do pacienta je třeba zvážit několik aspektů jakékoli konstrukce umělé kosti. Umělé kostní implantáty, které nejsou vhodné pro pacienta v důsledku událostí, jako je ponechání kosti příjemce bez fixace, mohou způsobit zarudnutí a otok v oblasti příjemce. Implantáty špatně přizpůsobené mohou být také způsobeny slinováním , které může způsobit rozměrovou kontrakci implantátu až o 27%. Osteokonduktivita je dalším důležitým faktorem pro návrh umělé kosti. Slinuté materiály zvyšují krystalinitu fosforečnanu vápenatého v některých umělých kostech, což vede ke špatné resorpci osteoklasty a zhoršené biologické rozložitelnosti . Jedna studie se tomu vyhnula vytvořením inkoustově potištěných, na míru vyrobených umělých kostí, které využívaly α-trikalciumfosfát (TCP), materiál, který se přeměňuje na hydroxyapatit a zpevňuje implantát bez použití slinování. Α-TCP je navíc biokompatibilní a pomáhá vytvářet novou kost, což je pro pacienty dlouhodobě lepší. Umělé kostní vzory musí být biokompatibilní, musí mít osteokonduktivitu a musí trvat dlouhou dobu uvnitř pacienta, aby byly životaschopným řešením ve srovnání s autologními a alogenními kostními implantáty.
Výzvy
Vlastnosti povrchu
Umělé štěpy si udržují srovnatelnou pevnost v tlaku, ale příležitostně postrádají podobnost s lidskou kostí v reakci na boční nebo třecí síly. Zejména topografie umělé kosti je ve srovnání s jejím přirozeným protějškem nepřesná. V Grant et al., Umělé kostní štěpy vyrobené fúzním ukládáním měly v průměru o 20% nižší koeficient tření ve srovnání se skutečnou kostí. Zatímco CT skeny a následné kostní modely velmi svědčí o skutečné kosti pro vnitřní složení, konečný produkt se spoléhá na rozlišení tiskárny. V případech, kdy dojde k vadám tiskárny, je nejpravděpodobnějším problémem snížení pevnosti v tlaku v důsledku neúmyslných dutin. Po implantaci je patrná snížená buněčná proliferace a diferenciace s rostoucím věkem pacientů. To prodlužuje integraci štěpů a brání tvorbě kostní tkáně. U zvířecích modelů způsobuje začlenění aloštěpů tvorbu teratomů . Zda se pravděpodobnost této události výrazně zvýší nebo ne, se teprve uvidí. K napodobení kostry těla je tedy nutné lešení s jinými biologickými činidly. Kolagen typu I , který tvoří významnou část organické hmoty kosti, je často používaným lešenářským činidlem. Alternativně má polymer chitosan podobnou biologickou odpověď, konkrétně podporu osteogeneze in vivo.
Omezení výroby
Mezi modernější výrobní techniky patří inkoustový tisk. V jedné studii vyrobila 3D inkoustová tiskárna autograftové implantáty pro dolní čelist 10 pacientů. Implantát hydroxyapatitu byl vyroben z prášku fosforečnanu vápenatého, který po hydrataci ztvrdl. Chirurgický zákrok byl proveden z estetického i funkčního hlediska. Všichni pacienti indikovali spokojenost s kostním produktem. V jiné studii, která zkoumala replikované kozí stehenní kosti, byly nanokrystaly hydroxyapatitu vyrobeny a smíchány na místě před načtením 3D tiskárny. Studie zaznamenala mírný pokles pevnosti stehenních kostí v tlaku, což lze přičíst nedokonalému tisku a zvýšenému poměru spongiózní kosti . Obecně techniky 3D tisku produkují implantáty s několika nežádoucími účinky u pacientů. Hostitelské buňky různých klasifikací, jako jsou lymfocyty a erytrocyty , vykazovaly minimální imunologickou odpověď na umělé štěpy. Pouze v případě nesprávné sterilizace nebo předchozí predispozice k infekci došlo k výrazným komplikacím. Rychlost tisku je primárním krokem omezujícím rychlost při výrobě umělé kosti. V závislosti na typu kostního implantátu se doba tisku může pohybovat od hodiny do několika. Protože tiskárny produkují grafty s vyšším rozlišením, úměrně se prodlužuje doba tisku.
Biologická odpověď
Výzkum umělých kostních materiálů ukázal, že bioaktivní a resorbovatelné silikátové brýle ( biosklo ), sklokeramika a fosforečnany vápenaté vykazují mechanické vlastnosti, které jsou podobné lidské kosti. Podobné mechanické vlastnosti nezajišťují biokompatibilitu. Biologická reakce těla na tyto materiály závisí na mnoha parametrech, včetně chemického složení, topografie, pórovitosti a velikosti zrn. Pokud je materiál kovový, existuje riziko koroze a infekce. Pokud je materiál keramický, je obtížné vytvořit požadovaný tvar a kost kvůli jeho vysoké krystalinitě nemůže znovu vstřebat nebo jej nahradit. Hydroxyapatit na druhé straně prokázal vynikající vlastnosti při podpoře adheze, diferenciace a proliferace buňky osteogeneze, protože je termodynamicky stabilní a bioaktivní. Umělé kosti využívající hydroxyapatit v kombinaci s kolagenovou tkání pomáhají vytvářet nové kosti v pórech a mají silnou afinitu k biologickým tkáním při zachování uniformity se sousední kostní tkání. Navzdory svému vynikajícímu výkonu v interakci s kostní tkání má hydroxyapatit kvůli vysoké krystalinitě stejný problém jako keramika. Protože je hydroxyapatit zpracováván při vysoké teplotě, je nepravděpodobné, že zůstane ve stabilním stavu.