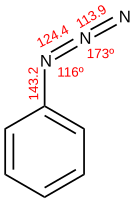Azide - Azide
Azid je aniont vzorce N-
3. To je konjugovaná báze z kyseliny azidovodíkové (HN 3 ). N.-
3je lineární aniont, který je izoelektronický s CO 2 , NCO - , N 2 O , NO+
2a NCF . Podle teorie valenčních vazeb může být azid popsán několika rezonančními strukturami ; důležitá bytost . Azid je také funkční skupina v organické chemii , RN 3 .
Dominantní aplikace azidů je jako pohonná látka ve vzduchových vakech .
Dějiny
Fenylazid („diazoamidobenzol“), připravil v roce 1864 Peter Griess reakcí čpavku a fenyldiazonia . V devadesátých letech 19. století popsal Theodor Curtius , který objevil kyselinu hydrazoovou (HN 3 ), přestavbu acylazidů na isokyanáty a následně pojmenoval Curtiusův přesmyk . Rolf Huisgen popsal stejnojmennou 1,3-dipolární cykloadici.
Zájem o azidy mezi organickými chemiky byl relativně malý kvůli hlášené nestabilitě těchto sloučenin. Situace se dramaticky změnila objevem Sharpless et al. Cu-katalyzovaných (3+2) -cykloadic mezi organickými azidy a koncovými alkyny. Azido- a alkinové skupiny jsou „ bioorthogonální “, což znamená, že neinteragují s živými systémy a současně procházejí působivě rychlou a selektivní vazbou. Tento typ formální 1,3-dipolární cykloadice se stal nejslavnějším příkladem takzvané „ klikací chemie “ (možná jedinou známou laikovi) a pole organických azidů explodovalo.
Příprava
Anorganické azidy
Azid sodný se vyrábí průmyslově reakcí oxidu dusného , N 2 O s amidem sodným v kapalném amoniaku jako rozpouštědle:
- N 2 O + 2 NaNH 2 → NaN 3 + NaOH + NH 3
Mnoho anorganických azidů lze připravit přímo nebo nepřímo z azidu sodného. Například azid olova , používaný v rozbuškách , může být připraven z reakce metateze mezi dusičnanem olovnatým a azidem sodným. Alternativní cestou je přímá reakce kovu s azidem stříbrným rozpuštěným v kapalném amoniaku. Některé azidy se vyrábějí zpracováním uhličitanových solí kyselinou hydrazoovou .
Organické azidy
Jako pseudohalogenid azid obecně vytěsňuje mnoho odstupujících skupin (např. Br - , I - , OTs - ) za vzniku azidové sloučeniny. Arylazidy lze připravit vytlačením příslušné diazoniové soli azidem sodným nebo trimethylsilylazidem ; nukleofilní aromatická substituce je také možná, dokonce s chloridy. Aniliny a aromatické hydraziny procházejí diazotací , stejně jako alkylaminy a hydraziny.
Vhodně funkcionalizované alifatické sloučeniny procházejí nukleofilní substitucí azidem sodným. Alifatické alkoholy poskytují azidy prostřednictvím varianty Mitsunobuovy reakce za použití kyseliny hydrazoové . Hydraziny mohou také tvořit azidy reakcí s dusitanem sodným :
Alkyl nebo aryl acylchloridy reagují s azidem sodným ve vodném roztoku za vzniku acylazidů , které v Curtiusově přesmyku poskytují isokyanáty .
Sloučeniny azo-přenosu, trifluormethansulfonyl azid a imidazol-1-sulfonyl azid , se připravují také z azidu sodného. Reagují s aminy za vzniku odpovídajících azidů:
- RNH 2 → RN 3
Některé běžné způsoby syntézy alkylazidů jsou uvedeny v následujícím schématu. Metodou volby bezpochyby zůstává jednoduchá nukleofilní substituce vhodné odstupující skupiny azidovým aniontem. Odstupující skupinou může být halogenid , sulfonát a další. Zdrojem azid je nejčastěji azid sodný (NaN 3 ), i když lithium azid (Lin 3 ), trimethylsilylazidem (TMSN 3 ), a tributylcínazidu (Bu 3 SNN 3 ), byly používány. Mikrovlnné a enantioselektivní modifikace reakce jsou také známé. Alkoholy lze převést na azidy v jednom kroku za použití 2-azido-1,3-dimethylimidazolinium hexafluorfosfátu (ADMP) nebo za podmínek Mitsunobu s difenylfosforylazidem (DPPA). Hydroxy- a aminoazidy jsou přístupné štěpením epoxidového a aziridinového kruhu. Diazo přenos na aminy za použití trifluormethansulfonyl azid TFN 3 a tosyl azidu (TSN 3 ) byla hlášena. V posledních letech přímá hydroazidation z alkenů se stává stále více populární.
Dutt – Wormallova reakce
Klasickou metodou syntézy azidů je Dutt -Wormallova reakce, při které diazoniová sůl reaguje se sulfonamidem nejprve na diazoaminosulfinát a poté při hydrolýze azid a kyselinu sulfinovou .
Reakce
Anorganické azidy
Azidové soli se mohou rozkládat uvolňováním plynného dusíku. Teploty rozkladu azidů alkalických kovů jsou: NaN 3 (275 ° C), KN 3 (355 ° C), RBN 3 (395 ° C), a ČSN 3 (390 ° C). Tato metoda se používá k výrobě ultračistých alkalických kovů.
Protonace azidových solí poskytuje toxickou kyselinu hydrazoovou v přítomnosti silných kyselin:
- H + + N.-
3 → HN 3
Azidové soli mohou reagovat s těžkými kovy nebo sloučeninami těžkých kovů za vzniku odpovídajících azidů, které jsou citlivější na nárazy než samotný azid sodný. Při okyselení se rozkládají dusitanem sodným. Toto je metoda ničení zbytkových azidů před likvidací.
- 2 NaN 3 + 2 HNO 2 → 3 N 2 + 2 NO + 2 NaOH
Bylo popsáno mnoho anorganických kovalentních azidů (např. Chlor, brom a jod azidy).
Azidový anion se chová jako nukleofil; prochází nukleofilní substitucí za alifatický i aromatický systém. Reaguje s epoxidy, což způsobuje otevření kruhu; podstoupí přidání Michaelova konjugátu k 1,4-nenasyceným karbonylovým sloučeninám.
Azidy mohou být použity jako prekurzory pro přípravu kovových komplexů nitrido tím, že je indukována k uvolnění N 2 , vytvářející kovový komplex v neobvyklých oxidačních stavů (viz vysoké elementárního železa ).
Organické azidy
Organické azidy se účastní užitečných organických reakcí . Koncový dusík je mírně nukleofilní. Azidy snadno vytlačují diatomický dusík , což je tendence, která se využívá v mnoha reakcích, jako je Staudingerova ligace nebo Curtiusův přesmyk .
Azidy mohou být redukovány na aminy podle hydrogenolýzou nebo fosfinu (např trifenylfosfin ) v reakci Staudinger . Tato reakce umožňuje, azidy, aby sloužil jako chráněná -NH 2 synthonů, jak je znázorněno na syntézu 1,1,1-tris (aminomethyl) ethan :
- 3 H 2 + CH 3 C (CH 2 N 3 ) 3 → CH 3 C (CH 2 NH 2 ) 3 + 3 N 2
V azidové alkynové Huisgenově cykloadici reagují organické azidy jako 1,3-dipoly a reagují s alkyny za vzniku substituovaných 1,2,3-triazolů .
Další azidový pravidelný je tosylazid zde v reakci s norbornadienem při reakci zavádění dusíku:
Aplikace
Ročně se vyrobí asi 250 tun sloučenin obsahujících azid, přičemž hlavním produktem je azid sodný.
Rozbušky a pohonné hmoty
Azid sodný je hnací plyn v automobilových airbagech . Při zahřívání se rozkládá a vzniká plynný dusík, který se používá k rychlému roztažení airbagu:
- 2 NaN 3 → 2 Na + 3 N 2
Soli těžkých kovů, jako je azid olovnatý , Pb (N 3 ) 2 , jsou rozbušky citlivé na otřesy, které se rozkládají na odpovídající kov a dusík, například:
- Pb (N 3 ) 2 → Pb + 3 N 2
Podobně se používají soli stříbra a barya. Některé organické azidy jsou potenciálními raketovými pohonnými hmotami, příkladem je 2-dimethylaminoethylazid (DMAZ).
jiný
Vzhledem k nebezpečím spojeným s jejich používáním se několik azidů používá komerčně, i když pro výzkumníky vykazují zajímavou reaktivitu. Azidy s nízkou molekulovou hmotností jsou považovány za zvláště nebezpečné a vyhýbá se jim. Ve výzkumné laboratoři jsou azidy prekurzory aminů . Oni jsou také populární pro jejich účast v " click reakce " a Staudinger ligace . Tyto dvě reakce jsou obecně docela spolehlivé a jsou vhodné pro kombinatorickou chemii .
Některé azidy jsou cenné jako bioorthogonální chemické reportéry , molekuly, na které lze „kliknout“, aby viděli metabolickou cestu, kterou prošla uvnitř živého systému.
Antivirové léčivo zidovudin (AZT) obsahuje azidovou skupinu.
Azid sodný se používá jako biocid k prevenci poruch a artefaktů z nekontrolovaného mikrobiálního růstu v laboratorních experimentech (vodné roztoky, suspenze, kaše ...).
Bezpečnost
- Azidy jsou výbušniny a toxiny.
- Azid sodný je toxický (jako kyanid sodný ) (s orálním LD 50 27 mg/kg u potkanů) a může být absorbován kůží. Po zahřátí na více než 275 ° C se explozivně rozkládá a prudce reaguje s CS 2 , bromem , kyselinou dusičnou , dimethylsulfátem a řadou těžkých kovů, včetně mědi a olova . V reakci s Brønstedovými kyselinami se uvolňuje vysoce toxický výbušný vodík .
- Těžké kovy azidy, jako je azid olovnatý jsou primární vysoce explozivní výbušniny nedetonuje při zahřátí nebo protřepe. Azidy těžkých kovů se tvoří, když se roztoky azidu sodného nebo par HN 3 dostanou do kontaktu s těžkými kovy nebo jejich solemi. Azidy těžkých kovů se mohou za určitých okolností hromadit, například v kovových potrubích a na kovových součástech různých zařízení ( rotační odparky , mrazicí zařízení, chladicí pasti, vodní lázně, odpadní potrubí), a vést tak k prudkým výbuchům.
- Některé organické a jiné kovalentní azidy jsou klasifikovány jako vysoce výbušné a toxické: anorganické azidy jako neurotoxiny; azidové ionty se podobně jako kyanidové ionty chovají jako inhibitory oxidázy cytochromu c .
- Bylo publikováno, že azid sodný a azidová činidla vázaná na polymer reagují s di- a trihalometany za vzniku di- a triazidomethanu, které jsou oba nestabilní, aniž by se s nimi manipulovalo v roztocích. Během koncentrace reakčních směsí v rotačních odparkách byly hlášeny různé výbuchy. Rizika diazidomethanu (a triazidomethanu) byla dobře zdokumentována.
- Pevné halogenidové azidy jsou velmi výbušné a neměly by být připravovány bez rozpouštědla.
Viz také
Reference
![]() Tento článek včlení text od Oleksandra Zhurakovskyi dostupný pod licencí CC BY 2.5 .
Tento článek včlení text od Oleksandra Zhurakovskyi dostupný pod licencí CC BY 2.5 .