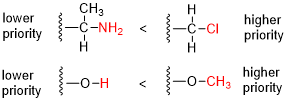Pravidla priority Cahn – Ingold – Prelog - Cahn–Ingold–Prelog priority rules
Cahn-Ingold-Prelog ( CIP ) pravidla sekvence , pojmenovaný pro organické chemiky Robert Sidney Cahn , Christopher Kelk Ingold a Vladimír Prelog - alternativně nazývané prioritní CIP pravidla , systém , či konvence - jsou standardní proces používaný v organické chemii zcela a jednoznačně pojmenovat stereoizomer molekuly. Účelem systému CIP je přiřadit R nebo S deskriptor každému stereocentru a E nebo Z deskriptor každé dvojné vazbě tak, aby konfiguraci celé molekuly bylo možné specifikovat jednoznačně zahrnutím deskriptorů do jejího systematického názvu. Molekula může obsahovat libovolný počet stereocenter a libovolný počet dvojných vazeb a každá obvykle vede ke vzniku dvou možných izomerů. Molekula s celým číslem n popisujícím počet jejích stereogenních center bude mít obvykle 2 n stereoizomerů a 2 n -1 diastereomerů, z nichž každý má přidružený pár enantiomerů. Pravidla sekvence CIP přispívají k přesnému pojmenování každého stereoizomeru každé organické a organokovové molekuly se všemi atomy liganity menší než 4 (ale včetně ligancy také 6, tento termín označuje „počet sousedních atomů“ vázaných na centrum).
Klíčový článek stanovující pravidla posloupnosti CIP byl publikován v roce 1966 a poté následovala další upřesnění, než byl začleněn do pravidel Mezinárodní unie pro čistou a aplikovanou chemii (IUPAC), oficiálního orgánu, který definuje organické názvosloví , v 1974. Pravidla byla od té doby revidována, naposledy v roce 2013, jako součást knihy IUPAC Nomenclature of Organic Chemistry . Prezentace pravidel IUPAC představuje oficiální formální standard pro jejich používání a uvádí, že „metoda byla vyvinuta tak, aby pokrývala všechny sloučeniny s ligancí do 4 ... a… [rozšířeno na případ] ligancy 6… [stejně jako] pro všechny konfigurace a konformace takových sloučenin. “ Přesto, ačkoli dokumentace IUPAC představuje důkladný úvod, obsahuje upozornění, že „je nezbytné prostudovat původní dokumenty, zejména papír z roku 1966, před použitím pravidla posloupnosti pro jiné než poměrně jednoduché případy“.
Nedávný článek argumentuje změnami v některých pravidlech (pravidla sekvence 1b a 2), aby se řešily určité molekuly, pro které byly správné deskriptory nejasné. Zůstává však jiný problém: ve vzácných případech mohou mít dva různé stereoizomery stejné molekuly stejné CIP deskriptory, takže systém CIP nemusí být schopen jednoznačně pojmenovat stereoizomer a mohou být výhodnější jiné systémy.
Kroky pro pojmenování
Kroky pro pojmenování molekul pomocí systému CIP jsou často prezentovány jako:
- Identifikace stereocenter a dvojných vazeb ;
- Přiřazení priorit ke skupinám připojeným ke každému stereocentru nebo atomu dvojné vazby; a
- Přiřazení deskriptorů R / S a E / Z.
Přiřazení priorit
R / S a E / Z deskriptory jsou přiřazeny pomocí systému pro hodnocení priority skupin připojených ke každému stereocentru. Tento postup, často známý jako pravidla sekvence , je srdcem systému CIP. Přehled v této části vynechává některá pravidla, která jsou potřeba pouze ve výjimečných případech.
- Porovnejte atomové číslo ( Z ) atomů přímo připojených ke stereocentru; skupina mající atom vyššího atomového čísla dostává vyšší prioritu.
- Pokud existuje shoda, musíme uvažovat o atomech ve vzdálenosti 2 od stereocentra - protože se vytváří seznam pro každou skupinu atomů vázaných k jednomu přímo připojenému k stereocentru. Každý seznam je seřazen podle klesajícího atomového čísla. Poté jsou seznamy porovnány atom po atomu; při nejbližším rozdílu dostane skupina obsahující atom vyššího atomového čísla vyšší prioritu.
- Pokud stále existuje shoda, každý atom v každém ze dvou seznamů je nahrazen sublistem ostatních atomů, které jsou k němu připojeny (ve vzdálenosti 3 od stereocentra), jsou sublisty uspořádány v sestupném pořadí atomového čísla a celý struktura se opět porovnává atom po atomu. Tento proces se opakuje rekurzivně, pokaždé s atomy o jednu vazbu dále od stereocentra, dokud se nerozdělí vazba.
Izotopy
Pokud se dvě skupiny liší pouze izotopy , pak se k nastavení priority použije větší atomová hmotnost .
Dvojité a trojité vazby
Pokud je atom A dvojitě vázán k atomu B, je s A zacházeno jako s jednotlivě vázaným ke dvěma atomům: B a „fantomovému atomu“, který je duplikátem B (má stejné atomové číslo), ale není k ničemu připojen kromě A. Je -li B nahrazen seznamem připojených atomů, je vyloučen samotný A, ale nikoli jeho „fantom“, v souladu s obecnou zásadou, že se zdvojnásobí zpět podél vazby, která byla právě následována. Trojná vazba se zpracovává stejným způsobem, kromě toho, že A a B jsou každý spojen se dvěma fantomovými atomy druhého.
Geometrické izomery
Pokud jsou dva substituenty na atomu navzájem geometrickými izomery , má Z -izomer vyšší prioritu než E -izomer.
Cyklické molekuly
Aby člověk zvládl molekulu obsahující jeden nebo více cyklů , musí ji nejprve rozšířit do stromu (nazývaného hierarchický digraf ) procházením vazeb všemi možnými cestami začínajícími ve stereocentru. Když traversal narazí na atom, kterým již prošla aktuální cesta, generuje se fantomový atom, aby byl strom konečný. Jediný atom původní molekuly se může na stromě objevit na mnoha místech (některé jako fantomy, některé ne).
Přiřazení deskriptorů
Stereocentra: R / S
Po substituenty příslušníky stereocentra byly přiřazeny jejich priority, je molekula orientována v prostoru tak, že skupina s nejnižší prioritou je zaměřeno směrem od pozorovatele. Pokud jsou substituenty očíslovány od 1 (nejvyšší priorita) do 4 (nejnižší priorita), pak stereoisomery rozlišuje smysl otáčení křivky procházející 1, 2 a 3 . Střed se smyslem otáčení ve směru hodinových ručiček je střed R ( rectus ) a střed se smyslem otáčení proti směru hodinových ručiček je S ( zlověstný ) střed. Názvy jsou odvozeny z latiny pro „pravý“ a „levý“.
Praktická metoda, jak určit, zda je enantiomer R nebo S, je pomocí pravidla pravé ruky : molekulou se obalí prsty ve směru 1 → 2 → 3 . Pokud palec ukazuje ve směru čtvrtého substituentu, enantiomer je R ; v opačném případě je S .
Ve vzácných případech je možné, že se dva substituenty na atomu liší pouze svou absolutní konfigurací ( R nebo S ). Pokud je třeba stanovit relativní priority různých substituentů, R má přednost před S . Když k tomu dojde, deskriptor stereocentra je místo běžně používaných velkých písmen malé písmeno ( r nebo s ).
Dvojité vazby: E / Z
U alkenů a podobných dvojných vazebných molekul se postupuje stejně jako u substituentů. V tomto případě záleží na umístění dvou substituentů s nejvyšší prioritou vzhledem k dvojné vazbě. Pokud jsou oba substituenty s vysokou prioritou na stejné straně dvojné vazby, tj. V cis konfiguraci , pak je stereoizomeru přiřazen Z ( zusammen ). Pokud jsou naopak v trans konfiguraci , pak je stereoizomeru přiřazeno E ( entgegen ). V tomto případě jsou identifikační písmena odvozena z němčiny pro „společně“ a „opačně“.
Příklady
Níže jsou uvedeny příklady použití nomenklatury.
Přiřazení R / S pro několik sloučenin Hypotetická molekula bromchlorfluorjodomethan uvedená v ( R ) -konfiguraci by byla velmi jednoduchou chirální sloučeninou. Priority jsou přiřazeny na základě atomového čísla ( Z ): jód ( Z = 53)> brom ( Z = 35)> chlor ( Z = 17)> fluor ( Z = 9). Umožnění fluoru (nejnižší priorita) směřovat od diváka k rotaci ve směru hodinových ručiček, proto je přiřazení R. V přiřazení L -serin nejvyšší prioritou je kladen na dusíku atomu ( Z = 7) ve aminové skupiny (NH 2 ). Oba hydroxymethyl skupina (CH 2 OH) a kyselina karboxylová skupina (-COOH) mají atomy uhlíku ( Z = 6), ale přednost se dává druhé proto, že atom uhlíku ve skupině COOH je spojena s druhou kyslíku ( Z = 8 ), zatímco v CH 2 OH skupiny uhlíku je připojen k vodíku atom ( z = 1). Nejnižší priorita je dána na atom vodíku a jak tomuto atomu bodů od diváka pokles proti směru hodinových ručiček v prioritu než tři zbývající substituenty dokončí úkol jako S . Stereocentrum v ( S ) -karvonu je spojeno s jedním atomem vodíku (není ukázáno, priorita 4) a třemi atomy uhlíku. Isopropenylová skupina má prioritu 1 (pouze atomy uhlíku) a u dvou zbývajících atomů uhlíku je priorita rozhodnuta, přičemž ze atomů uhlíku jsou odstraněny dvě vazby, jedna část keto skupiny (O, O, C, priorita 2) a jedna část alkenu (C, C, H, priorita 3). Získané výsledky proti směru hodinových ručiček v S .
Popis několika center
Pokud sloučenina obsahuje více než jedno chirální stereogenní centrum a každá stanice je označován buď R nebo S . Například efedrin existuje ve (1 R , 2 S ) a (1 S , 2 R ) stereoizomerech, které jsou navzájem odlišnými zrcadlově podobnými formami, což z nich činí enantiomery . Tato sloučenina také existuje jako dva enantiomery napsané (1 R , 2 R ) a (1 S , 2 S ), které jsou pojmenovány spíše pseudoefedrin než efedrin. Všechny čtyři tyto izomery jsou v systematickém názvosloví pojmenovány 2-methylamino-1-fenyl-1-propanol. Efedrin a pseudoefedrin jsou však diastereomery nebo stereoizomery, které nejsou enantiomery, protože nejsou příbuzné jako kopie zrcadlového obrazu. Pseudoefedrin a efedrin mají různá jména, protože jako diastereomery mají různé chemické vlastnosti, dokonce i pro racemické směsi každého z nich.
Obecněji platí, že pro jakýkoli pár enantiomerů jsou všechny deskriptory opačné: ( R , R ) a ( S , S ) jsou enantiomery, stejně jako ( R , S ) a ( S , R ). Diastereomery mají alespoň jeden společný deskriptor; například ( R , S ) a ( R , R ) jsou diasteriomery, stejně jako ( S , R ) a ( S , S ). To platí také pro sloučeniny, které mají více než dvě stereocentra: pokud mají dva stereoizomery společný alespoň jeden deskriptor, jsou to diastereomery. Pokud jsou všechny deskriptory opačné, jsou to enantiomery.
Není-li numerické přiřazení stereocenter jedinečné kvůli zrcadlové symetrii celé molekuly, výsledkem je meso sloučenina, jako je kyselina mezotartarová , ve které ( R , S ) je stejné jako ( S , R ). V meso sloučeninách se R a S stereocentra vyskytují v symetricky umístěných párech.
Relativní konfigurace
Relativní konfigurace dvou stereoizomerů může být označován deskriptorů R a S s hvězdičkou (*). ( R *, R *) znamená dvě centra se stejnými konfiguracemi, ( R , R ) nebo ( S , S ); ( R *, S *) znamená dvě centra s opačnými konfiguracemi, ( R , S ) nebo ( S , R ). Nejprve je stereogennímu centru s nejnižšími čísly (podle systematického číslování IUPAC) přiřazen deskriptor R *.
K označení dvou anomerů se používají relativní stereodescriptory alfa (a) a beta (p). V a anomeru mají anomerní atom uhlíku a referenční atom opačné konfigurace ( R , S ) nebo ( S , R ), zatímco v beta anomeru jsou stejné ( R , R ) nebo ( S , S ).
Tváře
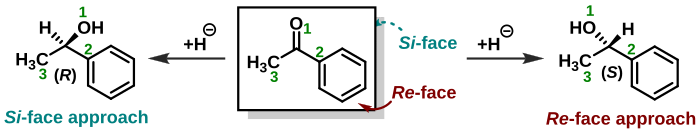
Stereochemie také hraje roli při přiřazování tváří trigonálním molekulám, jako jsou ketony . Nukleofil v nukleofilní adice může obrátit na karbonylovou skupinu ze dvou protilehlých stranách nebo plochách. Když achirální nukleofil napadne aceton , obě tváře jsou identické a existuje pouze jeden reakční produkt. Když nukleofil napadne butanon , tváře nejsou identické ( enantiotopické ) a vzniká racemický produkt . Když je nukleofil chirální molekula, vytvoří se diastereoizomery . Když je jeden povrch molekuly ve srovnání s druhým povrchem chráněn substituenty nebo geometrickými omezeními, nazývají se povrchy diastereotopické . Stejná pravidla, která určují stereochemii stereocentra ( R nebo S ), platí také při přiřazování obličeje molekulární skupiny. Tváře se pak říká Re -face a Si -face . V příkladu zobrazeném vpravo je sloučenina acetofenon viděna z Re -face. Přidání hydridu, jako v redukčním procesu z této strany, vytvoří ( S ) -enantiomer a útok z opačného povrchu Si poskytne ( R ) -enantiomer. Je však třeba poznamenat, že přidání chemické skupiny do prochirálního centra z Re -face nepovede vždy k ( S ) -stereocentru, protože je třeba vzít v úvahu prioritu chemické skupiny. To znamená, že absolutní stereochemie produktu je určena sama o sobě, a nikoli zvážením, ze které strany byl napaden. Ve výše uvedeném příkladu, pokud by byl chlorid ( Z = 17) přidán do prochirálního centra z Re -face, mělo by to za následek ( R ) -enantiomer.