Cirkadiánní rytmus - Circadian rhythm
| Cirkadiánní rytmus | |
|---|---|
 Vlastnosti lidských cirkadiánních biologických hodin
| |
| Výslovnost | |
| Frekvence | Opakuje se zhruba každých 24 hodin |
Cirkadiánní rytmus ( / s ər k eɪ d i ə n / ), nebo cirkadiánní cyklus , je přirozený, vnitřní proces, který reguluje spánek-bdění cyklus opakuje a zhruba každých 24 hodin. Může se vztahovat na jakýkoli proces, který má původ v organismu (tj. Endogenní ) a reaguje na prostředí ( stržené prostředím). Tyto 24hodinové rytmy jsou poháněny cirkadiánními hodinami a byly široce pozorovány u rostlin , zvířat , hub a sinic .
Termín cirkadián pochází z latinského circa , což znamená „kolem“ (nebo „přibližně“), a diēm , což znamená „den“. Procesy s 24hodinovými cykly se obecněji nazývají denní rytmy ; denní rytmy by neměly být nazývány cirkadiánními rytmy, pokud je nelze potvrdit jako endogenní a nikoli environmentální.
Přestože jsou cirkadiánní rytmy endogenní, přizpůsobují se místnímu prostředí vnějšími náznaky zvanými zeitgebers (německy „ časodárci “), které zahrnují světelné, teplotní a redoxní cykly. V klinickém prostředí je abnormální cirkadiánní rytmus u lidí známý jako porucha cirkadiánního rytmického spánku .
Dějiny
Zatímco ve východních a indiánských kulturách existuje několik zmínek o „přirozeném tělesném cyklu“, nejstarší zaznamenané západní záznamy o cirkadiánním procesu pocházejí ze 4. století př. N. L. , Kdy Androsthenes , kapitán lodi sloužící za Alexandra Velikého , popsal denní pohyby listů z tamarindovým stromu. Pozorování cirkadiánního nebo denního procesu u lidí je zmíněno v čínských lékařských textech datovaných přibližně do 13. století, včetně příručky Poledne a Půlnoci a Mnemotechnického rýmu na pomoc při výběru bodů Acu podle denního cyklu, dne měsíce a ročního období .
V roce 1729 provedl francouzský vědec Jean-Jacques d'Ortous de Mairan první experiment, jehož cílem bylo odlišit endogenní hodiny od reakcí na každodenní podněty. Poznamenal, že 24hodinové vzorce v pohybu listů rostliny Mimosa pudica přetrvávají, i když byly rostliny udržovány v konstantní tmě.
V roce 1896 Patrick a Gilbert pozorovali, že během delšího období spánkové deprivace se ospalost zvyšuje a snižuje přibližně po 24 hodinách. V roce 1918 JS Szymanski ukázal, že zvířata jsou schopná udržovat 24hodinové vzorce aktivity při absenci vnějších podnětů, jako je světlo a změny teploty.
Na počátku 20. století byly v rytmických dobách krmení včel pozorovány cirkadiánní rytmy. Auguste Forel , Ingeborg Beling a Oskar Wahl provedli řadu experimentů, aby zjistili, zda tento rytmus lze přičíst endogenním hodinám. Existenci cirkadiánního rytmu nezávisle objevili v ovocných muškách v roce 1935 dva němečtí zoologové Hans Kalmus a Erwin Bünning .
V roce 1954, důležitý experiment hlášený Colinem Pittendrighem, prokázal, že eclosion (proces přeměny kukly na dospělého) v Drosophila pseudoobscura byl cirkadiánní chování. Ukázal, že zatímco teplota hrála zásadní roli v rytmu zatemnění, období zatemnění se zpozdilo, ale nezastavilo se, když se teplota snížila.
Termín cirkadián vytvořil Franz Halberg v roce 1959. Podle Halbergovy původní definice:
Termín „cirkadiánní“ byl odvozen z circa (asi) a umírá (den); může to znamenat, že určitá fyziologická období se blíží 24 hodinám, ne -li přesně této délce. V tomto případě lze „cirkadiánní“ použít na všechny „24hodinové“ rytmy, bez ohledu na to, zda se jejich období, jednotlivě nebo v průměru, liší od 24 hodin, delších nebo kratších, o několik minut nebo hodin.
V roce 1977 Mezinárodní výbor pro názvosloví Mezinárodní společnosti pro chronobiologii formálně přijal definici:
Cirkadiánní: vztahující se k biologickým variacím nebo rytmům s frekvencí 1 cyklu za 24 ± 4 h; přibližně (přibližně) a zemře (den nebo 24 hodin). Poznámka: termín popisuje rytmy s délkou cyklu přibližně 24 hodin, ať už jsou frekvenčně synchronizovány s (přijatelné), nebo jsou desynchronizované nebo volně běžící z místního časového měřítka prostředí, s obdobími mírně, ale konzistentně odlišnými od 24 hodin.
Ron Konopka a Seymour Benzer identifikovali první hodinovou mutaci v Drosophile v roce 1971, přičemž gen pojmenovali „ period “ ( per ) gen, první objevený genetický determinant behaviorální rytmicity. na gen izolovali v roce 1984 dva týmy výzkumníků. Konopka, Jeffrey Hall, Michael Roshbash a jejich tým ukázali, že per lokus je středem cirkadiánního rytmu a že ztráta cirkadiánní aktivity per stop. Tým Michaela W. Younga současně informoval o podobných účincích per a že gen pokrývá interval 7,1 kilobase (kb) na chromozomu X a kóduje 4,5 (poly) (A)+ RNA 4,5 kb. Pokračovali v objevování klíčových genů a neuronů v cirkadiánním systému Drosophila , za který Hall, Rosbash a Young obdrželi Nobelovu cenu za fyziologii nebo medicínu 2017 .
Joseph Takahashi objevil první savčí cirkadiánní hodinovou mutaci ( hodinyΔ19 ) pomocí myší v roce 1994. Nedávné studie však ukazují, že delece hodin nevede k behaviorálnímu fenotypu (zvířata stále mají normální cirkadiánní rytmy), což zpochybňuje její význam při generování rytmu .
První mutaci lidských hodin identifikoval v rozšířené rodině v Utahu Chris Jones a geneticky ji charakterizovali Ying-Hui Fu a Louis Ptacek. Postižení jedinci jsou extrémní „ ranní skřivani “ se 4hodinovým pokročilým spánkem a dalšími rytmy. Tato forma syndromu familiární pokročilé spánkové fáze je způsobena jedinou změnou aminokyseliny , S662➔G, v lidském proteinu PER2.
Kritéria
Aby byl biologický rytmus nazýván cirkadiánním, musí splňovat tato tři obecná kritéria:
- Rytmus má endogenní volný běh, který trvá přibližně 24 hodin. Rytmus přetrvává za konstantních podmínek (tj. Konstantní tma) po dobu přibližně 24 hodin. Perioda rytmu za konstantních podmínek se nazývá perioda volného běhu a označuje se řeckým písmenem τ (tau). Důvodem tohoto kritéria je odlišit cirkadiánní rytmy od jednoduchých reakcí na každodenní vnější podněty. O rytmu nelze říci, že je endogenní, pokud nebyl testován a přetrvává v podmínkách bez externího periodického vstupu. U denních zvířat (aktivní během denního světla) je obecně τ o něco větší než 24 hodin, zatímco u nočních zvířat (aktivních v noci) je obecně τ kratší než 24 hodin.
- Rytmy jsou strhatelné. Rytmus lze resetovat vystavením vnějším podnětům (jako je světlo a teplo), což je proces nazývaný strhávání . Vnější podnět používaný k unášení rytmu se nazývá Zeitgeber neboli „dárce času“. Cestování v časových pásmech ukazuje schopnost lidských biologických hodin přizpůsobit se místnímu času; člověk obvykle zažije jet lag, než ho strhávání jeho cirkadiánních hodin synchronizuje s místním časem.
- Rytmy vykazují teplotní kompenzaci. Jinými slovy, udržují cirkadiánní periodicitu v rozsahu fyziologických teplot. Mnoho organismů žije v širokém rozmezí teplot a rozdíly v tepelné energii ovlivní kinetiku všech molekulárních procesů v jejich buňce (buňkách). Aby bylo možné sledovat čas, musí cirkadiánní hodiny organismu udržovat zhruba 24hodinovou periodicitu navzdory měnící se kinetice, což je vlastnost známá jako teplotní kompenzace. Q 10 Teplotní koeficient je mírou tohoto kompenzačního účinku. Pokud koeficient Q 10 zůstane při zvyšování teploty přibližně 1, je rytmus považován za teplotně kompenzovaný.
Původ
Cirkadiánní rytmy umožňují organismům předvídat a připravit se na přesné a pravidelné změny prostředí. Umožňují tak organizmům lépe těžit z environmentálních zdrojů (např. Světla a potravin) ve srovnání s těmi, které takovou dostupnost nedokážou předvídat. Proto bylo navrženo, že cirkadiánní rytmy dávají organizmům z evolučního hlediska selektivní výhodu. Zdá se však, že rytmičnost je stejně důležitá při regulaci a koordinaci vnitřních metabolických procesů jako při koordinaci s okolím . To je naznačeno udržováním (dědičností) cirkadiánních rytmů u ovocných mušek po několika stovkách generací v konstantních laboratorních podmínkách, stejně jako u tvorů v neustálé tmě ve volné přírodě, a experimentální eliminací cirkadiánních rytmů chování - ale ne fyziologických - v křepelce .
Co vedlo k vývoji cirkadiánních rytmů, byla záhadná otázka. Předchozí hypotézy zdůrazňovaly, že fotosenzitivní proteiny a cirkadiánní rytmy mohly pocházet společně v nejranějších buňkách, za účelem ochrany replikace DNA před vysokými úrovněmi škodlivého ultrafialového záření během dne. V důsledku toho byla replikace odsunuta do tmy. Důkazy pro to však chybí, protože nejjednodušší organismy s cirkadiánním rytmem, sinice, to dělají naopak - ve dne se více rozdělují. Nedávné studie místo toho zdůrazňují důležitost společné evoluce redoxních proteinů s cirkadiánními oscilátory ve všech třech oblastech života po Velké oxidační události přibližně před 2,3 miliardami let. Současný názor je, že cirkadiánní změny hladin kyslíku v životním prostředí a produkce reaktivních druhů kyslíku (ROS) za přítomnosti denního světla pravděpodobně vedly k potřebě vyvinout cirkadiánní rytmy, aby se předešlo, a tedy působilo proti škodlivým redoxním reakcím na denním základ.
Nejjednodušší známé cirkadiánní hodiny jsou bakteriální cirkadiánní rytmy , jejichž příkladem jsou prokaryotické sinice . Nedávný výzkum ukázal, že cirkadiánní hodiny Synechococcus elongatus mohou být rekonstituovány in vitro pouze pomocí tří proteinů ( KaiA , KaiB , KaiC ) jejich centrálního oscilátoru. Ukázalo se, že tyto hodiny udržují 22hodinový rytmus po několik dní po přidání ATP . Předchozí vysvětlení prokaryotického cirkadiánního časovače byly závislé na mechanismu zpětné vazby transkripce/translace DNA.
Defekt v lidském homologu genu „ období “ Drosophila byl identifikován jako příčina poruchy spánku FASPS ( syndrom familiární pokročilé spánkové fáze ), což evolucí podtrhuje konzervovanou povahu molekulárních cirkadiánních hodin. Nyní je známo mnohem více genetických složek biologických hodin. Výsledkem jejich interakcí je propojená zpětnovazební smyčka genových produktů, která má za následek periodické výkyvy, které buňky těla interpretují jako konkrétní denní dobu.
Nyní je známo, že molekulární cirkadiánní hodiny mohou fungovat v rámci jedné buňky. To znamená, že je buňkově autonomní. Toto prokázal Gene Block v izolovaných bazálních retinálních neuronech měkkýšů (BRN). Současně mohou různé buňky navzájem komunikovat, což má za následek synchronizovaný výstup elektrické signalizace. Ty mohou komunikovat s endokrinními žlázami mozku, což má za následek pravidelné uvolňování hormonů. Receptory pro tyto hormony mohou být umístěny daleko přes tělo a synchronizovat periferní hodiny různých orgánů. Informace o denní době tak, jak jsou přenášeny očima, putují do hodin v mozku a prostřednictvím nich lze synchronizovat hodiny ve zbytku těla. Biologické hodiny takto koordinují načasování například spánku/bdění, tělesné teploty, žízně a chuti k jídlu.
Význam u zvířat
Cirkadiánní rytmičnost je přítomna ve spánkových a krmných návycích zvířat, včetně lidí. Existují také jasné vzorce tělesné teploty, aktivity mozkových vln , produkce hormonů , regenerace buněk a další biologické aktivity. Kromě toho, fotoperiodismus , fyziologická reakce organismů k délce dne nebo v noci, je životně důležité, aby obě rostlin a zvířat, a cirkadiánní systém hraje roli v měření a vyhodnocení délky dne. Včasná předpověď sezónních období povětrnostních podmínek, dostupnosti potravy nebo aktivity predátorů je zásadní pro přežití mnoha druhů. I když to není jediný parametr, měnící se délka fotoperiody („délka dne“) je nejvíce prediktivní environmentální narážkou na sezónní načasování fyziologie a chování, zejména na načasování migrace, hibernace a reprodukce.
Účinek cirkadiánního narušení
Mutace nebo delece hodinového genu u myší prokázaly důležitost tělesných hodin pro zajištění správného načasování buněčných/metabolických dějů; hodinově mutované myši jsou hyperfágní a obézní a mají změněný metabolismus glukózy. U myší delece alfa hodinového genu Rev-ErbA usnadňuje dietou indukovanou obezitu a mění rovnováhu mezi využitím glukózy a lipidů predisponujícími k diabetu. Není však jasné, zda existuje silná asociace mezi polymorfismy hodinových genů u lidí a náchylností k rozvoji metabolického syndromu.
Účinek cyklu světlo -tma
Rytmus je spojen s cyklem světlo -tma. Zvířata, včetně lidí, držená delší dobu v naprosté tmě, nakonec fungují s volně běžícím rytmem. Jejich spánkový cyklus se každý „den“ posouvá dozadu nebo dopředu, podle toho, zda je jejich „den“, jejich endogenní období, kratší nebo delší než 24 hodin. Environmentální narážky, které každý den resetují rytmy, se nazývají zeitgebers (z němčiny „dávači času“). Zcela slepí podzemní savci (např. Slepý krtek Spalax sp.) Jsou schopni udržovat své endogenní hodiny při zjevné absenci vnějších podnětů. Přestože postrádají obrazotvorné oči, jejich fotoreceptory (které detekují světlo) jsou stále funkční; periodicky se také objevují.
Volně pobíhající organismy, které mají obvykle jednu nebo dvě konsolidované spánkové epizody, je budou mít stále, i když jsou v prostředí chráněném před vnějšími podněty, ale rytmus není unášen 24hodinovým cyklem světlo-tma v přírodě. Rytmus spánku a bdění se za těchto okolností může stát mimo fázi s jinými cirkadiánními nebo ultradianovými rytmy, jako jsou metabolické, hormonální, elektrické CNS nebo neurotransmiterové rytmy.
Nedávný výzkum ovlivnil design prostředí kosmických lodí , protože systémy, které napodobují cyklus světlo -tma, byly pro astronauty velmi přínosné. Světelná terapie byla vyzkoušena jako léčba poruch spánku .
Arktická zvířata
Norští vědci z University of Tromsø ukázali, že některá arktická zvířata (např. Ptarmigan , sob ) vykazují cirkadiánní rytmy pouze v částech roku, kde dochází k východu a západu slunce každý den. V jedné studii na soby vykazovala zvířata na 70 stupních severu cirkadiánní rytmy na podzim, v zimě a na jaře, ale ne v létě. Sobi na Špicberkách na 78 stupních severu vykazovali takové rytmy pouze na podzim a na jaře. Vědci mají podezření, že i ostatní arktická zvířata nemusí vykazovat cirkadiánní rytmy za stálého světla léta a neustálé tmy zimy.
Studie z roku 2006 na severní Aljašce zjistila, že veverky žijící ve dne a noční dikobrazi přísně zachovávají svůj cirkadiánní rytmus přes 82 dní a nocí slunečního svitu. Vědci spekulují, že tito dva hlodavci si všimli, že zdánlivá vzdálenost mezi sluncem a obzorem je nejkratší jednou denně, a mají tedy dostatečný signál k unášení (přizpůsobení).
Motýl a můra
Navigace pádové migrace motýla monarchy východoamerického ( Danaus plexippus ) na jejich přezimovací území ve středním Mexiku využívá sluneční kompas s kompenzací času, který závisí na cirkadiánních hodinách v jejich anténách. Cirkadiánní rytmus je také známý tím, že řídí chování páření u některých druhů můr, jako je Spodoptera littoralis , kde samice produkují specifický feromon, který přitahuje a resetuje mužský cirkadiánní rytmus, aby vyvolal páření v noci.
V rostlinách
Cirkadiánní rytmy rostlin říkají rostlině, jaké je roční období a kdy kvést, aby měla největší šanci přilákat opylovače. Mezi chování vykazující rytmy patří mimo jiné pohyb listů, růst, klíčení, výměna stomatálu/plynu, enzymová aktivita, fotosyntetická aktivita a emise vůní. Cirkadiánní rytmy se vyskytují, když rostlina strhává k synchronizaci se světelným cyklem okolního prostředí. Tyto rytmy jsou generovány endogenně, jsou soběstačné a jsou relativně konstantní v rozsahu teplot okolí. Mezi důležité vlastnosti patří dvě interagující smyčky zpětné vazby transkripce a translace: proteiny obsahující domény PAS, které usnadňují interakce protein-protein; a několik fotoreceptorů, které dolaďují hodiny na různé světelné podmínky. Očekávání změn v prostředí umožňuje vhodné změny ve fyziologickém stavu rostliny, což poskytuje adaptivní výhodu. Lepší porozumění cirkadiánním rytmům rostlin má uplatnění v zemědělství, například pomáhá zemědělcům rozložit sklizeň plodin za účelem prodloužení dostupnosti plodin a zajištění proti masivním ztrátám vlivem počasí.
Světlo je signál, kterým rostliny synchronizují své vnitřní hodiny s okolním prostředím a je snímán širokou škálou fotoreceptorů. Červené a modré světlo je absorbováno několika fytochromy a kryptochromy . Jeden fytochrom, phyA, je hlavním fytochromem v sazenicích pěstovaných ve tmě, ale ve světle rychle degraduje za vzniku Cry1. Fytochromy B – E jsou stabilnější s phyB, hlavním fytochromem v sazenicích pěstovaných na světle. Gen cryptochrome (cry) je také světlocitlivou složkou cirkadiánních hodin a předpokládá se, že je zapojen jak jako fotoreceptor, tak jako součást endogenního mechanismu kardiostimulátoru hodin. Kryptochromy 1–2 (zapojené do modré – UVA) pomáhají udržovat délku periody v hodinách prostřednictvím celé řady světelných podmínek.
Centrální oscilátor generuje soběstačný rytmus a je poháněn dvěma interagujícími smyčkami zpětné vazby, které jsou aktivní v různých denních dobách. Ranní smyčka se skládá z CCA1 (Circadian and Clock-Associated 1) a LHY (Late Elongated Hypocotyl), které kódují úzce související transkripční faktory MYB, které regulují cirkadiánní rytmy u Arabidopsis , stejně jako PRR 7 a 9 (regulátory pseudo-odezvy). Večerní smyčka se skládá z GI (Gigantea) a ELF4, které se podílejí na regulaci genů doby květu. Když jsou CCA1 a LHY nadměrně exprimovány (za konstantních světelných nebo tmavých podmínek), rostliny se stanou arytmickými a signály mRNA se snižují, což přispívá k negativní zpětné vazbě. Genová exprese CCA1 a LHY osciluje a vrcholí brzy ráno, zatímco genová exprese TOC1 osciluje a vrcholí v podvečer. Ačkoli se dříve předpokládalo, že tyto tři geny modelují negativní zpětnovazební smyčku, ve které nadměrně exprimovaný CCA1 a LHY potlačují TOC1 a nadměrně exprimovaný TOC1 je pozitivním regulátorem CCA1 a LHY, v roce 2012 Andrew Millar a další ukázali, že TOC1 ve skutečnosti slouží jako represor nejen CCA1, LHY a PRR7 a 9 v ranní smyčce, ale také GI a ELF4 ve večerní smyčce. Toto zjištění a dále výpočtové modelování TOC1 genových funkcí a interakcí naznačují reframing rostlinné cirkadiánních hodin jako triple negativní komponentní repressilator modelu spíše než pozitivní / negativní-prvek zpětné vazby charakterizující hodiny u savců.
V roce 2018 vědci zjistili, že exprese rodících se transkriptů hnRNA PRR5 a TOC1 probíhá podle stejného oscilačního vzorce jako rytmicky zpracované transkripty mRNA v A.thaliana. LNK se váže na 5 -oblast PRR5 a TOC1 a interaguje s RNAP II a dalšími transkripčními faktory . Interakce RVE8-LNK navíc umožňuje modifikaci permisivního vzorce histon-methylace (H3K4me3) a samotná histonová modifikace je paralelní s oscilací exprese hodinového genu.
Dříve bylo zjištěno, že sladění cirkadiánního rytmu rostliny se světlými a tmavými cykly vnějšího prostředí má potenciál pozitivně ovlivnit rostlinu. Vědci k tomuto závěru došli provedením experimentů na třech různých odrůdách Arabidopsis thaliana . Jedna z těchto odrůd měla normální 24hodinový cirkadiánní cyklus. Další dvě odrůdy byly mutovány, jedna měla cirkadiánní cyklus delší než 27 hodin a jedna měla kratší než normální cirkadiánní cyklus 20 hodin.
Arabidopsis s 24hodinovou cirkadiánního cyklu se pěstuje ve třech různých prostředích. Jedno z těchto prostředí mělo 20hodinový cyklus světla a tmy (10 hodin světla a 10 hodin tmy), druhé mělo 24hodinový cyklus světla a tmy (12 hodin světla a 12 hodin tmy) a konečné prostředí mělo 28hodinový cyklus světla a tmy (14 hodin světla a 14 hodin tmy). Tyto dvě mutované rostliny byly pěstovány jak v prostředí, které mělo 20hodinový cyklus světla a tmy, tak v prostředí, které mělo 28hodinový cyklus světla a tmy. Bylo zjištěno, že rozmanitost Arabidopsis s 24hodinovým cyklem cirkadiánního rytmu rostla nejlépe v prostředí, které mělo také 24hodinový cyklus světla a tmy. Celkově bylo zjištěno, že všechny odrůdy Arabidopsis thaliana měly vyšší hladiny chlorofylu a zvýšený růst v prostředích, jejichž cykly světla a tmy odpovídaly jejich cirkadiánnímu rytmu.
Výzkumníci navrhli, že by to mohlo být způsobeno tím, že přizpůsobení cirkadiánního rytmu Arabidopsis jeho prostředí by mohlo umožnit rostlině být lépe připraveno na úsvit a soumrak, a tedy schopno lépe synchronizovat své procesy. V této studii bylo také zjištěno, že geny, které pomáhají kontrolovat chlorofyl, dosáhly vrcholu několik hodin po úsvitu. To se zdá být v souladu s navrhovaným jevem známým jako metabolické svítání.
Podle hypotézy metabolického úsvitu mají cukry produkované fotosyntézou potenciál pomoci regulovat cirkadiánní rytmus a určité fotosyntetické a metabolické dráhy. Jak vychází slunce, je k dispozici více světla, což obvykle umožňuje více fotosyntézy. Cukry produkované fotosyntézou potlačují PRR7. Tato represe PRR7 pak vede ke zvýšené expresi CCA1. Na druhou stranu snížené hladiny fotosyntetického cukru zvyšují expresi PRR7 a snižují expresi CCA1. Tato smyčka zpětné vazby mezi CCA1 a PRR7 je navržena tak, aby způsobila metabolický úsvit.
V Drosophile
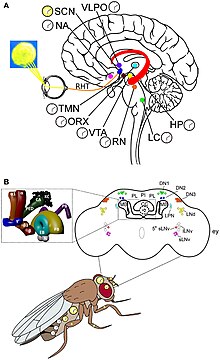
Molekulární mechanismus cirkadiánního rytmu a vnímání světla lze nejlépe pochopit u Drosophily . Geny hodin jsou objeveny od Drosophily a působí společně s hodinovými neurony. Existují dva jedinečné rytmy, jeden během procesu líhnutí (nazývaného eclosion ) z kukly a druhý během páření. Hodinové neurony jsou umístěny v odlišných shlucích v centrálním mozku. Nejlépe srozumitelnými hodinovými neurony jsou velké a malé laterální ventrální neurony (l-LNvs a s-LNvs) optického laloku . Tyto neurony produkují pigmentový disperzní faktor (PDF), neuropeptid, který funguje jako cirkadiánní neuromodulátor mezi různými hodinovými neurony.
Cirkadiánní rytmus Drosophila probíhá prostřednictvím zpětnovazební smyčky transkripce a překladu. Mechanismus jádrových hodin se skládá ze dvou vzájemně závislých zpětnovazebních smyček, a to smyčky PER/TIM a smyčky CLK/CYC. Smyčka CLK/CYC se vyskytuje během dne a iniciuje transkripci genů per a tim . Ale jejich hladiny proteinů zůstávají nízké až do soumraku, protože během denního světla také aktivuje gen doubletime ( dbt ). Protein DBT způsobuje fosforylaci a obrat monomerních proteinů PER. TIM je také fosforylován chundelatým až do západu slunce. Po západu slunce DBT zmizí, takže molekuly PER se stabilně vážou na TIM. Dimer PER/TIM vstupuje do jádra několik v noci a váže se na dimery CLK/CYC. Vázaný PER zcela zastavuje transkripční aktivitu CLK a CYC.
V časných ranních hodinách světlo aktivuje gen cry a jeho protein CRY způsobí rozpad TIM. Dimer PER/TIM se tedy disociuje a nevázaný PER se stává nestabilní. PER prochází progresivní fosforylací a nakonec degradací. Absence PER a TIM umožňuje aktivaci genů clk a cyc . Hodiny se tedy resetují, aby zahájily další cirkadiánní cyklus.
PER-TIM model
Tento proteinový model byl vyvinut na základě oscilací proteinů PER a TIM v Drosophile . Je založen na svém předchůdci, modelu PER, kde bylo vysvětleno, jak gen per a jeho protein ovlivňují biologické hodiny. Model zahrnuje tvorbu jaderného komplexu PER-TIM, který ovlivňuje transkripci genů per a tim (poskytnutím negativní zpětné vazby) a vícenásobnou fosforylaci těchto dvou proteinů. Cirkadiánní oscilace těchto dvou proteinů se zdají synchronizovat s cyklem světlo-tma, i když na něm nemusí nutně záviset. Proteiny PER i TIM jsou fosforylovány a poté, co vytvoří jaderný komplex PER-TIM, se vrací dovnitř jádra, aby zastavily expresi per a tim mRNA. Tato inhibice trvá tak dlouho, dokud nedojde k degradaci proteinu nebo mRNA. Když k tomu dojde, komplex uvolní zábranu. Zde lze také zmínit, že degradace proteinu TIM je urychlena světlem.
U savců
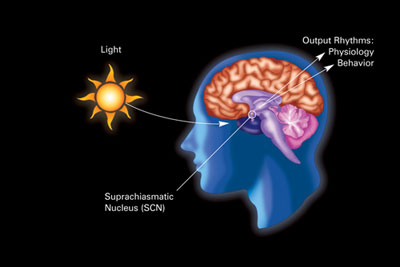
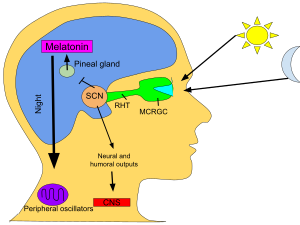
Primární cirkadiánní hodiny u savců se nacházejí v suprachiasmatickém jádru (nebo jádrech) (SCN), dvojici odlišných skupin buněk umístěných v hypotalamu . Zničení SCN má za následek úplnou absenci pravidelného rytmu spánku a bdění. SCN dostává informace o osvětlení očima. Sítnice oka obsahuje „klasické“ fotoreceptory ( „ tyče ‚a‘ kužele “), které se používají pro konvenční vidění. Sítnice ale také obsahuje specializované gangliové buňky, které jsou přímo fotosenzitivní a promítají se přímo do SCN, kde pomáhají při strhávání (synchronizaci) těchto hlavních cirkadiánních hodin. Proteiny zahrnuté v hodinách SCN jsou homologické s těmi, které se nacházejí v ovocné mušce.
Tyto buňky obsahují fotopigment melanopsin a jejich signály sledují dráhu nazývanou retinohypothalamický trakt , vedoucí k SCN. Pokud jsou buňky ze SCN odstraněny a kultivovány, udržují si svůj vlastní rytmus bez externích podnětů.
SCN odebírá informace o délkách dne a noci ze sítnice, interpretuje je a předává je epifýze , drobné struktuře ve tvaru borovicového kužele, která se nachází na epithalamu . V reakci na to epifýza vylučuje hormon melatonin . Sekrece melatoninu vrcholí v noci a odliv během dne a jeho přítomnost poskytuje informace o délce noci.
Několik studií ukázalo, že pineal melatonin se živí rytmicitou SCN k modulaci cirkadiánních vzorců aktivity a dalších procesů. Povaha a význam této zpětné vazby na úrovni systému však nejsou známy.
Cirkadiánní rytmy lidí mohou být strženy do mírně kratších a delších období, než je 24 hodin Země. Vědci z Harvardu ukázali, že lidské subjekty lze přinejmenším unést do cyklu 23,5 hodiny a cyklu 24,65 hodiny (přičemž poslední z nich je přirozený sluneční cyklus den-noc na planetě Mars ).
Lidé
Dřívější výzkum cirkadiánních rytmů naznačil, že většina lidí upřednostňuje den blíže 25 hodinám, když jsou izolovaní od vnějších podnětů, jako je denní světlo a měření času. Tento výzkum byl však chybný, protože nedokázal ochránit účastníky před umělým světlem. Přestože subjekty byly chráněny před časovými narážkami (jako hodiny) a denním světlem, vědci si nebyli vědomi fázově zpožďujících účinků vnitřních elektrických světel. Subjektům bylo dovoleno rozsvítit světlo, když byli vzhůru, a zhasnout, když chtěli spát. Elektrické světlo večer zpozdilo jejich cirkadiánní fázi. Přísnější studie provedená v roce 1999 Harvardskou univerzitou odhadovala přirozený lidský rytmus blíže k 24 hodinám a 11 minutám: mnohem blíže slunečnímu dni . V souladu s tímto výzkumem byla novější studie z roku 2010, která také identifikovala rozdíly mezi pohlavími, přičemž cirkadiánní období bylo u žen o něco kratší (24,09 hodin) než u mužů (24,19 hodin). V této studii měly ženy tendenci se probouzet dříve než muži a vykazovaly větší přednost ranním aktivitám než muži, ačkoli základní biologické mechanismy těchto rozdílů nejsou známy.
Biologické markery a efekty
Klasické fázové markery pro měření načasování cirkadiánního rytmu savce jsou:
- sekrece melatoninu epifýzou ,
- základní tělesná teplota minimální a
- plazmatická hladina kortizolu .
Pro teplotní studie musí subjekty zůstat vzhůru, ale klidné a polokloněné v blízké tmě, zatímco jejich rektální teploty jsou měřeny nepřetržitě. Ačkoli jsou rozdíly mezi normálními chronotypy velké , průměrná teplota dospělého člověka dosáhne svého minima přibližně v 5:00 ráno, asi dvě hodiny před obvyklým časem probuzení. Baehr a kol. zjistil, že u mladých dospělých se denní tělesná teplota objevila přibližně u 04:00 (4:00) u ranních typů, ale přibližně u 06:00 (6:00) u večerních typů. Toto minimum nastalo přibližně v polovině osmihodinového spánkového období pro ranní typy, ale blíže k probuzení ve večerních typech.
Melatonin v systému chybí nebo je během dne nezjistitelně nízký. Jeho nástup v šeru, nástup melatoninu v tlumeném světle (DLMO), zhruba ve 21:00 (21:00), lze měřit v krvi nebo slinách. Jeho hlavní metabolit lze také měřit v ranní moči. Jako cirkadiánní markery byly použity DLMO i střed (v čase) přítomnosti hormonu v krvi nebo slinách. Novější výzkum však naznačuje, že spolehlivějším ukazatelem může být kompenzace melatoninu . Benloucif a kol. zjistili, že markery melatoninové fáze byly stabilnější a více korelovaly s načasováním spánku než minimální teplota jádra. Zjistili, že jak offset spánku, tak offset melatoninu silněji korelují s fázovými markery než nástup spánku. Kromě toho je klesající fáze hladin melatoninu spolehlivější a stabilnější než ukončení syntézy melatoninu.
Mezi další fyziologické změny, ke kterým dochází podle cirkadiánního rytmu, patří srdeční frekvence a mnoho buněčných procesů „včetně oxidačního stresu , buněčného metabolismu , imunitních a zánětlivých reakcí, epigenetických modifikací, cest reakce hypoxie / hyperoxie , endoplazmatického retikulárního stresu , autofagie a regulace kmene buněčné prostředí. " Ve studii mladých mužů bylo zjištěno, že srdeční frekvence dosahuje nejnižší průměrné frekvence během spánku a nejvyšší průměrné frekvence krátce po probuzení.
V rozporu s předchozími studiemi bylo zjištěno, že neexistuje žádný vliv tělesné teploty na výkon na psychologické testy. To je pravděpodobně způsobeno evolučními tlaky na vyšší kognitivní funkce ve srovnání s ostatními oblastmi funkcí zkoumanými v předchozích studiích.
Mimo „hlavní hodiny“
Více či méně nezávislé cirkadiánní rytmy se nacházejí v mnoha orgánech a buňkách v těle mimo suprachiasmatická jádra (SCN), „hlavní hodiny“. Neurovědec Joseph Takahashi a jeho kolegové v článku z roku 2013 skutečně uvedli, že „téměř každá buňka v těle obsahuje cirkadiánní hodiny“. Například tyto hodiny, nazývané periferní oscilátory, byly nalezeny v nadledvinách, jícnu , plicích , játrech , slinivce , slezině , brzlíku a kůži. Existují také určité důkazy o tom, že čichový bulb a prostata mohou oscilovat, přinejmenším při kultivaci.
Ačkoli oscilátory v kůži reagují na světlo, systémový vliv nebyl prokázán. Navíc bylo prokázáno , že mnoho oscilátorů, jako jsou například jaterní buňky , reaguje na jiné vstupy než světlo, například na krmení.
Světlo a biologické hodiny
Světlo resetuje biologické hodiny podle křivky fázové odezvy (PRC). V závislosti na načasování může světlo posunout nebo oddálit cirkadiánní rytmus. Jak ČLR, tak požadovaná osvětlenost se liší druh od druhu a k vynulování hodin u nočních hlodavců jsou zapotřebí nižší úrovně světla než u lidí.
Vynucené delší nebo kratší cykly
Různé studie na lidech využily vynucených cyklů spánku/bdění silně odlišných od 24 hodin, jako například ty, které provedli Nathaniel Kleitman v roce 1938 (28 hodin) a Derk-Jan Dijk a Charles Czeisler v devadesátých letech (20 hodin). Protože lidé s normálními (typickými) cirkadiánními hodinami nemohou strhávat takové abnormální denní/noční rytmy, označuje se to jako protokol vynucené desynchronie. Podle takového protokolu jsou epizody spánku a bdění odděleny od endogenního cirkadiánního období těla, což umožňuje výzkumným pracovníkům posoudit účinky cirkadiánní fáze (tj. Relativní načasování cirkadiánního cyklu) na aspekty spánku a bdění, včetně latence spánku a dalších funkce - fyziologické, behaviorální i kognitivní.
Studie také ukazují, že Cyclosa turbinata je jedinečná v tom, že její pohybová a webová aktivita způsobuje, že má výjimečně krátkou dobu cirkadiánní hodiny, přibližně 19 hodin. Když jsou pavouci C. turbinata umístěni do komor s periodami 19, 24 nebo 29 hodin rovnoměrně rozděleného světla a tmy, žádný z pavouků nevykazoval sníženou životnost ve vlastních cirkadiánních hodinách. Tato zjištění naznačují, že C. turbinata netrpí stejnými náklady na extrémní desynchronizaci jako ostatní druhy zvířat.
Lidské zdraví
Načasování lékařské léčby v koordinaci s tělesnými hodinami, chronoterapeutiky , může výrazně zvýšit účinnost a snížit toxicitu léčiva nebo nežádoucí reakce.
Řada studií dospěla k závěru, že silový šlofík , krátká doba spánku během dne, může snížit stres a zlepšit produktivitu bez jakéhokoli měřitelného vlivu na normální cirkadiánní rytmy.
Zdravotní problémy mohou být důsledkem narušení cirkadiánního rytmu. Cirkadiánní rytmy také hrají roli v retikulárním aktivačním systému , který je zásadní pro udržení stavu vědomí. Zvrat v cyklu spánek -bdění může být známkou nebo komplikací uremie , azotemie nebo akutního poškození ledvin .
Studie také ukázaly, že světlo má přímý účinek na lidské zdraví, protože ovlivňuje cirkadiánní rytmy.
Vnitřní osvětlení
Požadavky na osvětlení pro cirkadiánní regulaci nejsou jednoduše stejné jako pro vidění; plánování vnitřního osvětlení v kancelářích a institucích s tím začíná počítat. Studie na zvířatech o účincích světla v laboratorních podmínkách donedávna uvažovaly o intenzitě světla ( ozáření ), ale nikoli o barvě, což lze prokázat, že „působí jako základní regulátor biologického načasování v přirozenějším prostředí“.
Obezita a cukrovka
Obezita a cukrovka jsou spojeny se životním stylem a genetickými faktory. Mezi těmito faktory může ve vývoji metabolických poruch hrát roli narušení cirkadiánního mechanismu a/nebo nesoulad cirkadiánního časovacího systému s vnějším prostředím (např. Cyklus světlo -tma).
Směnná práce nebo chronický jet lag mají hluboké důsledky pro cirkadiánní a metabolické děje v těle. Zvířata, která jsou v době klidu nucena jíst, vykazují zvýšenou tělesnou hmotnost a změněnou expresi hodinových a metabolických genů. U lidí je směnná práce, která upřednostňuje nepravidelnou dobu jídla, spojena se změnou citlivosti na inzulín a vyšší tělesnou hmotou. Směnná práce také vede ke zvýšenému metabolickému riziku kardio-metabolického syndromu, hypertenze a zánětu.
Piloti leteckých společností a palubní průvodčí
Vzhledem k pracovní povaze pilotů leteckých společností, kteří často překračují několik časových pásem a oblastí slunečního světla a tmy za jeden den a tráví mnoho hodin vzhůru ve dne i v noci, často nedokáží udržet spánkový režim, který odpovídá přirozenému lidskému cirkadiánnímu rytmus; tato situace může snadno vést k únavě . NTSB uvádí toto přispívá k mnoha nehodám, a provedl několik výzkumných studií s cílem nalézt způsoby boje proti únavě pilotů.
Narušení
Narušení rytmů má obvykle negativní účinek. Mnoho cestujících zažilo stav známý jako jet lag , s ním spojené příznaky únavy , dezorientace a nespavosti .
Řada dalších poruch, jako je bipolární porucha a některé poruchy spánku, jako je porucha zpožděné spánkové fáze (DSPD), je spojena s nepravidelným nebo patologickým fungováním cirkadiánních rytmů.
Předpokládá se, že dlouhodobé narušení rytmu má významné nepříznivé zdravotní důsledky pro periferní orgány mimo mozek, zejména při rozvoji nebo exacerbaci kardiovaskulárních chorob. Modré LED osvětlení potlačuje produkci melatoninu pětkrát více než oranžově žluté vysokotlaké sodíkové světlo (HPS) ; halogenidová výbojka , která je bílé světlo, potlačuje melatoninu v množství více než třikrát větší než HPS. Příznaky deprese z dlouhodobého nočního působení světla lze vrátit návratem do normálního cyklu.
Účinek léků
Studie prováděné na zvířatech i lidech ukazují velké obousměrné vztahy mezi cirkadiánním systémem a zneužívajícími drogami. Uvádí se, že tyto zneužívající léky ovlivňují centrální cirkadiánní kardiostimulátor. Jedinci trpící zneužíváním návykových látek vykazují narušené rytmy. Tyto narušené rytmy mohou zvýšit riziko zneužívání návykových látek a relapsu. Je možné, že genetické a/nebo environmentální poruchy normálního cyklu spánku a bdění mohou zvýšit náchylnost k závislosti.
Je obtížné určit, zda je narušení cirkadiánního rytmu příčinou zvýšeného výskytu zneužívání návykových látek - nebo za to mohou jiné faktory prostředí, jako je stres. Změny cirkadiánního rytmu a spánku nastávají, jakmile jedinec začne zneužívat drogy a alkohol. Jakmile se jedinec rozhodne přestat užívat drogy a alkohol, cirkadiánní rytmus je nadále narušován.
Stabilizace spánku a cirkadiánního rytmu by možná mohla pomoci snížit náchylnost k závislosti a snížit pravděpodobnost relapsu.
Cirkadiánní rytmy a hodinové geny exprimované v oblastech mozku mimo suprachiasmatické jádro mohou významně ovlivnit účinky vyvolané drogami, jako je kokain . Genetické manipulace hodinových genů navíc hluboce ovlivňují akce kokainu.
Společnost a kultura
V roce 2017 získali Jeffrey C. Hall , Michael W. Young a Michael Rosbash Nobelovu cenu za fyziologii nebo medicínu „za objevy molekulárních mechanismů ovládajících cirkadiánní rytmus“.
Viz také
- Actigrafie (také známá jako aktimetrie)
- ARNTL
- ARNTL2
- Bakteriální cirkadiánní rytmy
- Poruchy cirkadiánního rytmického spánku , jako např
- Chronobiologie
- HODINY
- Circasemidský rytmus
- Circaseptan , 7denní biologický cyklus
- Kryptochrom
- CRY1 a CRY2 : geny rodiny kryptochromů
- Denní cyklus
- Světelné efekty na cirkadiánní rytmus
- Světlo ve školních budovách
- PER1 , PER2 a PER3 : geny dobové rodiny
- Fotosenzitivní gangliová buňka : část oka, která se podílí na regulaci cirkadiánního rytmu.
- Polyfázický spánek
- Rev-ErbA alfa
- Segmentovaný spánek
- Architektura spánku (spánek u lidí)
- Spát v nelidských zvířatech
- Stefania Follini
Reference
Další čtení
- Aschoff J, ed. (1965). Cirkadiánní hodiny . Amsterdam: North Holland Press.
- Avivi A, Albrecht U, Oster H, Joel A, Beiles A, Nevo E (listopad 2001). „Biologické hodiny v naprosté tmě: cirkadiánní systém Clock/MOP3 slepé podzemní krysy krtka“ . Sborník Národní akademie věd Spojených států amerických . 98 (24): 13751–6. Bibcode : 2001PNAS ... 9813751A . doi : 10,1073/pnas.181484498 . PMC 61113 . PMID 11707566 .
- Avivi A, Oster H, Joel A, Beiles A, Albrecht U, Nevo E (září 2002). „Cirkadiánní geny u slepého podzemního savce II: zachování a jedinečnost tří dobových homologů u slepé podzemní krysy krtka, Spalax ehrenbergi superspecies“ . Sborník Národní akademie věd Spojených států amerických . 99 (18): 11718–23. Bibcode : 2002 PNAS ... 9911718A . doi : 10,1073/pnas.182423299 . PMC 129335 . PMID 12193657 .
- Li D, Ma S, Guo D, Cheng T, Li H, Tian Y a kol. (Říjen 2016). „Cirkadiánní narušení životního prostředí zhoršuje neurologické poškození a inhibuje hippocampální neurogenezi u dospělých potkanů po traumatickém poranění mozku“ . Buněčná a molekulární neurobiologie . 36 (7): 1045–55. doi : 10,1007/s10571-015-0295-2 . PMC 4967018 . PMID 26886755 .
- Ditty JL, Williams SB, Golden SS (2003). „Cyanobakteriální cirkadiánní načasovací mechanismus“. Výroční přehled genetiky . 37 : 513–43. doi : 10,1146/annurev.genet.37.110801.142716 . PMID 14616072 . S2CID 36703896 .
- Dunlap JC, Loros J, DeCoursey PJ (2003). Chronobiologie: biologické časomíry . Sunderland: Sinauer. ISBN 9780878931491.
- Dvornyk V, Vinogradova O, Nevo E (březen 2003). „Původ a evoluce genů cirkadiánních hodin v prokaryotech“ . Sborník Národní akademie věd Spojených států amerických . 100 (5): 2495–500. Bibcode : 2003PNAS..100.2495D . doi : 10,1073/pnas.0130099100 . PMC 151369 . PMID 12604787 .
- Koukkari WL, Sothern RB (2006). Představujeme biologické rytmy . New York: Springer.
- Martino T, Arab S, Straume M, Belsham DD, Tata N, Cai F a kol. (Duben 2004). „Denní/noční rytmy v genové expresi normálního myšího srdce“. Journal of Molecular Medicine . 82 (4): 256–64. doi : 10,1007/s00109-003-0520-1 . PMID 14985853 . S2CID 871822 .
- Refinetti R (2006). Cirkadiánní fyziologie (2. vyd.). Boca Raton: CRC Press.
- Takahashi JS, Zatz M (září 1982). „Regulace cirkadiánní rytmicity“. Věda . 217 (4565): 1104–11. Bibcode : 1982Sci ... 217.1104T . doi : 10,1126/věda.6287576 . PMID 6287576 .
- Tomita J, Nakajima M, Kondo T, Iwasaki H (leden 2005). „Žádná zpětná vazba na transkripci a překlad v cirkadiánním rytmu fosforylace KaiC“. Věda . 307 (5707): 251–4. Bibcode : 2005Sci ... 307..251T . doi : 10,1126/věda.1102540 . PMID 15550625 . S2CID 9447128 .
- Moore-Ede MC, Sulzman FM, Fuller CA (1982). Hodiny, které nás určují: fyziologie cirkadiánního časovacího systému . Cambridge, Massachusetts: Harvard University Press. ISBN 978-0-674-13581-9.