Koordinační komplex - Coordination complex
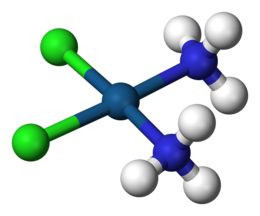
Koordinační komplex se skládá z centrální atomu nebo iontu , který je obvykle kovová a nazývá se koordinační centrum , a okolní pole vázaných molekul nebo iontů, které jsou zase známé jako ligandy nebo komplexotvorných činidel. Mnoho sloučenin obsahujících kovy , zejména sloučenin přechodných kovů (d blokové prvky), jsou koordinační komplexy.
Názvosloví a terminologie
Koordinační komplexy jsou tak všudypřítomné, že jejich struktury a reakce jsou popsány mnoha způsoby, někdy matoucími. Atom v ligandu, který je navázán na centrální atom nebo iont kovu, se nazývá donorový atom . V typickém komplexu je kovový iont vázán na několik donorových atomů, které mohou být stejné nebo různé. Vícefunkční (vícenásobné vázaný) ligandem je molekula nebo iont, který váže na centrální atom přes několik atomů, že ligand je; ligandy se 2, 3, 4 nebo dokonce 6 vazbami na centrální atom jsou běžné. Tyto komplexy se nazývají chelátové komplexy ; tvorba takových komplexů se nazývá chelatace, komplexace a koordinace.
Centrální atom nebo iont spolu se všemi ligandy tvoří koordinační sféru . Centrální atomy nebo ionty a donorové atomy tvoří první koordinační sféru.
Koordinace označuje „kovalentní vazby souřadnic“ ( dipolární vazby ) mezi ligandy a centrálním atomem. Komplex původně znamenal reverzibilní asociaci molekul , atomů nebo iontů prostřednictvím takových slabých chemických vazeb . Při aplikaci na koordinační chemii se tento význam vyvinul. Některé komplexy kovů jsou tvořeny prakticky nevratně a mnohé jsou spojeny dohromady vazbami, které jsou poměrně silné.
Počet donorových atomů připojených k centrálnímu atomu nebo iontu se nazývá koordinační číslo . Nejběžnější koordinační čísla jsou 2, 4 a zejména 6. Hydratovaný iont je jeden druh komplexního iontu (nebo jednoduše komplexu), druh vytvořený mezi centrálním kovovým iontem a jedním nebo více okolními ligandy, molekulami nebo ionty, které obsahovat alespoň jeden volný pár elektronů.
Pokud jsou všechny ligandy monodentátové , pak se počet donorových atomů rovná počtu ligandů. Například hexahydrát kobaltu (II) nebo ion hexaakvakobaltu (II) [Co (H 2 O) 6 ] 2+ je iont hydratovaného komplexu, který se skládá ze šesti molekul vody připojených ke kovovému iontu Co. Oxidační stav a koordinační číslo odráží počet vazeb vytvořených mezi kovovým iontem a ligandy v komplexním iontu. Koordinační číslo Pt ( en )2+
2 je 4 (spíše než 2), protože má dva bidentátní ligandy, které obsahují celkem čtyři donorové atomy.
Jakýkoli donorový atom dá pár elektronů. Existuje několik donorových atomů nebo skupin, které mohou nabídnout více než jeden pár elektronů. Takové se nazývají bidentátní (nabízí dva páry elektronů) nebo polydentát (nabízí více než dva páry elektronů). V některých případech atom nebo skupina nabízí pár elektronů dvěma podobným nebo odlišným centrálním atomům kovu nebo akceptorům - rozdělením elektronového páru - do třícentrální vazby se dvěma elektrony . Říká se jim přemosťující ligandy.
Dějiny
Koordinační komplexy jsou známy již od počátku moderní chemie. Mezi rané známé koordinační komplexy patří barviva, jako je pruská modrá . Jejich vlastnosti byly poprvé dobře pochopeny koncem 19. století po práci Christiana Wilhelma Blomstranda z roku 1869 . Blomstrand vyvinul to, co se stalo známým jako teorie komplexních iontových řetězců. Při posuzování kovové aminové komplexy, se domníval, že molekuly amoniaku kompenzoval náboj iontu vytvořením řetězce typu [(NH 3 ) X ] X + , kde X je koordinační číslo kovového iontu. Ten oproti své teoretické amoniaku řetězce uhlovodíků formuláře (CH 2 ) X .
V návaznosti na tuto teorii ji dánský vědec Sophus Mads Jørgensen vylepšil. Ve své verzi teorie Jørgensen tvrdil, že když se molekula disociuje v roztoku, existují dva možné výsledky: ionty se vážou přes amoniakové řetězce, které popsal Blomstrand, nebo se ionty vážou přímo na kov.
Teprve v roce 1893 vydal nejvíce přijímanou verzi dnešní teorie Alfred Werner . Wernerova práce zahrnovala dvě důležité změny v Blomstrandově teorii. První bylo, že Werner popsal dvě možnosti, pokud jde o umístění v koordinační sféře. Tvrdil, že pokud by ionty měly tvořit řetěz, došlo by k tomu mimo koordinační sféru, zatímco ionty, které se vážou přímo na kov, by tak činily v koordinační sféře. V jednom ze svých nejdůležitějších objevů však Werner vyvrátil většinu teorie řetězů. Werner objevil prostorové uspořádání ligandů, které se podílely na tvorbě komplexního hexakoordinačního kobaltu. Jeho teorie umožňuje pochopit rozdíl mezi koordinovaným ligandem a iontem vyrovnávajícím náboj ve sloučenině, například chloridovým iontem v chloridech kobaltaminu, a vysvětlit mnoho dříve nevysvětlitelných izomerů.
V roce 1911 Werner nejprve vyřešil koordinační komplex hexol na optické izomery , čímž svrhl teorii, že chirality mohou mít pouze sloučeniny uhlíku .
Struktury
Ionty nebo molekuly obklopující centrální atom se nazývají ligandy . Ligandy jsou klasifikovány jako L nebo X (nebo jejich kombinace) v závislosti na tom, kolik elektronů zajišťují vazbu mezi ligandem a centrálním atomem. L ligandy poskytují dva elektrony z osamoceného elektronového páru , což vede k souřadnicové kovalentní vazbě . X ligandy poskytují jeden elektron, přičemž centrální atom poskytuje druhý elektron, čímž vytváří pravidelnou kovalentní vazbu . O ligandech se říká, že jsou koordinovány s atomem. U alkenů se vazby pí mohou koordinovat s atomy kovů. Příkladem je ethylen v komplexu [PtCl 3 (C 2 H 4 )] - .
Geometrie
V koordinační chemii je struktura nejprve popsána svým koordinačním číslem , počtem ligandů připojených ke kovu (konkrétněji počtem donorových atomů). Obvykle lze spočítat připojené ligandy, ale někdy se počítání může stát nejednoznačné. Koordinační čísla jsou obvykle mezi dvěma a devíti, ale velké množství ligandů není u lanthanoidů a aktinidů neobvyklé. Počet vazeb závisí na velikosti, náboji a elektronové konfiguraci kovového iontu a ligandů. Kovové ionty mohou mít více než jedno koordinační číslo.
Typicky v chemii komplexů přechodných kovů dominují interakce mezi s a p molekulárními orbitaly donorových atomů v ligandech a d orbitaly kovových iontů. S, p a d orbitaly kovu mohou pojmout 18 elektronů (viz pravidlo 18-elektronů ). Maximální koordinační číslo pro určitý kov tedy souvisí s elektronickou konfigurací kovového iontu (konkrétněji s počtem prázdných orbitalů) a s poměrem velikosti ligandů a kovového iontu. Velké kovy a malé ligandy vedou k vysokým koordinačním číslům, např. [Mo (CN) 8 ] 4− . Malé kovy s velkými ligandy vedou k nízkým koordinačním číslům, např. Pt [P (CMe 3 )] 2 . Lanthanoidy , aktinidy a rané přechodné kovy mají kvůli své velké velikosti tendenci mít vysoké koordinační počty.
Většina struktur sleduje vzorec body na kouli (nebo, jako by centrální atom byl uprostřed mnohostěnu, kde rohy tohoto tvaru jsou umístění ligandů), kde se orbitální překrývají (mezi ligandem a kovovými orbitaly ) a odpuzování ligand-ligand mají tendenci vést k určitým pravidelným geometriím. Nejvíce pozorované geometrie jsou uvedeny níže, ale existuje mnoho případů, které se odchylují od běžné geometrie, např. Kvůli použití ligandů různých typů (což má za následek nepravidelné délky vazeb; koordinační atomy nenásledují body-na-a -sphere pattern), kvůli velikosti ligandů nebo kvůli elektronickým efektům (viz např. Jahn – Tellerovo zkreslení ):
- Lineární pro dvě koordinace
- Trigonal planar pro tříkoordinaci
- Čtyřboký nebo čtvercový planární pro čtyřkoordinaci
- Trigonální bipyramidální pro koordinaci
- Octahedral pro koordinaci šesti
- Pětiboká bipyramidová pro koordinaci sedmi
- Čtvercový antiprismatický pro osm koordinaci
- Trikovaný trigonální prizmatický pro devíti koordinaci
Idealizované popisy koordinace 5-, 7-, 8- a 9- jsou často nejasné geometricky od alternativních struktur s mírně odlišnými úhly LML (ligand-kov-ligand), např. Rozdíl mezi čtvercovými pyramidálními a trigonálními bipyramidovými strukturami.
- Čtvercový pyramidální pro pětkoordinaci
- Omezený osmistěn nebo omezený trigonální prizmatický pro koordinaci sedmi
- Dodecahedral nebo bicapped trigonální prizmatická pro osm koordinaci
- Čtvercový antiprismatický pro devíti koordinaci
V systémech s nízkým počtem elektronů d jsou kvůli zvláštním elektronickým efektům, jako je stabilizace Jahna – Tellera (druhého řádu) , určité geometrie (ve kterých atomy koordinace nenásledují vzorec body na kouli) stabilizované vzhledem k další možnosti, např. pro některé sloučeniny je trigonální prizmatická geometrie stabilizována vzhledem k oktaedrickým strukturám pro koordinaci šesti.
- Ohnuté pro dvoukoordinaci
- Trigonální pyramidální pro tříkoordinaci
- Trigonální prizmatický pro koordinaci šesti
Izomerismus
Uspořádání ligandů je pro daný komplex fixní, ale v některých případech je proměnlivé reakcí, která vytvoří další stabilní izomer .
V koordinačních komplexech existuje mnoho druhů izomerismu , stejně jako v mnoha jiných sloučeninách.
Stereoizomerie
Stereoizomerismus se vyskytuje se stejnými vazbami v různých orientacích. Stereoizomerismus lze dále rozdělit na:
Cis-trans izomerismus a obličej-meridionální izomerismus
Cis – trans izomerismus se vyskytuje v oktaedrických a čtvercových rovinných komplexech (ale ne ve čtyřbokých). Když dva ligandy sousedí, říká se o nich, že jsou cis , když jsou naproti sobě, trans . Když se tři stejné ligandy zabírají jeden tvář osmistěn, izomer se říká, že obličeje nebo FAC . V izomeru Fac jsou libovolné dva identické ligandy navzájem sousedící nebo cis . Pokud jsou tyto tři ligandy a kovový iont v jedné rovině, říká se, že izomer je meridionální nebo mer . Mer izomer může být považována za kombinace Trans a jen cis , protože obsahuje jak trans a cis párů identických ligandů.
Optická izomerie
K optickému izomerismu dochází, když komplex není překrývající se svým zrcadlovým obrazem. Říká se tomu proto, že oba izomery jsou každý opticky aktivní , to znamená, že otáčejí rovinou polarizovaného světla v opačných směrech. V první zobrazené molekule je symbol Λ ( lambda ) používán jako předpona k popisu levotočivého vrtulového kroucení tvořeného třemi bidentátními ligandy. Druhá molekula je zrcadlovým obrazem první, se symbolem Δ ( delta ) jako předponou pro otočení vrtule pro pravou ruku. Třetí a čtvrtá molekula jsou podobnou dvojicí izomerů a Δ, v tomto případě se dvěma bidentátními ligandy a dvěma identickými monodentátními ligandy.
Strukturální izomerismus
Ke strukturnímu izomerismu dochází, když jsou samy vazby odlišné. Rozeznávají se čtyři typy strukturního izomerismu: ionizační izomerismus, solvátový nebo hydrátový izomerismus, vazebný izomerismus a koordinační izomerismus.
- Ionizační izomerismus - izomery dávají v roztoku různé ionty, i když mají stejné složení. K tomuto typu izomerismu dochází, když je protiont komplexu také potenciálním ligandem. Například, síran pentaamminebromocobalt (III), [Co (NH 3 ) 5 Br] SO 4 je červená fialová a v roztoku se získá precipitát chloridu barnatého, potvrzující přítomnost síranový iont, zatímco pentaamminesulphatecobalt (III) bromidu [Co (NH 3 ) 5 SO 4 ] Br je červený a má negativní testy na síranový iont v roztoku, ale místo toho poskytuje sraženinu AgBr s dusičnanem stříbrným.
- Somerát nebo hydrát izomerismus - izomery mají stejné složení, ale liší se s ohledem na počet molekul rozpouštědla, které slouží jako ligand, oproti jednoduše zabírajícím místům v krystalu. Příklady: [Cr (H 2 O) 6 ] Cl 3 je zabarvení, [CrCl (H 2 O) 5 ] Cl 2 · H 2 O je modro-zelená, a [CrCl 2 (H 2 O) 4 ] Cl · 2H 2 O je tmavě zelená. Viz voda krystalizace .
- K izomerismu vazeb dochází u ligandů s více než jedním typem donorového atomu, známých jako ambidentátní ligandy . Například, dusitan může koordinovat přes O nebo N. Jeden pár vazbových dusitanů izomerů mají struktury (NH 3 ) 5 CONO 2 2+ (nitro isomer) a (NH 3 ) 5 CoONO 2+ (nitrito izomer).
- Koordinační izomerismus - k tomu dochází, když jsou pozitivní i negativní ionty soli komplexní ionty a tyto dva izomery se liší v distribuci ligandů mezi kationtem a aniontem. Například, [Co (NH 3 ) 6 ] [Cr (CN) 6 ] a [Cr (NH 3 ) 6 ] [Co (CN) 6 ].
Elektronické vlastnosti
Mnoho vlastností komplexů přechodných kovů je diktováno jejich elektronovými strukturami. Elektronická struktura může být popsána relativně iontovým modelem, který připisuje formální náboje kovům a ligandům. Tento přístup je podstatou teorie krystalového pole (CFT). Teorie krystalového pole, kterou představil Hans Bethe v roce 1929, poskytuje pokus o porozumění komplexům kvantově mechanicky . Teorie krystalového pole však považuje všechny interakce v komplexu za iontové a předpokládá, že ligandy lze aproximovat zápornými bodovými náboji.
Sofistikovanější modely zahrnují kovalenci a tento přístup je popsán teorií ligandového pole (LFT) a molekulární orbitální teorií (MO). Ligandová teorie pole, představená v roce 1935 a postavená na molekulární orbitální teorii, zvládne širší škálu komplexů a může vysvětlit komplexy, ve kterých jsou interakce kovalentní . Chemické aplikace teorie skupin mohou pomoci pochopit teorii pole krystalů nebo ligandů tím, že umožní jednoduché řešení formálních rovnic založené na symetrii.
Chemici mají tendenci používat nejjednodušší model požadovaný k předpovědi sledovaných vlastností; z tohoto důvodu je CFT oblíbeným předmětem diskusí, kdykoli je to možné. Teorie MO a LF jsou složitější, ale poskytují realističtější perspektivu.
Elektronická konfigurace komplexů jim dává některé důležité vlastnosti:

Barva komplexů přechodových kovů
Komplexy přechodných kovů mají často velkolepé barvy způsobené elektronickými přechody absorpcí světla. Z tohoto důvodu se často používají jako pigmenty . Většina přechodů, které souvisejí s barevnými komplexy kovů, jsou buď přechody d – d, nebo pásma přenosu náboje . Při přechodu ad-d je elektron v ad orbitálu na kov excitován fotonem na jiný d orbitál s vyšší energií, proto se přechody d – d vyskytují pouze u částečně vyplněných d-orbitálních komplexů (d 1–9 ). U komplexů s konfigurací d 0 nebo d 10 je přenos náboje stále možný, i když přechody d – d nejsou. Pás přenosu náboje znamená podporu elektronu z orbitálu na bázi kovu do prázdného orbitálu na bázi ligandu (přenos náboje z kovu na ligand nebo MLCT). Rovněž dochází k obrácení : excitace elektronu v orbitalu na bázi ligandu do prázdného orbitalu na bázi kovu ( přenos náboje ligand na kov nebo LMCT). Tyto jevy lze pozorovat pomocí elektronické spektroskopie; také známý jako UV-Vis . U jednoduchých sloučenin s vysokou symetrií lze d – d přechody přiřadit pomocí diagramů Tanabe – Sugano . Tyto úkoly získávají zvýšenou podporu s výpočetní chemií .
| Fe 2+ | Fe 3+ | Co 2+ | Cu 2+ | Al 3+ | Cr 3+ | |
|---|---|---|---|---|---|---|
| Hydratovaný ion |
[Fe (H 2 O) 6 ] 2+ Bledě zelené řešení |
[Fe (H 2 O) 6 ] 3+ žlutohnědý roztok |
[Co (H 2 O) 6 ] 2+ růžové řešení |
[Cu (H 2 O) 6 ] 2+ modrý roztok |
[Al (H 2 O) 6 ] 3+ Bezbarvý roztok |
[Cr (H 2 O) 6 ] 3+ zelené řešení |
| (OH) - , zředit |
[Fe (H 2 O) 4 (OH) 2 ] Tmavě zelená sraženina |
[Fe (H 2 O) 3 (OH) 3 ] Hnědá sraženina |
[Co (H 2 O) 4 (OH) 2 ] modrá / zelená sraženina |
[Cu (H 2 O) 4 (OH) 2 ] Modrá sraženina |
[Al (H 2 O) 3 (OH) 3 ] Bílá sraženina |
[Cr (H 2 O) 3 (OH) 3 ] Zelená Sraženina |
| (OH) - , koncentrovaný |
[Fe (H 2 O) 4 (OH) 2 ] Tmavě zelená sraženina |
[Fe (H 2 O) 3 (OH) 3 ] Hnědá sraženina |
[Co (H 2 O) 4 (OH) 2 ] modrá / zelená sraženina |
[Cu (H 2 O) 4 (OH) 2 ] Modrá sraženina |
[Al (OH) 4 ] - bezbarvý roztok |
[Cr (OH) 6 ] 3– zelené řešení |
| NH 3 , zředěné |
[Fe (NH 3 ) 6 ] 2+ Tmavě zelená sraženina |
[Fe (NH 3 ) 6 ] 3+ hnědé sraženiny |
[Co (NH 3 ) 6 ] 2+ Slaměný roztok |
[Cu (NH 3 ) 4 (H 2 O) 2 ] 2+ temně modrá Řešení |
[Al (NH 3 ) 3 ] 3+ bílé sraženiny |
[Cr (NH 3 ) 6 ] 3+ fialový roztok |
| NH 3 , koncentruje |
[Fe (NH 3 ) 6 ] 2+ Tmavě zelená sraženina |
[Fe (NH 3 ) 6 ] 3+ hnědé sraženiny |
[Co (NH 3 ) 6 ] 2+ Slaměný roztok |
[Cu (NH 3 ) 4 (H 2 O) 2 ] 2+ temně modrá Řešení |
[Al (NH 3 ) 3 ] 3+ bílé sraženiny |
[Cr (NH 3 ) 6 ] 3+ fialový roztok |
| (CO 3 ) 2- |
FeCO 3 Tmavě zelená sraženina |
Fe 2 (CO 3 ) 3 hnědá sraženina + bubliny |
Růžový srážek CoCO 3 |
CuCO 3 Modrozelený precipitát |
Barvy lanthanidových komplexů
Povrchově lanthanoidové komplexy jsou podobné komplexům přechodových kovů v tom, že některé jsou zabarveny. Avšak pro běžné ionty Ln 3+ (Ln = lanthanid) jsou všechny barvy bledé a těžko ovlivněné povahou ligandu. Barvy jsou způsobeny elektronovými přechody 4f. Protože orbitaly 4f v lanthanidech jsou „pohřbeny“ v xenonovém jádru a chráněny před ligandem orbitály 5s a 5p, nejsou proto ligandy nijak ovlivněny, což vede k mnohem menšímu štěpení krystalového pole než v přechodových kovech . Absorpční spektra iontu Ln 3+ se blíží absorpčnímu spektru volného iontu, kde jsou elektronické stavy popsány vazbou spin-orbit . To kontrastuje s přechodnými kovy, kde je základní stav rozdělen krystalovým polem. Absorpce pro Ln 3+ jsou slabé, protože přechody elektrických dipólů jsou zakázány paritou ( Laporte zakázán ), ale mohou nabývat na intenzitě vlivem pole ligandu s nízkou symetrií nebo mícháním s vyššími elektronovými stavy ( např. D orbitaly). ff absorpční pásma jsou extrémně ostrá, což kontrastuje s těmi pozorovanými u přechodných kovů, které mají obecně široká pásma. To může vést k extrémně neobvyklým efektům, jako jsou výrazné změny barev při různých formách osvětlení.
Magnetismus
Kovové komplexy, které mají nepárové elektrony, jsou magnetické . Vezmeme-li v úvahu pouze monokovové komplexy, vznikají nepárové elektrony, protože komplex má lichý počet elektronů nebo proto, že párování elektronů je destabilizováno. Monomerní druhy Ti (III) tedy mají jeden „d-elektron“ a musí být (para) magnetické , bez ohledu na geometrii nebo povahu ligandů. Ti (II), se dvěma d-elektrony, tvoří některé komplexy, které mají dva nepárové elektrony a jiné žádné. Tento účinek je ilustrován sloučeninami TIX 2 [(CH 3 ) 2 PCH 2 CH 2 P (CH 3 ) 2 ] 2 : pokud X = Cl , komplex je paramagnetický ( high-spin konfigurace), zatímco pokud X = CH 3 , je diamagnetická ( konfigurace s nízkým spinem ). Je důležité si uvědomit, že ligandy poskytují důležitý prostředek k úpravě vlastností základního stavu .
V bi- a polymetalických komplexech, ve kterých mají jednotlivá centra lichý počet elektronů nebo které mají vysokou rotaci, je situace komplikovanější. Pokud existuje interakce (buď přímá nebo prostřednictvím ligandu) mezi dvěma (nebo více) kovovými centry, elektrony se mohou spojit ( antiferomagnetická vazba , což vede k diamagnetické sloučenině), nebo se mohou navzájem zesilovat ( feromagnetická vazba ). Pokud nedochází k žádné interakci, chovají se dvě (nebo více) jednotlivých kovových center jako ve dvou samostatných molekulách.
Reaktivita
Komplexy vykazují řadu možných reaktivit:
- Elektronové převody
- K přenosu elektronů (ET) mezi kovovými ionty může dojít dvěma odlišnými mechanismy, elektronovými přenosy vnitřní a vnější sféry . Při reakci vnitřní koule slouží můstkový ligand jako kanál pro ET.
- (Degenerovaná) výměna ligandu
- Jedním důležitým ukazatelem reaktivity je rychlost degenerované výměny ligandů. Například rychlost výměny souřadnicové vody v komplexech [M (H 2 O) 6 ] n + kolísá přes 20 řádů. Komplexy, kde se ligandy uvolňují a rychle se odrážejí, jsou klasifikovány jako labilní. Takové labilní komplexy mohou být termodynamicky docela stabilní. Typické labilní komplexy kovů mají buď nízký náboj (Na + ), elektrony v d-orbitálech, které jsou antibondingové vzhledem k ligandům (Zn 2+ ), nebo postrádají kovalenci (Ln 3+ , kde Ln je jakýkoli lanthanid). Pokud je to možné, labilita kovového komplexu závisí také na konfiguracích s vysokým a nízkým spinem. Fe (II) a Co (III) s vysokým spinem tedy tvoří labilní komplexy, zatímco analogy s nízkým spinem jsou inertní. Cr (III) může existovat pouze ve stavu s nízkým spinem (kvartet), který je inertní kvůli vysokému formálnímu oxidačnímu stavu, absenci elektronů na orbitálech, které jsou M – L antibondingové, plus nějaká „stabilizace ligandového pole“ spojená s d 3 konfigurace.
- Asociativní procesy
- Komplexy, které mají nevyplněné nebo napůl naplněné orbitaly, často ukazují schopnost reagovat se substráty. Většina substrátů má singletový základní stav; to znamená, že mají osamocené elektronové páry (např. voda, aminy, ethery), takže tyto substráty potřebují prázdný orbitál, aby mohly reagovat s kovovým středem. Některé substráty (např. Molekulární kyslík) mají základní stav tripletů , což vede k tomu, že kovy s poloplněnými orbitaly mají tendenci reagovat s takovými substráty (je třeba říci, že molekula dioxygenů má také jednotlivé páry, takže je také schopná reagovat jako „normální“ Lewisova základna).
Pokud jsou ligandy kolem kovu pečlivě vybrány, může kov pomoci při ( stechiometrických nebo katalytických ) transformacích molekul nebo může být použit jako senzor.
Klasifikace
Kovové komplexy, známé také jako koordinační sloučeniny, zahrnují prakticky všechny kovové sloučeniny. Studium „koordinační chemie“ je studium „anorganické chemie“ všech kovů alkalických kovů a kovů alkalických zemin , přechodných kovů , lanthanoidů , aktinidů a metaloidů . Koordinační chemie je tedy chemií většiny periodické tabulky. Kovy a kovové ionty existují, alespoň v kondenzovaných fázích, pouze obklopené ligandy.
Oblasti koordinační chemie lze klasifikovat podle povahy ligandů, obecně:
- Klasické (neboli „ Wernerovy komplexy“): Ligandy v klasické koordinační chemii se vážou na kovy téměř výlučně prostřednictvím svých osamělých párů elektronů umístěných na atomech hlavní skupiny ligandu. Typické ligandy jsou H 2 O, NH 3 , Cl - , CN - , en . Některé z nejjednodušších členů těchto komplexů jsou popsány v kovových komplexech aquo , kov amonných komplexů ,
- Příklady: [Co ( EDTA )] - , [Co (NH 3 ) 6 ] 3+ , [Fe (C 2 O 4 ) 3 ]
- Organokovová chemie: Ligandy jsou organické (alkeny, alkyny, alkyly) a také "organické" ligandy, jako jsou fosfiny, hydridy a CO.
- Příklad: (C 5 H 5 ), Fe (CO) 2 CH 3
- Bioanorganická chemie: Ligandy jsou ty, které poskytuje příroda, zejména včetně postranních řetězců aminokyselin a mnoha kofaktorů, jako jsou porfyriny .
- Příklad: hemoglobin obsahuje hem , porfyrinový komplex železa
- Příklad: chlorofyl obsahuje porfyrinový komplex hořčíku
- Mnoho přírodních ligandů je „klasických“, zejména včetně vody.
- Cluster Chemistry: Ligandy zahrnují všechny výše uvedené i další ionty nebo atomy kovů.
- Příklad Ru 3 (CO) 12
- V některých případech existují kombinace různých polí:
- Příklad: [Fe 4 S 4 (Scysteinyl) 4 ] 2 , ve kterém se shluk je vložený v biologicky aktivních látek.
Mineralogie , věda o materiálech a chemie pevných látek - jak se vztahují na ionty kovů - jsou podmnožinami koordinační chemie v tom smyslu, že kovy jsou obklopeny ligandy. V mnoha případech jsou tyto ligandy oxidy nebo sulfidy, ale kovy jsou přesto koordinovány a platí níže uvedené zásady a pokyny. V hydrátech jsou alespoň některé z ligandů molekuly vody. Je pravda, že zaměření mineralogie, vědy o materiálech a chemie pevných látek se liší od obvyklého zaměření koordinace nebo anorganické chemie. První se týkají především polymerních struktur, vlastností vyplývajících z kolektivních účinků mnoha vysoce propojených kovů. Naproti tomu se koordinační chemie zaměřuje na reaktivitu a vlastnosti komplexů obsahujících jednotlivé atomy kovů nebo malé soubory atomů kovů.
Názvosloví koordinačních komplexů
Základní postup pro pojmenování komplexu je:
- Při pojmenování komplexního iontu jsou ligandy pojmenovány před kovovým iontem.
- Názvy ligandů jsou uvedeny v abecedním pořadí. Číselné předpony nemají na pořadí vliv.
- Více monodentátních ligandů, které se vyskytují, obdrží předponu podle počtu výskytů: di- , tri- , tetra- , penta- nebo hexa- .
- Mnoho polydentátových ligandů (např. Ethylendiamin, oxalát) dostává bis- , tris- , tetrakis- atd.
- Anionty končí o . Toto nahradí konečné „e“, když anion končí s „-ide“, „-ate“ nebo „-ite“, např. Z chloridu se stane chlorido a ze síranu se stane sulfato . Dříve byl „-ide“ změněn na „-o“ (např. Chlor a kyano ), ale toto pravidlo bylo upraveno v doporučeních IUPAC z roku 2005 a správnými formami pro tyto ligandy jsou nyní chlorido a kyanido .
- Neutrální ligandy jsou vzhledem ke své obvyklé jméno, s některými výjimkami: NH 3 se stává aminového ; H 2 O se stane aqua nebo aquo ; CO se stává karbonylem ; NO se stává nitrosylem .
- Napište název centrálního atomu / iontu. Pokud je komplexem anion, název centrálního atomu bude končit inate a bude použit jeho latinský název, pokud je k dispozici (kromě rtuti).
- Oxidační stav centrálního atomu je třeba specifikovat (je-li jeden z několika možných nebo nulový) a měl by být zapsán jako římská číslice (nebo 0) uzavřená v závorkách.
- Před názvem kationtu by měl být uveden název aniontu. (pokud je to relevantní, jako v posledním příkladu)
Příklady:
| kov | Změnil na |
|---|---|
| kobalt | kobaltan |
| hliník | hlinitany |
| chrom | chromát |
| vanadium | zmizet |
| měď | cuprate |
| žehlička | ferrát |
- [Cd (CN) 2 (en) 2 ] → dikyanidobis (ethylendiamin) kadmium (II)
- [CoCl (NH 3 ) 5 ] SO 4 → pentaamminechloridocobalt (III) sulfát
- [Cu (H 2 O) 6 ] 2+ → hexaquacopica (II) ion
- [CuCl 5 NH 3 ] 3- → amminepentachloridocuprate (II) ion
- K 4 [Fe (CN) 6 ] → hexakyanidoferát draselný (II)
- [Nicl 4 ] 2- → tetrachloridonickelate (II) ion (Použití chlor se odstraní z IUPAC konvence)
Koordinační počet ligandů připojených k více než jednomu kovu (přemosťující ligandy) je indikován indexem řeckého symbolu μ umístěného před názvem ligandu. Tak dimer z chloridu hlinitého je popsán Al 2 Cl 4 (μ 2 -Cl) 2 .
Libovolná aniontová skupina může být elektronicky stabilizována jakýmkoli kationtem. Aniontový komplex lze stabilizovat vodíkovým kationtem a stát se kyselým komplexem, který se může disociovat a uvolnit kationtový vodík. Tento druh složité sloučeniny má název s „ic“ přidaným za centrální kov. Například H 2 [Pt (CN) 4 ] má název kyselina tetracyanoplatinová (II).
Konstanta stability
Afinita kovových iontů pro ligandy je popsán konstantu stability, nazývaná také tvorba konstantní, a je reprezentován symbolem K f . Jedná se o rovnovážnou konstantu pro jeho sestavení ze základního kovu a ligandů a lze ji odpovídajícím způsobem vypočítat, jako v následujícím příkladu pro jednoduchý případ:
- xM (aq) + yL (aq) ⇌ zZ (aq)
kde: x, yaz jsou stechiometrické koeficienty každého druhu. M znamená kov / kovový ion, L pro Lewisovy báze a nakonec Z pro komplexní ionty. Formační konstanty se velmi liší. Velké hodnoty naznačují, že kov má vysokou afinitu k ligandu, pokud je systém v rovnováze.
Někdy bude konstanta stability v jiné formě známé jako konstanta destability. Tato konstanta je vyjádřena jako inverzní konstanta formace a je označena jako K d = 1 / K f . Tato konstanta představuje reverzní reakci pro rozklad komplexního iontu na jednotlivé složky kovu a ligandu. Při porovnávání hodnot pro K d , čím větší je hodnota, tím je komplexnější iont nestabilnější.
V důsledku tvorby těchto komplexních iontů v roztocích mohou také hrát klíčovou roli v rozpustnosti jiných sloučenin. Když se vytvoří komplexní iont, může změnit koncentrace svých složek v roztoku. Například:
- Ag+
(aq)+ 2NH 4 OH (vodný) ⇌ Ag (NH 3 )+
2+ H 2 O
- AgCl (s) + H 2 O (l) ⇌ Ag+
(aq) + Cl-
(aq)
Pokud se tyto reakce oba došlo ve stejné reakční nádobě, rozpustnost chloridu stříbrného by být zvýšena přítomností NH 4 OH, protože tvorba Diammine argentum (I) komplexní spotřebuje značná část volných iontů stříbra z roztoku. Podle Le Chatelierova principu to způsobí posun rovnovážné reakce pro rozpuštění chloridu stříbrného, který má jako produkt iont stříbra, doprava.
Tuto novou rozpustnost lze vypočítat na základě hodnot Kf a Ksp pro původní reakce. Rozpustnost se zjistí v podstatě spojením dvou oddělených rovnováh do jedné kombinované rovnovážné reakce a tato kombinovaná reakce je ta, která určuje novou rozpustnost. Takže K c , nová konstanta rozpustnosti, je označena:
Aplikace koordinačních sloučenin
Kovy existují v roztoku pouze jako koordinační komplexy, z toho vyplývá, že tato třída sloučenin je užitečná různými způsoby.
Bioanorganická chemie
V bioanorganické chemii a bioorganokovové chemii plní koordinační komplexy strukturní nebo katalytické funkce. Odhaduje se, že 30% bílkovin obsahuje ionty kovů. Příklady zahrnují intenzivně barevný vitaminu B 12 , na hem skupinu v hemoglobinu , na cytochromy , je chlorin skupinu v chlorofylu , a karboxypeptidáza , hydrolytický enzym důležitý při trávení. Dalším komplexním iontovým enzymem je kataláza , která rozkládá odpadní peroxid vodíku v buňce . Syntetické koordinační sloučeniny se také používají k vazbě na proteiny a zejména nukleové kyseliny (např. Protinádorové léčivo cisplatina ).
Průmysl
Homogenní katalýza je hlavní aplikací koordinačních sloučenin pro výrobu organických látek. Procesy zahrnují hydrogenaci , hydroformylaci , oxidaci . V jednom příkladu vede kombinace chloridu titaničitého a triethylaluminia ke vzniku katalyzátorů Ziegler-Natta , které se používají k polymeraci ethylenu a propylenu za vzniku polymerů, které mají velký komerční význam jako vlákna, filmy a plasty.
Nikl, kobalt a měď lze extrahovat pomocí hydrometalurgických procesů zahrnujících komplexní ionty. Jsou extrahovány ze svých rud jako aminové komplexy. Kovy lze také oddělit pomocí selektivního srážení a rozpustnosti komplexních iontů. Kyanid se používá hlavně k těžbě zlata a stříbra z jejich rud.
Ftalocyaninové komplexy jsou důležitou třídou pigmentů.
Analýza
Najednou byly použity koordinační sloučeniny k identifikaci přítomnosti kovů ve vzorku. Kvalitativní anorganická analýza byla převážně nahrazena instrumentálními analytickými metodami, jako je atomová absorpční spektroskopie (AAS), atomová emisní spektroskopie s indukčně vázanou plazmou (ICP-AES) a hmotnostní spektrometrie s indukčně vázanou plazmou (ICP-MS).
Viz také
- Aktivovaný komplex
- IUPAC nomenklatura anorganické chemie
- Koordinační klec
- Koordinační geometrie
- Koordinační izomerismus
- Koordinační polymery , ve kterých jsou opakujícími se jednotkami koordinační komplexy.
- Inkluzní sloučeniny
- Organokovová chemie se zabývá speciální třídou koordinačních sloučenin, kde jsou organické fragmenty vázány na kov alespoň prostřednictvím jednoho atomu C.
Reference
Další čtení
- De Vito, D .; Weber, J.; Merbach, AE „Vypočtené profily objemu a energie pro výměnu vody na t 2g 6 hexiaquaionů rhodia (III) a iridia (III): nezvratný důkaz pro mechanismus I a “ Anorganic Chemistry, 2004, svazek 43, strany 858–863. doi : 10,1021 / ic035096n
- Zumdahl, Steven S.Chemické principy, páté vydání. New York: Houghton Mifflin, 2005. 943–946, 957. OCLC 77760970
- Harris, D., Bertolucci, M., Symetrie a spektroskopie . 1989 New York, Dover Publications










![{\ displaystyle K_ {f} = {\ frac {[{\ text {Z}}] ^ {z}} {[{\ text {M}}]] ^ {x} [{\ text {L}}]] ^ {y}}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/868b5effa35af1d28b2bac1f0badf0e007fcf290)
