Cyklopentadien - Cyclopentadiene
|
|
|||

|
|||
| Jména | |||
|---|---|---|---|
|
Preferovaný název IUPAC
Cyklopenta-1,3-dien |
|||
| Ostatní jména
1,3-cyklopentadien
pyropentylen |
|||
| Identifikátory | |||
|
3D model ( JSmol )
|
|||
| Zkratky | CPD, HCp | ||
| 471171 | |||
| ČEBI | |||
| ChemSpider | |||
| Informační karta ECHA |
100,008,033 |
||
| Číslo ES | |||
| 1311 | |||
| Pletivo | 1,3-cyklopentadien | ||
|
PubChem CID
|
|||
| Číslo RTECS | |||
| UNII | |||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Vlastnosti | |||
| C 5 H 6 | |||
| Molární hmotnost | 66,103 g · mol −1 | ||
| Vzhled | Bezbarvá kapalina | ||
| Zápach | dráždivé, podobné terpenu | ||
| Hustota | 0,786 g cm −3 | ||
| Bod tání | -90 ° C; -130 ° F; 183 K. | ||
| Bod varu | 39 až 43 ° C; 102 až 109 ° F; 312 až 316 K. | ||
| nerozpustný | |||
| Tlak páry | 400 mmHg (53 kPa) | ||
| Kyselost (p K a ) | 16 | ||
| Konjugovaná základna | Cyklopentadienylový aniont | ||
| −44,5 × 10 −6 cm 3 mol −1 | |||
| Struktura | |||
| Planární | |||
| Termochemie | |||
|
Tepelná kapacita ( C )
|
115,3 JK −1 mol −1 | ||
|
Standardní molární
entropie ( S |
182,7 JK −1 mol −1 | ||
| Nebezpečí | |||
| Bod vzplanutí | 25 ° C (77 ° F; 298 K) | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
|
LC 50 ( střední koncentrace )
|
14 182 ppm (krysa, 2 hodiny) 5091 ppm (myš, 2 hodiny) |
||
| NIOSH (limity expozice USA pro zdraví): | |||
|
PEL (přípustné)
|
PEL 75 ppm (200 mg/m 3 ) | ||
|
REL (doporučeno)
|
PEL 75 ppm (200 mg/m 3 ) | ||
|
IDLH (bezprostřední nebezpečí)
|
750 ppm | ||
| Související sloučeniny | |||
|
Související uhlovodíky
|
Benzen Cyclobutadiene cyklopenten |
||
|
Související sloučeniny
|
Dicyklopentadien | ||
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Reference na infobox | |||
Cyklopentadienu je organická sloučenina se vzorcem C 5 H 6 . Často se zkracuje na CpH, protože cyklopentadienylový anion se zkracuje na Cp - .
Tato bezbarvá kapalina má silný a nepříjemný zápach . Při pokojové teplotě se tento cyklický dien v průběhu hodin dimerizuje za vzniku Dicyklopentadienu pomocí Diels -Alderovy reakce . Tento dimer lze obnovit zahřátím za vzniku monomeru.
Sloučenina se používá hlavně k výrobě cyklopentenu a jeho derivátů. S oblibou se používá jako prekurzor cyklopentadienylového aniontu (Cp - ), což je důležitý ligand v cyklopentadienylových komplexech v organokovové chemii .
Výroba a reakce
Produkce cyklopentadienu se obvykle neliší od dicyklopentadienu, protože dochází k jejich vzájemné přeměně. Získávají se z uhelného dehtu (asi 10-20 g / t) a parní krakování z nafty (cca 14 kg / t). K získání cyklopentadienového monomeru se komerční dicyklopentadien rozbije zahřátím na přibližně 180 ° C. Monomer se sebere destilací a použije se krátce poté. Při tom je vhodné použít nějakou formu frakcionační kolony , aby se odstranil refluxující nekrápaný dimer.
Sigmatropické přeskupení
Atomy vodíku v cyklopentadienu, podléhá rychlé [1,5] -sigmatropic posuny , jak je naznačeno 1 H NMR spekter zaznamenané při různých teplotách. Ještě fluxionálnější jsou deriváty C 5 H 5 E (CH 3 ) 3 (E = Si , Ge , Sn ), kde těžší prvek migruje z uhlíku na uhlí s nízkou aktivační bariérou.
Reakce Dielse – Olše
Cyklopentadien je vysoce reaktivní dien v Dielsově -Alderově reakci, protože k dosažení geometrie obalu přechodového stavu ve srovnání s jinými dieny je zapotřebí minimální zkreslení dienu. Je známo, že cyklopentadien dimerizuje. Ke konverzi dochází v hodinách při pokojové teplotě, ale monomer lze skladovat několik dní při -20 ° C.
Deprotonace
Sloučenina je neobvykle kyselá (p K = 16) pro uhlovodík , fakt vysvětlit vysokou stabilitou aromatického cyklopentadienylového aniontu , C
5H-
5. Deprotonace může být dosaženo řadou zásad, typicky hydridem sodným, kovem sodným a butyllithiem . Soli tohoto aniontu jsou komerčně dostupné, včetně cyklopentadienidu sodného a cyklopentadienidu lithného . Používají se k přípravě cyklopentadienylových komplexů .
Metalocenové deriváty
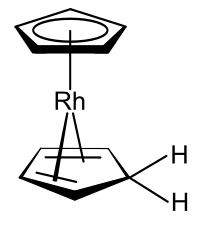
Metaloceny a příbuzné cyklopentadienylové deriváty byly intenzivně zkoumány a vzhledem ke své vysoké stabilitě představují základní kámen organokovové chemie . První metalocen vyznačený tím, ferrocenu , se připraví tak, jak se připraví řada dalších metaloceny Spojením deriváty alkalických kovů formě MC 5 H 5 s dihalogenidů z přechodných kovů : Jako typický příklad, nickelocene formy upon léčení nikl (II) chlorid s cyklopentadienid sodný v THF .
- NiCl 2 + 2 NaC 5 H 5 → Ni (C 5 H 5 ) 2 + 2 NaCl
Jsou známy organokovové komplexy, které zahrnují jak cyklopentadienylový anion, tak samotný cyklopentadien, přičemž jedním příkladem je rhodocenový derivát vyrobený z rhodocenového monomeru v protických rozpouštědlech .
Organická syntéza
Byl to výchozí materiál při syntéze dodecahedranu Leo Paquette z roku 1982 . První krok zahrnoval redukční dimerizaci molekuly za vzniku dihydrofulvalenu , nikoli jednoduché přidání za vzniku dicyklopentadienu.
Využití
Kromě toho, že slouží jako prekurzor katalyzátorů na bázi cyklopentadienylu, je hlavní komerční aplikace cyklopentadienu jako prekurzor pro komonomery . Semi-hydrogenací se získá cyklopenten . Diels-Alderova reakce s butadienem dává ethyliden norbornen , komonomer při výrobě EPDM kaučuků .
Deriváty

Cyklopentadien může nahradit jeden nebo více vodíků za vzniku derivátů s kovalentními vazbami:
- Objemné cyklopentadiény
- Calicene
- Cyklopentadienon
- Di -terc -butylcyklopentadien
- Methylcyklopentadien
- Pentamethylcyklopentadien
- Pentacyanocyklopentadien
Většina těchto substituovaných cyklopentadienů může také tvořit anionty a spojovat cyklopentadienylové komplexy .