Enol - Enol
Enoly , nebo více formálně, alkenoly , jsou typem reaktivní struktury nebo meziproduktu v organické chemii, který je reprezentován jako alken ( olefin ) s hydroxylovou skupinou připojenou k jednomu konci alkenové dvojné vazby . Termíny enol a alkenol jsou kontaminace vyplývající z „-en“ / „alken“ a „ol“ přípona označující hydroxylové skupiny z alkoholů , kapací terminál „-e“ prvního členu. Tvorba enolů často zahrnuje odstranění vodíku sousedícího ( a- ) s karbonylovou skupinou - tj. Deprotonace , jeho odstranění jako protonu , H + . Když se tento proton nevrátí na konci postupného procesu, výsledkem je anion nazývaný enolát (viz obrázky vpravo). Zobrazené enolátové struktury jsou schematické; modernější reprezentace bere v úvahu molekulární orbitaly, které jsou tvořeny a obsazeny elektrony v enolátu. Podobně je tvorba enolu často doprovázena "zachycením" nebo maskováním hydroxyskupiny jako etheru, jako je silyl-enolether .
V organické chemii se keto – enol tautomerismem označuje chemická rovnováha mezi keto formou ( keton nebo aldehyd ) a enolem ( alkohol ). O keto a enol formě se říká, že jsou navzájem tautomery . Vzájemná přeměna těchto dvou forem zahrnuje pohyb alfa atomu vodíku a reorganizaci vazebných elektronů ; Proto, izomerie kvalifikuje jako tautomerie.
Enolizace
Organické estery , ketony a aldehydy s a-vodíkem (vazba CH sousedící s karbonylovou skupinou ) často tvoří enoly. Reakce zahrnuje migraci protonu z uhlíku na kyslík:
- RC (O) CHR ' 2 RC (OH) = CR' 2
V případě ketonů se konverze nazývá keto-enol tautomerismus, ačkoli tento název se často obecněji aplikuje na všechny takové tautomerizace. Rovnovážná konstanta je obvykle tak malá, že enol je spektroskopicky nezjistitelný.
V některých sloučeninách se dvěma (nebo více) karbonyly se stává dominantní enolová forma. Chování 2,4-pentandionu ilustruje tento účinek:
| karbonyl | enol | K enolizace |
|---|---|---|
| CH 3 CHO | CH 2 = CHOH | 5,8 x 10 −7 |
| CH 3 C (O) CH 3 | CH 3 C (OH) = CH 2 | 5,12 x 10 −7 |
| CH 3 CO 2 CH 3 | CH 2 = CH (OH) OCH 3 | 4x10 −20 |
| C 6 H 5 C (O) CH 3 | C 6 H 5 C (OH) = CH 2 | 1 x 10 −8 |
| CH 3 C (O) CH 2 C (O) CH 3 | CH 3 C (O) CH = C (OH) CH 3 | 0,27 |
Enoly jsou deriváty vinylalkoholu s C = C-OH konektivitou. Deprotonace organických karbonylů poskytuje enolátový anion , které jsou silným nukleofilem . Klasický příklad upřednostňování ketoformy lze vidět v rovnováze mezi vinylalkoholem a acetaldehydem (K = [enol] / [keto] ≈ 3 × 10 −7 ). V 1,3-diketonech , jako je acetylaceton (2,4-pentandion), je upřednostňována enolová forma.
Kyselinou katalyzovaná konverze enolu na ketoformu probíhá přenosem protonů z O na uhlík. Proces neprobíhá intramolekulárně, ale vyžaduje účast rozpouštědla nebo jiných mediátorů.
Stereochemie ketonizace
Pokud R 1 a R 2 jsou (poznámka rovnice v horní části stránky) různé substituenty, je nový stereocentrum vytvořený v alfa poloze, kdy enolu převede se na své keto-formě. V závislosti na povaze tří R skupin by výslednými produkty v této situaci byly diastereomery nebo enantiomery .
Enedioly
Enedioly jsou alkeny s hydroxylovou skupinou na každém uhlíku dvojné vazby C = C. Normálně jsou takové sloučeniny znevýhodněnými složkami v rovnováze s acyloiny . Jedním zvláštním případem je katechol , kde je podjednotka C = C součástí aromatického kruhu. V některých dalších případech jsou však enedioly stabilizovány hraničními karbonylovými skupinami. Tyto stabilizované enedioly se nazývají reduktony . Takové druhy jsou důležité v glykochemii, např. Transformace Lobry de Bruyn-van Ekenstein .
 Keto-enediolové tautomerizace. Enediol ve středu; izomery acyloinu vlevo a vpravo. Př. je hydroxyaceton , zobrazený vpravo.
Keto-enediolové tautomerizace. Enediol ve středu; izomery acyloinu vlevo a vpravo. Př. je hydroxyaceton , zobrazený vpravo.
Fenoly
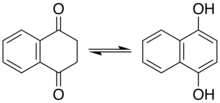
Fenoly představují druh enolu. U některých fenolů a příbuzných sloučenin hraje keto tautomer důležitou roli. Mnoho reakcí resorcinolu zahrnuje například keto tautomer. Naftalen-1,4-diol existuje ve viditelné rovnováze s diketon-tetrahydronaftalen-1,4-dionem.
Biochemie
Keto – enol tautomerismus je důležitý v několika oblastech biochemie .
Vysoký potenciál přenosu fosforečnanů fosfoenolpyruvátu vyplývá ze skutečnosti, že fosforylovaná sloučenina je „zachycena“ v méně termodynamicky příznivé enolové formě, zatímco po defosforylaci může převzít ketoformu.
Enzym enoláza katalyzuje dehydrataci kyseliny 2-phosphoglyceric k esteru enol fosfát. Metabolismus PEP na kyselinu pyrohroznovou prostřednictvím pyruvátkinázy (PK) generuje adenosintrifosfát (ATP) prostřednictvím fosforylace na úrovni substrátu .

|

|

|
||||
| H 2 O | ADP | ATP | ||||

|

|
|||||
| H 2 O | ||||||
Reaktivita
Terminál dvojné vazby v enolech je nukleofilní . Jeho reakce s elektrofilními organickými sloučeninami je základem obrovského významu meziproduktů na bázi enolu v široké škále důležitých životních procesů (tj. V biochemii , jako meziproduktů v reakcích katalyzovaných enzymy ) a je ústředním bodem moderní syntetické organické chemie (např. , v aplikacích aldolu a souvisejících reakcích).
Enoláty
Deprotonace enolizovatelných ketonů, aldehydů a esterů poskytuje enoláty . Enoláty lze zachytit přidáním elektrofilů na kyslík. Silylace dává silyl enol ether . Acylace poskytuje estery, jako je vinylacetát .
Stabilní enoly
Obecně jsou enoly méně stabilní než jejich keto ekvivalenty, kvůli příznivosti dvojné vazby C = O oproti dvojné vazbě C = C. Enoly však mohou být stabilizovány kineticky nebo termodynamicky.
Kineticky stabilní enoly
Kineticky stabilní enoly se velmi pomalu vracejí do keto formy. Keto forma je termodynamicky zvýhodněná, ale enol přežívá dostatečně dlouho, aby byl kineticky stabilní. Podobně jako tvorba enolu je tvorba ketonu z enolu katalyzována kyselinou nebo bází. Bez obou má forma enol poněkud dlouhou životnost. Například zahřátím ethylenglykolu na 900 ° C za nízkého tlaku se získá vinylalkohol, enol acetaldehydu. Acetaldehyd je stále výhodnější než enolová forma, ale bez katalyzátoru se tvorba pohybuje velmi pomalu.
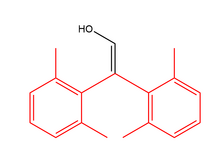
Enoly mohou být také stabilní, pokud je pro atom uhlíku velmi obtížné protonovat. Sterická zábrana může blokovat protonující látku a bez protonace nemůže být keton vytvořen. V příkladu vpravo dva benzenové kruhy chrání enol před útokem protonů, takže enol je kineticky stabilní.
Termodynamicky stabilní enoly
Termodynamicky stabilní enoly jsou stabilizovány delokalizací enolu a rezonancí. Můžeme je vytvořit přidáním funkčních skupin, které umožňují tyto efekty. Některé 1,3-dikarbonylové sloučeniny jsou relativně stabilní v enolové formě. S uspořádáním (1,3) jsou enoly konjugovány se dvěma karbonylovými skupinami. Prostřednictvím tautomerization , dva enoly jsou v rychlé rovnováze. Dalším stabilizujícím faktorem v 1,3-dikarbonylech je intramolekulární vodíková vazba. Oba tyto faktory můžeme vidět v acetylacetonu. Intramolekulární vodíková vazba vytváří příznivý šestičlenný kruh.
Kromě toho, pokud tvorba enolu vytvoří konjugovaný rezonanční systém, je zvýšená rezonance také příznivější a může stabilizovat enol. V níže uvedeném příkladu, v ketonové formě, dva kruhy nemohou tvořit jeden rezonanční systém, ale enolová forma dělá z celé molekuly plně konjugovaný systém a přidává více rezonance a stability.
Nejstabilnější enoly jsou fenoly . Enolová forma je stabilizována aromatičností, která podstatně převažuje nad příznivostí vazby C = O nad vazbou C = C. Ve výsledku tyto molekuly existují pouze ve formě fenolu a „keton“ fenolu není pozorován.
Viz také
- Alkenal
- Enoláza
- Keton
- Ynol
- Geminal diol , další forma ketonů a aldehydů ve vodných roztocích
- Regioselektivita