Rozšířená periodická tabulka - Extended periodic table
| Část série o |
| Periodická tabulka |
|---|
An prodloužené periodická tabulka teoretizuje z chemických prvků, kromě těch, v současné době známé v periodické tabulce a prokázáno, až oganesson , který dokončí sedmý období (ř) v periodické tabulce na atomové číslo ( Z ), 118. 2021, žádný prvek s úspěšně bylo syntetizováno vyšší atomové číslo než oganesson; všechny prvky v osmém období a dále tak zůstávají čistě hypotetické.
Pokud jsou objeveny další prvky s vyššími atomovými čísly, budou umístěny do dalších období, rozložených (jako u stávajících období), aby ilustrovaly periodicky se opakující trendy ve vlastnostech příslušných prvků. Očekává se, že jakákoli další období budou obsahovat větší počet prvků než sedmá perioda, protože se vypočítá, že budou mít další takzvaný g-blok , obsahující alespoň 18 prvků s částečně vyplněnými g- orbitály v každém období. Osmiperiodickou tabulku obsahující tento blok navrhl Glenn T. Seaborg v roce 1969. První prvek g-bloku může mít atomové číslo 121, a proto by měl systematický název unbiunium . Navzdory mnoha průzkumům nebyly v této oblasti syntetizovány ani objeveny žádné prvky v přírodě.
Podle orbitální aproximace v kvantově mechanických popisech atomové struktury by g-blok odpovídal prvkům s částečně vyplněnými g-orbitaly, ale efekty spojování spin-orbity snižují platnost orbitální aproximace podstatně pro prvky s vysokým atomovým číslem. Zatímco Seaborgova verze delšího období měla těžší prvky podle vzoru nastaveného lehčími prvky, protože nebrala v úvahu relativistické efekty , modely, které berou v úvahu relativistické efekty , ne. Pekka Pyykkö a Burkhard Fricke použili počítačové modelování k výpočtu poloh prvků až do Z = 172 a zjistili, že několik z nich bylo vytěsněno z Madelungova pravidla . V důsledku nejistoty a variability v předpovědích chemických a fyzikálních vlastností prvků nad 120 v současné době neexistuje shoda ohledně jejich umístění v rozšířené periodické tabulce.
Prvky v této oblasti budou pravděpodobně vysoce nestabilní, pokud jde o radioaktivní rozpad, a budou podléhat alfa rozpadu nebo spontánnímu štěpení s extrémně krátkými poločasy rozpadu , i když se předpokládá , že prvek 126 je na ostrově stability, který je odolný vůči štěpení, ale nikoli vůči alfa rozklad. Mohou být také možné další ostrůvky stability mimo známé prvky, včetně jednoho teoretizovaného kolem prvku 164, ačkoli rozsah stabilizačních účinků uzavřených jaderných granátů je nejistý. Není jasné, kolik prvků za očekávaným ostrovem stability je fyzicky možné, zda je období 8 dokončeno nebo zda existuje období 9. Mezinárodní unie pro čistou a aplikovanou chemii (IUPAC) definuje prvek, který má existovat, pokud je jeho životnost je delší než 10 - 14 sekund (0,01 pikosekundy nebo 10 femtosekund), což je doba, za kterou jádro vytvoří elektronový oblak .
Již v roce 1940 bylo zjištěno, že zjednodušená interpretace relativistické Diracovy rovnice naráží na problémy s elektronovými orbitaly na Z > 1/α ≈ 137, což naznačuje, že neutrální atomy nemohou existovat za prvkem 137 a že je založena periodická tabulka prvků na elektronových orbitálech se proto v tomto místě rozpadá. Na druhé straně přísnější analýza vypočítá analogickou mez jako Z ≈ 173, kde se subshell 1s ponoří do Diracového moře , a že místo prvku 173 nemohou existovat neutrální atomy, ale holá jádra, takže nepředstavují žádné překážka dalšího rozšiřování periodického systému. Atomy mimo toto kritické atomové číslo se nazývají nadkritické atomy.
Dějiny
Těžší prvky mimo aktinidy byly poprvé navrženy tak, aby existovaly již v roce 1895, kdy dánský chemik Hans Peter Jørgen Julius Thomsen předpověděl, že thorium a uran tvoří součást období 32 prvků, které končí chemicky neaktivním prvkem s atomovou hmotností 292 ( nedaleko od 294 dnes známého pro první a jediný objevený izotop oganesson ). V roce 1913 švédský fyzik Johannes Rydberg podobně předpověděl, že příští vzácný plyn po radonu bude mít atomové číslo 118, a čistě formálně odvodil ještě těžší kongenéry radonu při Z = 168, 218, 290, 362 a 460, přesně tam, kde Aufbau princip by je předpovídal. Niels Bohr předpověděl v roce 1922 elektronickou strukturu tohoto dalšího vzácného plynu na Z = 118 a navrhl, že důvodem, proč prvky mimo uran nebyly v přírodě vidět, bylo to, že byly příliš nestabilní. Německý fyzik a inženýr Richard Swinne publikoval v roce 1926 recenzní dokument obsahující předpovědi o transuranických prvcích (možná vytvořil termín), ve kterém očekával moderní předpovědi ostrova stability : od roku 1914 předpokládal, že poločasy by neměly přísně klesat s atomovým číslem, ale místo toho navrhl, že by mohly existovat některé prvky s delší životností na Z = 98–102 a Z = 108–110, a spekuloval, že takové prvky mohou existovat v zemském jádru , v železných meteoritech nebo v ledové čepice Grónska, kde byli zavřeni před jejich údajným kosmickým původem. V roce 1955 se tyto prvky nazývaly supertěžké prvky.
První předpovědi vlastností neobjevených supertěžkých prvků byly provedeny v roce 1957, kdy byl poprvé prozkoumán koncept jaderných granátů a byl teoretizován ostrov stability kolem prvku 126. V roce 1967 byly provedeny přísnější výpočty a ostrov stability byl teoreticky soustředěn na tehdy ještě neobjevené flerovium (prvek 114); tato a další následné studie motivovaly mnoho výzkumníků k hledání supertěžkých prvků v přírodě nebo se je pokoušely syntetizovat na urychlovačích. V 70. letech bylo provedeno mnoho hledání supertěžkých prvků, vše s negativními výsledky. V prosinci 2018 byla provedena syntéza pro každý prvek až do a včetně unbiseptia ( Z = 127), kromě unbitria ( Z = 123), přičemž nejtěžší úspěšně syntetizovaný prvek byl oganesson v roce 2002 a nejnovější objev byl tennessin v roce 2010.
Jak bylo předpovězeno, že některé supertěžké prvky leží mimo periodickou tabulku se sedmi periodami, další osmé období obsahující tyto prvky bylo poprvé navrženo Glennem T. Seaborgem v roce 1969. Tento model pokračoval ve vzorci zavedených prvků a zavedl nový g-blok a řada superaktinidů začínající na prvku 121, zvyšující počet prvků v období 8 ve srovnání se známými obdobími. Tyto rané výpočty nezohlednily relativistické efekty, které rozbíjejí periodické trendy a znemožňují jednoduchou extrapolaci. V roce 1971 vypočítal Fricke periodickou tabulku až do Z = 172 a zjistil, že některé prvky skutečně mají odlišné vlastnosti, které narušují zavedený vzorec, a výpočet Pekka Pyykkö z roku 2010 také poznamenal, že několik prvků se může chovat jinak, než se očekávalo. Není známo, jak daleko může periodická tabulka přesahovat známých 118 prvků, protože se předpokládá, že těžší prvky budou stále nestabilnější. Glenn T. Seaborg navrhl, že prakticky řečeno, konec periodické tabulky může kvůli jaderné nestabilitě přijít již kolem Z = 120.
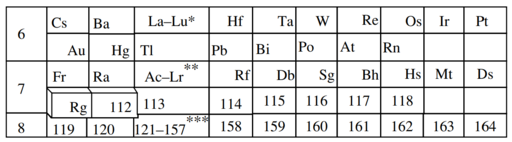
Predikované struktury rozšířené periodické tabulky
V současné době neexistuje shoda na umístění prvků nad atomové číslo 120 v periodické tabulce.
Všechny tyto hypotetické neobjevené prvky jsou pojmenovány podle standardu systematického názvu prvku Mezinárodní unie čisté a aplikované chemie (IUPAC), který vytváří obecný název pro použití, dokud není prvek objeven, potvrzen a schválen oficiální název. Tato jména se v literatuře obvykle nepoužívají a jsou označována jejich atomovými čísly; prvek 164 by proto obvykle neměl být nazýván „unhexquadium“ nebo „Uhq“ (systematický název a symbol IUPAC), ale spíše „prvek 164“ se symbolem „164“, „(164)“ nebo „E164“.
Aufbauův princip
U prvku 118 se předpokládá, že orbitaly 1s, 2s, 2p, 3s, 3p, 3d, 4s, 4p, 4d, 4f, 5s, 5p, 5d, 5f, 6s, 6p, 6d, 7s and 7p jsou vyplněny, přičemž zbývající orbitaly nevyplněny. Jednoduchá extrapolace z Aufbauova principu by předpovídala osmou řadu k vyplnění orbitálů v pořadí 8s, 5g, 6f, 7d, 8p; ale po prvku 120 blízkost elektronových obalů činí umístění v jednoduché tabulce problematickým.
| 1 | 1 H |
2 On |
||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2 | 3 Li |
4 Be |
5 B |
6 C. |
7 N. |
8 O |
9 F |
10 Ne |
||||||||||||||||||||||||||||||||||||||||||
| 3 | 11 Na |
12 mg |
13 Al |
14 Si |
15 str |
16 S. |
17 Cl |
18 Ar |
||||||||||||||||||||||||||||||||||||||||||
| 4 | 19 K. |
20 Ca |
21 Sc |
22 Ti |
23 V. |
24 kr |
25 Mn |
26 Fe |
27 Co |
28 Ni |
29 Cu |
30 Zn |
31 Ga |
32 Ge |
33 As |
34 Se |
35 Br |
36 kr |
||||||||||||||||||||||||||||||||
| 5 | 37 Rb |
38 Sr |
39 Y |
40 Zr |
41 Nb |
42 Mo |
43 Tc |
44 Ru |
45 Rh |
46 Pd |
47 Ag |
48 Cd |
49 palců |
50 Sn |
51 Sb |
52 Te |
53 já |
54 Xe |
||||||||||||||||||||||||||||||||
| 6 | 55 Cs |
56 Ba |
57 La |
58 Ce |
59 Pr |
60 Nd |
61 hodin |
62 Sm |
63 Eu |
64 Gd |
65 Tb |
66 Dy |
67 Ho |
68 Er |
69 Tm |
70 Yb |
71 Lu |
72 Hf |
73 Ta |
74 W. |
75 Re |
76 Os |
77 Ir |
78 Pt |
79 Au |
80 Hg |
81 Tl |
82 Pb |
83 Bi |
84 Po |
85 v |
86 Rn |
||||||||||||||||||
| 7 | 87 Fr |
88 Ra |
89 Ac |
90 tis |
91 Pa |
92 U |
93 Np |
94 Pu |
95 dop |
96 cm |
97 Bk |
98 Srov |
99 Es |
100 Fm |
101 Md |
102 č |
103 Lr |
104 Rf |
105 Db |
106 Sg |
107 Bh |
108 hod |
109 Mt |
110 Ds |
111 Rg |
112 Cn |
113 Nh |
114 Fl |
115 Mc |
116 Lv |
117 Ts |
118 Og |
||||||||||||||||||
| 8 | 119 Uue |
120 Ubn |
121 Ubu |
122 Ubb |
123 Ubt |
124 Ubq |
125 Ubp |
126 Ubh |
127 Ubs |
128 Ubo |
129 Ube |
130 Utn |
131 Utu |
132 Utb |
133 Utt |
134 Utq |
135 utp |
136 Uth |
137 Uts |
138 Uto |
139 Ute |
140 Uqn |
141 Uqu |
142 Uqb |
143 Uqt |
144 Uqq |
145 Uqp |
146 Uqh |
147 Uqs |
148 Uqo |
149 Uqe |
150 Upn |
151 Upu |
152 Upb |
153 Upt |
154 Upq |
155 Upp |
156 Uph |
157 ups |
158 Upo |
159 Upe |
160 Uhn |
161 Uhu |
162 Uhb |
163 Uht |
164 Uhq |
165 Uhp |
166 Uhh |
167 Uhs |
168 Uho |
Pyykkö
Ne všechny modely ukazují vyšší prvky podle vzoru stanoveného lehčími prvky. Pekka Pyykkö například pomocí počítačového modelování vypočítal polohy prvků až do Z = 172 a jejich možné chemické vlastnosti v článku publikovaném v roce 2011. Zjistil, že několik prvků bylo vytlačeno z pravidla Madelungova uspořádání energie v důsledku překrývající se orbitaly; je to způsobeno rostoucí rolí relativistických efektů v těžkých prvcích.
Fricke
Burkhard Fricke a kol., Kteří provedli výpočty až k prvku 184 v článku publikovaném v roce 1971, také zjistili, že některé prvky jsou vytlačeny z Aufbauova principu v důsledku relativistických efektů.
| H | On | |||||||||||||||||||||||||||||||
| Li | Být | B | C | N. | Ó | F | Ne | |||||||||||||||||||||||||
| Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| K | Ca | Sc | Ti | PROTI | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | Tak jako | Se | Br | Kr | |||||||||||||||
| Rb | Sr | Y | Zr | Pozn | Mo | Tc | Ru | Rh | Pd | Ag | CD | v | Sn | Sb | Te | Já | Xe | |||||||||||||||
| Čs | Ba | Los Angeles | Ce | Pr | Nd | Odpoledne | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | Na | Rn | |
| Fr | Ra | Ac | Th | Pa | U | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 119 | 120 | 121 | 122–141 | 142 | 143 | 144 | 145 | 146 | 147 | 148 | 149 | 150 | 151 | 152 | 153 | 154 | 155 | 156 | 157 | 158 | 159 | 160 | 161 | 162 | 163 | 164 | ||||||
| 165 | 166 | 167 | 168 | 169 | 170 | 171 | 172 |
Nefedov
Nefedov , Trzhaskovskaya a Yarzhemskii provedli výpočty až 164 (výsledky publikované v roce 2006). Na rozdíl od Pyykkö, stejně jako Fricke a kol., Považovali prvky 158 až 164 za homology skupin 4 až 10, a nikoli 6 až 12, přičemž si všimli podobností elektronových konfigurací s přechodnými kovy období 5. Prvky 111 a 112 jsou posunuty z roviny tak, aby odrážely odlišné konfigurace od Au a Hg.
Kulsha
Výpočetní chemik Andrey Kulsha navrhl dvě formy rozšířené periodické tabulky. Na základě svých pravděpodobných chemických vlastností jsou prvky 157–172 umístěny jako kongenery osmého období yttria prostřednictvím xenonu v pátém období; to odpovídá výpočtům Nefedova a kol. z roku 2006. V Kulshově prvním návrhu (2011, poté, co byl publikován článek Pyykkö), jsou prvky 121–138 a 139–156 umístěny jako dvě oddělené řady (společně nazývané „ultranzionové prvky“), které souvisejí s přidáním 5g 18 subshell do jádra, protože napodobují lanthanoidy a aktinidy. Ve svém druhém návrhu (2016) prvky 121–142 tvoří g-blok (protože mají aktivitu 5g), zatímco prvky 143–156 tvoří f-blok umístěný pod aktiniem prostřednictvím nobeliia.
Hledá neobjevené prvky
Syntetické pokusy
Byly provedeny neúspěšné pokusy syntetizovat prvky 8 období až do unbiseptia, kromě unbitria. Pokusy syntetizovat ununenium, první prvek období 8, probíhají od roku 2021.
Ununenium
O syntézu ununenia se poprvé pokusili v roce 1985 bombardováním cíle einsteinium -254 ionty vápníku -48 na urychlovači superHILAC v Berkeley v Kalifornii:
-
254
99Es
+ 48
20Ca
→ 302
119Uue
* → žádné atomy
Nebyly identifikovány žádné atomy, což vedlo k omezujícímu průřezu 300 nb . Pozdější výpočty naznačují, že průřez 3n reakce (což by mělo za následek 299 Uue a tři neutrony jako produkty) by ve skutečnosti byl šest set tisíckrát nižší než tato horní hranice, při 0,5 pb.
Jelikož ununennium je nejlehčím neobjeveným prvkem, bylo v posledních letech cílem syntézních experimentů německých i ruských týmů. Ruské experimenty byly provedeny v roce 2011 a nebyly zveřejněny žádné výsledky, což silně naznačuje, že nebyly identifikovány žádné atomy ununenium. Od dubna do září 2012 byl proveden pokus o syntézu izotopů 295 Uue a 296 Uue bombardováním cíle berkelium -249 titanem -50 v Centru těžkého iontového výzkumu GSI Helmholtz v německém Darmstadtu . Na základě teoreticky předpovězeného průřezu se očekávalo, že atom ununenium bude syntetizován do pěti měsíců od začátku experimentu.
-
249
97Bk
+ 50
22Ti
→ 299
119Uue
* → 296
119Uue
+ 3 1
0
n
-
249
97Bk
+ 50
22Ti
→ 299
119Uue
* → 295
119Uue
+ 4 1
0
n
Experiment měl původně pokračovat do listopadu 2012, ale byl brzy zastaven, aby bylo možné použít cíl 249 Bk k potvrzení syntézy tennessinu (čímž se projektily změnily na 48 Ca). Tato reakce mezi 249 Bk a 50 Ti byla předpovězena jako nejpříznivější praktická reakce pro tvorbu ununenium, protože je spíše asymetrická, i když poněkud studená. (Reakce mezi 254 Es a 48 Ca by byla lepší, ale připravit miligramová množství 254 Es na cíl je obtížná.) Nezbytná změna ze „stříbrné střely“ 48 Ca na 50 Ti však dělí očekávaný výnos ununenium o asi dvacet, protože výtěžek silně závisí na asymetrii fúzní reakce.
Vzhledem k předpokládaným krátkým poločasům tým GSI použil novou „rychlou“ elektroniku schopnou zaregistrovat rozpadové události během mikrosekund. Nebyly identifikovány žádné atomy ununenium, což znamená omezující průřez 70 fb. Předpovídaný skutečný průřez je kolem 40 fb, což je na hranicích současné technologie.
Tým ze Společného institutu pro jaderný výzkum v Dubně v Rusku plánoval zahájit experimenty na syntéze ununenium a unbinilium pomocí reakcí 249 Bk+ 50 Ti a 249 Cf+ 50 Ti v roce 2019 s využitím nového experimentálního komplexu. Tým v japonské RIKEN také plánoval provést pokusy o tyto prvky počínaje rokem 2018 s 248 Cm cíli pomocí reakcí 248 Cm+ 51 V a 248 Cm+ 54 Cr. První z nich probíhá od června 2018.
Unbinilium
Po úspěchu při získávání oganisů reakcí mezi 249 Cf a 48 Ca v roce 2006 zahájil tým ve Společném institutu pro jaderný výzkum (JINR) v Dubně podobné experimenty v březnu až dubnu 2007 v naději, že vytvoří unbinilium (prvek 120) z jader 58 Fe a 244 Pu . Předpokládá se, že izotopy unbinilium mají poločasy rozpadu alfa v řádu mikrosekund . Počáteční analýza odhalila, že nebyly vytvořeny žádné atomy unbinilium, což poskytuje limit 400 fb pro průřez studovanou energií.
-
244
94Pu
+ 58
26Fe
→ 302
120Ubn
* → žádné atomy
Ruský tým plánoval modernizaci svých zařízení, než se znovu pokusí o reakci.
V dubnu 2007 se tým z GSI Helmholtz Center for Heavy Ion Research v německém Darmstadtu pokusil vytvořit unbinilium pomocí uranu -238 a niklu -64:
-
238
92U
+ 64
28Ni
→ 302
120Ubn
* → žádné atomy
Nebyly detekovány žádné atomy poskytující limit 1,6 pb pro průřez při poskytnuté energii. GSI zopakoval experiment s vyšší citlivostí ve třech samostatných cyklech v dubnu až květnu 2007, lednu až březnu 2008 a září až říjnu 2008, všechny s negativními výsledky a dosáhly hranice průřezu 90 fb.
V červnu až červenci 2010 a znovu v roce 2011 se vědci z GSI po upgradu vybavení, které umožnilo použití více radioaktivních cílů, pokusili o asymetrickější fúzní reakci:
-
248
96Cm
+ 54
24Cr
→ 302
120Ubn
* → žádné atomy
Očekávalo se, že změna reakce zdvojnásobí pravděpodobnost syntézy unbinilia, protože výtěžek takových reakcí je silně závislý na jejich asymetrii. Byly pozorovány tři korelované signály, které odpovídaly předpovězeným energiím rozpadu alfa 299 Ubn a její dcery 295 Og, stejně jako experimentálně známé energii rozpadu její vnučky 291 Lv . Životnost těchto možných rozpadů však byla mnohem delší, než se očekávalo, a výsledky nebylo možné potvrdit.
V srpnu až říjnu 2011 vyzkoušel jiný tým na GSI využívající zařízení TASCA novou, ještě více asymetrickou reakci:
-
249
98Srov
+ 50
22Ti
→ 299
120Ubn
* → žádné atomy
Vzhledem ke své asymetrii byla reakce mezi 249 Cf a 50 Ti předpovězena jako nejpříznivější praktická reakce pro syntézu unbinilium, i když je také poněkud chladná. Nebyly identifikovány žádné atomy unbinilium, což znamená omezující průřez 200 fb. Jens Volker Kratz předpověděl, že skutečný maximální průřez pro produkci unbinilia jakoukoli z těchto reakcí bude kolem 0,1 fb; pro srovnání, světový rekord pro nejmenší průřez úspěšné reakce byl 30 fb pro reakci 209 Bi ( 70 Zn, n) 278 Nh a Kratz předpovídal maximální průřez 20 fb pro produkci sousedního ununenium. Pokud jsou tyto předpovědi přesné, pak by syntéza ununenium byla na hranicích současné technologie a syntetizace unbinilium by vyžadovala nové metody.
Unbiunium
Syntéza unbiunium byl poprvé pokusil v roce 1977 tím, že bombarduje cíl uranu-238 s mědí -65 ionty na Gesellschaft fur Schwerionenforschung v Darmstadt , Německo:
-
238
92U
+ 65
29Cu
→ 303
121Ubu
* → žádné atomy
Nebyly identifikovány žádné atomy.
Unbibium
První pokusy syntetizovat nebibium byly provedeny v roce 1972 Flerovem et al. ve Společném institutu pro jaderný výzkum (JINR) pomocí reakcí horké fúze vyvolané těžkými ionty:
-
238
92U
+ 66,68
30Zn
→ 304, 306
122Ubb
* → žádné atomy
Tyto experimenty byly motivovány časnými předpověďmi existence ostrova stability při N = 184 a Z > 120. Nebyly detekovány žádné atomy a byl změřen limit výtěžku 5 nb (5 000 pb ). Aktuální výsledky (viz flerovium ) ukázaly, že citlivost těchto experimentů byla příliš nízká alespoň o 3 řády.
V roce 2000 provedlo Centrum pro těžký iontový výzkum Gesellschaft für Schwerionenforschung (GSI) Helmholtz velmi podobný experiment s mnohem vyšší citlivostí:
-
238
92U
+ 70
30Zn
→ 308
122Ubb
* → žádné atomy
Tyto výsledky naznačují, že syntéza takových těžších prvků zůstává významnou výzvou a je vyžadováno další zlepšení intenzity paprsku a experimentální účinnosti. Citlivost by měla být v budoucnu zvýšena na 1 fb, aby se dosáhlo kvalitnějších výsledků.
Další neúspěšný pokus syntetizovat nebibium byl proveden v roce 1978 v GSI Helmholtz Center, kde byl přírodní erbiový cíl bombardován ionty xenon-136 :
-
nat
68Er
+ 136
54Xe
→ 298, 300, 302, 303, 304, 306
Ubb
* → žádné atomy
Zejména se očekávalo , že reakce mezi 170 Er a 136 Xe poskytne alfa zářiče s poločasy mikrosekund, které by se rozpadly až na izotopy flerovia s poločasy rozpadu, které by se možná zvýšily až na několik hodin, protože se předpokládá, že flerovium bude ležet blízko střed ostrova stability . Po dvanácti hodinách ozařování nebylo v této reakci nic nalezeno. Po podobném neúspěšném pokusu syntetizovat unbiunium z 238 U a 65 Cu byl učiněn závěr, že poločasy supertěžkých jader musí být menší než jedna mikrosekunda nebo jsou průřezy velmi malé. Novější výzkum syntézy supertěžkých prvků naznačuje, že oba závěry jsou pravdivé. Oba pokusy v 70. letech o syntézu nebibia byly poháněny výzkumem zkoumajícím, zda by se potenciálně přirozeně mohly vyskytovat supertěžké prvky.
V letech 2000 až 2004 bylo ve Flerovově laboratoři jaderných reakcí provedeno několik experimentů studujících štěpné charakteristiky různých supertěžkých sloučeninových jader, jako je 306 Ubb . Byly použity dvě jaderné reakce, konkrétně 248 Cm + 58 Fe a 242 Pu + 64 Ni. Výsledky odhalují, jak supertěžká jádra štěpí převážně vyloučením jader uzavřených obalů, jako je 132 Sn (Z = 50, N = 82). Bylo také zjištěno, že výtěžek pro dráhu fúzního štěpení byl podobný mezi 48 Ca a 58 Fe projektily, což naznačuje možné budoucí použití 58 Fe projektilů při tvorbě supertěžkých prvků.
Unbiquadium
Vědci z GANIL (Grand Accélérateur National d'Ions Lourds) se pokusili změřit přímé a opožděné štěpení složených jader prvků se Z = 114, 120 a 124, aby prozkoumali efekty skořápky v této oblasti a určili další sférický proton skořápka. To je proto, že mají kompletní jaderných skořápky (nebo ekvivalentně, které mají řadu magický z protonů a neutronů ) by jí větší stabilitu na jádrech těchto superheavy prvků, čímž se přibližuje k ostrov stability . V roce 2006, s úplnými výsledky publikovanými v roce 2008, tým poskytl výsledky z reakce zahrnující bombardování cíle přirozeného germania ionty uranu:
-
238
92U
+ nat
32Ge
→ 308, 310, 311, 312, 314
Ubq
* → štěpení
Tým oznámil, že byli schopni identifikovat štěpení složených jader s poločasy> 10 −18 s. Tento výsledek naznačuje silný stabilizační účinek při Z = 124 a ukazuje na další protonovou skořepinu při Z > 120, nikoli při Z = 114, jak se dříve předpokládalo. Složené jádro je volná kombinace nukleonů, které se dosud neuspořádaly do jaderných obalů. Nemá žádnou vnitřní strukturu a drží je pohromadě pouze kolizními silami mezi jádrem cíle a projektilu. Odhaduje se, že to vyžaduje asi 10 až 14 s, než se nukleony uspořádají do jaderných obalů, v tomto okamžiku se složené jádro stane nuklidem a toto číslo používá IUPAC jako minimální poločas rozpadu, který musí nárokovaný izotop mít potenciálně být uznán jako objevený. To znamená, že GANIL pokusy se nepočítají jako objev prvku 124 .
Štěpení složeného jádra 312 124 bylo také studováno v roce 2006 na tandemovém urychlovači těžkých iontů ALPI v Laboratori Nazionali di Legnaro (Legnaro National Laboratories) v Itálii:
-
232
90Th
+ 80
34Se
→ 312
Ubq
* → štěpení
Podobně jako v předchozích experimentech prováděných v JINR ( Joint Institute for Nuclear Research ) se štěpné fragmenty shlukly kolem dvojnásobně magických jader, jako je 132 Sn ( Z = 50, N = 82), což odhalilo tendenci superheavy jader vylučovat taková dvojnásobně magická jádra v štěpení. Bylo také zjištěno, že se zvyšuje průměrný počet neutronů na štěpení z 312 124 složeného jádra (ve srovnání s lehčími systémy), což potvrzuje, že trend těžších jader emitujících více neutronů během štěpení pokračuje do superheavy masové oblasti.
Unbipentium
První a jediný pokus syntetizovat unbipentium byl proveden v Dubně v letech 1970–1971 za použití iontů zinku a cíle americium - 243 :
-
243
95Dopoledne
+ 66, 68
30Zn
→ 309, 311
Ubp
* → žádné atomy
Nebyly detekovány žádné atomy a byl stanoven limit průřezu 5 nb. Tento experiment byl motivován možností vyšší stability pro jádra kolem Z ~ 126 a N ~ 184, ačkoli novější výzkum naznačuje, že ostrov stability může místo toho ležet na nižším atomovém čísle (jako je copernicium , Z = 112) a syntéza těžších prvků, jako je unbipentium, bude vyžadovat citlivější experimenty.
Unbihexium
První a jediný pokus syntetizovat unbihexium , který byl neúspěšný, byl proveden v roce 1971 v CERN (Evropská organizace pro jaderný výzkum) René Bimbotem a Johnem M. Alexanderem pomocí reakce horké fúze:
-
232
90Th
+ 84
36Kr
→ 316
126Ubh
* → žádné atomy
Byly pozorovány alfa částice s vysokou energií (13-15 MeV ) a považovány za možný důkaz pro syntézu nebihexia. Následné neúspěšné experimenty s vyšší citlivostí naznačují, že citlivost 10 mb tohoto experimentu byla příliš nízká; proto je tvorba nebihexiových jader v této reakci vysoce nepravděpodobná.
Unbiseptium
První a jediný pokus o syntézu unbiseptia, který byl neúspěšný, byl proveden v roce 1978 na urychlovači UNILAC v GSI Helmholtz Center, kde byl přírodní tantalový cíl bombardován xenonovými -136 ionty:
-
nat
73Ta
+ 136
54Xe
→ 316, 317
Ubs
* → žádné atomy
Hledání v přírodě
Studie v roce 1976 skupiny amerických vědců z několika univerzit navrhuje, aby prvotní superheavy prvky, zejména livermorium , unbiquadium, unbihexium a unbiseptium, by mohla být příčinou nevysvětlitelné radiačního poškození (zejména radiohalos ) v minerálů. To přimělo mnoho vědců hledat je v přírodě v letech 1976 až 1983. Skupina vedená Tomem Cahillem, profesorem Kalifornské univerzity v Davisu , v roce 1976 tvrdila, že detekovali částice alfa a rentgenové paprsky se správnými energiemi, aby způsobit poškození, které podporuje přítomnost těchto prvků. Zejména se předpokládala přítomnost dlouhověkých (řádově 10 9 let) nebiquadiových a unbihexiových jader spolu s produkty jejich rozpadu v množství 10 −11 vzhledem k jejich možným kongenerům uranu a plutonia . Jiní tvrdili, že nikdo nebyl detekován, a zpochybnili navrhované vlastnosti prvotních supertěžkých jader. Zejména uvedli, že všechna taková supertěžká jádra musí mít uzavřený neutronový obal při N = 184 nebo N = 228, a tato nezbytná podmínka pro zvýšenou stabilitu existuje pouze v neutronech s nedostatkem izotopů livermoria nebo izotopů bohatých na neutrony ostatních prvků, které by nemusí být beta-stabilní na rozdíl od většiny přirozeně se vyskytujících izotopů. Bylo také navrženo, aby tato aktivita byla způsobena jadernými transmutacemi v přírodním ceru , což zvyšuje další nejednoznačnost při tomto nárokovaném pozorování supertěžkých prvků.
24. dubna 2008 skupina vedená Amnonem Marinovem na Hebrejské univerzitě v Jeruzalémě tvrdila, že v přirozeně se vyskytujících ložiscích thoria našla jednotlivé atomy unbibia -292 v množství mezi 10 −11 a 10 −12 v poměru k thoriu. Tvrzení Marinova a kol. byla kritizována částí vědecké komunity. Marinov tvrdil, že článek zaslal do časopisů Nature and Nature Physics, ale oba jej odmítli, aniž by jej poslali k peer review. Atomy unbibium-292 byly prohlašovány za superdeformované nebo hyperdeformované izomery s poločasem rozpadu nejméně 100 milionů let.
Kritika této techniky, dříve používaná při údajné identifikaci lehčích izotopů thoria pomocí hmotnostní spektrometrie , byla publikována ve Physical Review C v roce 2008. Vyloučení skupiny Marinov bylo publikováno ve Physical Review C po zveřejněném komentáři.
Opakování experimentu na thoriu s využitím vynikající metody Accelerator Mass Spectrometry (AMS) nepotvrdilo výsledky, a to navzdory stonásobně lepší citlivosti. Tento výsledek vyvolává značné pochybnosti o výsledcích marinovské spolupráce, pokud jde o jejich tvrzení o dlouhotrvajících izotopech thoria , roentgenia a nebibia . Je stále možné, že stopy nebibia mohou existovat pouze v některých vzorcích thoria, i když je to nepravděpodobné.
Možný rozsah prvotních supertěžkých prvků na Zemi je dnes nejistý. I když se potvrdí, že způsobili radiační poškození již dávno, nyní se mohou rozpadnout na pouhé stopy nebo dokonce úplně zmizet. Není také jisté, zda lze taková supertěžká jádra vůbec produkovat přirozeně, protože se očekává , že spontánní štěpení ukončí r-proces zodpovědný za tvorbu těžkých prvků mezi hmotností číslo 270 a 290, a to mnohem dříve, než mohou být vytvořeny prvky těžší než unbinilium .
Nedávná hypotéza se pokouší vysvětlit spektrum Przybylského hvězdy přirozeně se vyskytujícím fleroviem , unbiniliem a unbihexiem .
Predikované vlastnosti prvků osmého období
Element 118, oganesson , je nejtěžším prvkem, který byl syntetizován. Další dva prvky, prvky 119 a 120 , by mělo tvořit 8S sérii a být alkalických a kovů alkalických zemin , resp. Očekává se, že za prvkem 120 začne superaktinidová řada, když elektrony 8 s a plnění subplášťů 8p 1/2 , 7d 3/2 , 6f a 5g určí chemii těchto prvků. Úplné a přesné výpočty CCSD nejsou k dispozici pro prvky nad 122 kvůli extrémní složitosti situace: orbitaly 5g, 6f a 7d by měly mít přibližně stejnou energetickou úroveň a v oblasti prvku 160 9s, 8p 3 /2 a 9p 1/2 orbitalů by měly mít také přibližně stejnou energii. To způsobí, že se elektronové obaly mísí, takže koncepce bloku již příliš dobře neplatí, a také to povede k novým chemickým vlastnostem, které velmi ztěžují umístění některých těchto prvků v periodické tabulce.

Chemické a fyzikální vlastnosti
Prvky 119 a 120
Některé předpovídané vlastnosti prvků 119 a 120 Vlastnictví 119 120 Standardní atomová hmotnost [322] [325] Skupina 1 2 Valence elektronová konfigurace 8s 1 8s 2 Stabilní oxidační stavy 1 , 3 2 , 4 První ionizační energie 463,1 kJ/mol 563,3 kJ/mol Kovový rádius 260 hodin 200 hod Hustota 3 g / cm 3 7 g / cm 3 Bod tání 0–30 ° C (32–86 ° F) 680 ° C (1300 ° F) Bod varu 630 ° C (1200 ° F) 1700 ° C (3100 ° F)
První dva prvky období 8 budou ununenium a unbinilium, prvky 119 a 120. Jejich elektronové konfigurace by měly mít vyplněný orbitál 8s. Tento orbitál je relativisticky stabilizovaný a smrštěný; prvky 119 a 120 by tedy měly být spíše jako rubidium a stroncium než jejich bezprostřední sousedé výše, francium a radium . Dalším účinkem relativistické kontrakce orbitálu 8s je, že atomové poloměry těchto dvou prvků by měly být přibližně stejné jako u francia a radia. Měly by se chovají jako normální alkalických a kovů alkalických zemin (i když méně reaktivní než jejich bezprostřední vertikální sousedy), které běžně tvoří +1 a +2 oxidační stavy v tomto pořadí, ale relativistická destabilizaci 7P 3/2 subshell a relativně nízké ionizační energie z elektrony 7p 3/2 by také měly umožňovat vyšší oxidační stavy jako +3 a +4 (v uvedeném pořadí).
Superaktinidy
Lze uvažovat, že superaktinidy se pohybují od prvků 121 až 157, které lze klasifikovat jako prvky 5g a 6f osmé periody, společně s prvním prvkem 7d. V sérii superaktinidů by se všechny skořápky 7d 3/2 , 8p 1/2 , 6f 5/2 a 5g 7/2 měly plnit současně. To vytváří velmi komplikované situace natolik, že úplné a přesné výpočty CCSD byly provedeny pouze pro prvky 121 a 122. První superaktinid, unbiunium (prvek 121), by měl být podobný lanthanu a aktiniu : jeho hlavní oxidační stav by měl být + 3, přestože blízkost energetických hladin valenčních subshellů může umožnit vyšší oxidační stavy, stejně jako v prvcích 119 a 120. Relativistická stabilizace 8sh subshell by měla mít za následek elementární stav 8s 2 8p 1 valenční elektronová konfigurace pro element 121, na rozdíl od ds 2 konfigurace lanthanu a aktinia; nicméně se zdá, že tato anomální konfigurace neovlivňuje její vypočítanou chemii, která zůstává podobná jako u aktinia. Předpokládá se, že jeho první ionizační energie bude 429,4 kJ/mol, což by bylo nižší než u všech známých prvků kromě alkalických kovů draslíku , rubidia , cesia a francia : tato hodnota je ještě nižší než u alkalického kovu období 8 ununenium (463,1 kJ/mol). Podobně další superaktinid, nebibium (prvek 122), může být podobný ceru a thoriu , s hlavním oxidačním stavem +4, ale měl by základní stav 7d 1 8s 2 8p 1 nebo 8s 2 8p 2 valenční elektronová konfigurace , na rozdíl od konfigurace thoria 6d 2 7s 2 . Proto by jeho první ionizační energie byla menší než toriová (Th: 6,3 eV ; Ubb: 5,6 eV), protože bylo snadnější ionizovat 8p 1/2 elektronu nebibia než 6d elektronu thoria. Kolaps samotného orbitálu 5g je zpožděn až kolem prvku 125; očekává se, že konfigurace elektronů izoelektronické řady 119 elektronů bude [Og] 8s 1 pro prvky 119 až 122, [Og] 6f 1 pro prvky 123 a 124 a [Og] 5 g 1 pro prvek 125 dále.
V prvních několika superaktinidech se předpokládá, že vazebné energie přidaných elektronů jsou dostatečně malé, aby mohly ztratit všechny své valenční elektrony; například unbihexium (prvek 126) by mohlo snadno vytvořit oxidační stav +8 a pro několik dalších prvků mohou být možné ještě vyšší oxidační stavy. Unbihexium se také předpokládá, že vykazují řadu dalších oxidačních stavech : poslední výpočty naznačují, stabilní fluorid UbhF možné, vyplývající z vzájemného spojování mezi 5g orbitální na unbihexium a 2 p orbitální na fluor . Mezi další predikované oxidační stavy patří +2, +4 a +6; Očekává se, že +4 bude nejběžnějším oxidačním stavem nebihexia. Předpokládá se, že superaktinidy od unbipentia (prvek 125) po unbienium (prvek 129) budou vykazovat oxidační stav +6 a budou tvořit hexafluoridy , i když se předpokládá , že UbpF 6 a UbhF 6 budou relativně slabě vázány. Tyto vazby Disociační energie se očekává, že se výrazně zvýší na prvku 127 a ještě více na prvku 129. To naznačuje posun od silného iontový charakter v fluoridy prvku 125 na více kovalentní charakter, se zapojením 8p orbitalu, ve fluoridy prvku 129. vazba v těchto superaktinidových hexafluoridech je většinou mezi nejvyšší 8p subshell superactinide a 2p subshell fluoru, na rozdíl od toho, jak uran používá své 5f a 6d orbitaly pro vazbu v hexafluoridu uranu .
Navzdory schopnosti raných superaktinidů dosáhnout vysokých oxidačních stavů bylo vypočteno, že 5 g elektronů bude nejobtížněji ionizovatelné; Očekává se, že ionty Ubp 6+ a Ubh 7+ budou mít konfiguraci 5 g 1 , podobnou konfiguraci 5f 1 iontu Np 6+ . Podobné chování je pozorováno při nízké chemické aktivitě 4f elektronů v lanthanoidech ; to je důsledek toho, že 5g orbitaly jsou malé a hluboko zakopané v elektronovém oblaku. Přítomnost elektronů v g-orbitálech, které neexistují v základní konfiguraci elektronů žádného aktuálně známého prvku, by měla umožnit v současné době neznámým hybridním orbitálům vytvářet a ovlivňovat chemii superaktinidů novými způsoby, ačkoli absence elektronů g ve známých prvcích ztěžuje předpovídání chemie superaktinidů.
Některé predikované sloučeniny superaktinidů (X = halogen ) 121 122 123 124 125 126 127 128 129 132 142 143 144 145 146 148 153 154 155 156 157 Sloučenina UbuX 3 UbbX 4 UbtX 5 UbqX 6 UbpF
UbpF 6
UbpO2+
2UbhF
UbhF 6
UbhO 4UbsF 6 UboF 6 UbeF
UbeF 6UqbX 4
UqbX 6UqtF 6 UqqX 6
UqqO2+
2
UqqF 8
UqqO 4UqpF 6 UqoO 6 Analogy La X 3
Účet X 3Ce X 4
Th X 4Np O2+
2ThF 4 UF 6
UO2+
2
Pu F 8
PuO 4UO 6 Oxidační stavy 3 4 5 6 1, 6, 7 1, 2, 4, 6, 8 6 6 1, 6 6 4, 6 6, 8 3, 4, 5, 6, 8 6 8 12 3 0, 2 3, 5 2 3
V pozdějších superaktinidech by měly být oxidační stavy nižší. U prvku 132 bude převládající nejstabilnější oxidační stav pouze +6; toto je dále sníženo na +3 a +4 pomocí prvku 144 a na konci superaktinidové řady to bude jen +2 (a možná dokonce 0), protože 6f shell, který se v tomto bodě plní, je hluboko uvnitř elektronový mrak a elektrony 8s a 8p 1/2 jsou vázány příliš silně na to, aby byly chemicky aktivní. 5g skořepina by měla být vyplněna v prvku 144 a 6f skořápka kolem prvku 154 a v této oblasti superaktinidů jsou elektrony 8p 1/2 vázány tak silně, že již nejsou chemicky aktivní, takže může pouze několik elektronů účastnit se chemických reakcí. Výpočty Fricke et al. předpovídat, že v prvku 154 je obal 6f plný a mimo chemicky neaktivní 8s a 8p 1/2 skořepiny neexistují žádné funkce d- nebo jiných elektronových vln . To může způsobit, že prvek 154 bude poněkud nereaktivní s vlastnostmi podobnými vzácnému plynu . Výpočty Pyykkö nicméně očekávají, že v prvku 155 je 6f shell stále chemicky ionizovatelný: Upp 3+ by měl mít plný 6f shell a čtvrtý ionizační potenciál by měl být mezi terbiem a dysprosiem , oba jsou známy v + 4 stav.
Podobně jako u lanthanidových a aktinidových kontrakcí by mělo dojít k superaktinidové kontrakci v sérii superaktinidů, kde jsou iontové poloměry superaktinidů menší, než se očekávalo. V lanthanoidech je kontrakce asi 4,4 pm na prvek; u aktinidů je to asi 15 hodin na prvek. Kontrakce je u lanthanoidů větší než u aktinidů v důsledku větší lokalizace 4f vlnové funkce ve srovnání s 5f vlnovou funkcí. Srovnání s vlnovými funkcemi vnějších elektronů lanthanoidů, aktinidů a superaktinidů vede k predikci kontrakce asi 2 pm na prvek v superaktinidech; přestože je to menší než kontrakce v lanthanoidech a aktinidech, jeho celkový účinek je větší díky skutečnosti, že 32 elektronů je naplněno hluboce zakopanými 5g a 6f skořápkami, místo aby bylo vyplněno pouze 14 elektronů ve skořápkách 4f a 5f v lanthanoidy a aktinidy.
Pekka Pyykkö rozděluje tyto superaktinidy do tří řad: řada 5g (prvky 121 až 138), řada 8p 1/2 (prvky 139 až 140) a řada 6f (prvky 141 až 155), přičemž rovněž uvádí, že by existovaly velké překrývání mezi energetickými hladinami a to, že orbitaly 6f, 7d nebo 8p 1/2 by mohly být také obsazeny v raných atomech nebo iontech superaktinidů. Očekává také, že by se chovaly spíše jako „super lanthanoidy “, v tom smyslu, že 5 g elektrony by byly většinou chemicky neaktivní, podobně jako v chemických sloučeninách je vždy ionizován pouze jeden nebo dva 4f elektrony v každém lanthanidu. Také předpověděl, že možné oxidační stavy superaktinidů mohou v sérii 6f stoupnout velmi vysoko na hodnoty, jako je +12 v prvku 148.
Andrey Kulsha nazval šestatřicet prvků 121 až 156 prvky „ultranzice“ a navrhl je rozdělit na dvě řady po osmnácti, jednu z prvků 121 až 138 a druhou z prvků 139 až 156. První by byla analogická lanthanoidy, s oxidačními stavy převážně v rozmezí od +4 do +6, protože dominuje plnění 5g skořápky a sousední prvky jsou si navzájem velmi podobné, což vytváří analogii s uranem , neptuniem a plutoniem . Druhý by byl analogický k aktinidům: na začátku (kolem prvků ve 140. letech) by se očekávaly velmi vysoké oxidační stavy, protože skořepina 6f stoupá nad 7d, ale poté by se typické oxidační stavy snížily a v prvcích v Po 150 s přestanou být 8p 1/2 elektrony chemicky aktivní. Protože jsou tyto dvě řady odděleny přidáním úplného 5sh 18 subshell, mohly by být také považovány za analogie navzájem.
Očekává se, že jako příklad pozdních superaktinidů bude prvek 156 vykazovat hlavně oxidační stav +2, a to kvůli jeho konfiguraci elektronů se snadno odstranitelnými 7d 2 elektrony přes stabilní [Og] 5g 18 6f 14 8s 2 8p2
1/2jádro. Lze tedy považovat za těžší kongener nobelium , který má rovněž dvojici snadno vyjmout 7s 2 elektrony přes stabilní [n] 5f 14 jádra, a je obvykle v +2 stavu (silná oxidační činidla jsou potřebné pro získání nobelium v +3 stav). Jeho první ionizační energie by měla být asi 400 kJ/mol a jeho kovový poloměr přibližně 170 pikometrů. S relativní atomovou hmotností kolem 445 u by to měl být velmi těžký kov s hustotou kolem 26 g/cm 3 .
Prvky 157 až 166
Očekává se, že 7d přechodnými kovy v období 8 budou prvky 157 až 166. Ačkoli jsou elektrony 8s a 8p 1/2 v těchto prvcích vázány tak silně, že by se neměly moci účastnit žádných chemických reakcí, 9s a 9p Očekává se, že 1/2 úrovně budou snadno dostupné pro hybridizaci. Tyto 7d prvky by měly být podobné prvkům 4d yttria přes kadmium . Zejména prvek 164 s elektronovou konfigurací 7d 10 9s 0 ukazuje jasné analogie s palladiem s jeho elektronovou konfigurací 4d 10 5s 0 .
Vzácné kovy této řady přechodových kovů se neočekává, že by jako ušlechtilý jako jejich lehčí homology, vzhledem k absenci vnějšího s pláštěm pro stínění a také proto, že 7d plášť je silně rozdělena do dvou subshells důsledku relativistické efekty. To způsobí, že první ionizační energie 7d přechodových kovů budou menší než energie jejich lehčích kongenerů.
Teoretický zájem o chemii unhexquadium je do značné míry motivován teoretickými předpověďmi, že by zejména izotopy 472 Uhq a 482 Uhq (se 164 protony a 308 nebo 318 neutrony ) byly ve středu hypotetického druhého ostrova stability (první se soustředí na copernicium , zejména na izotopy 291 Cn, 293 Cn a 296 Cn, u nichž se očekává poločas staletí nebo tisíciletí).
Výpočty předpovídají, že 7d elektrony prvku 164 (unhexquadium) by se měly velmi snadno účastnit chemických reakcí, takže unhexquadium by měl být schopen kromě normálního stavu +2 ve vodných roztocích se silnými ligandy vykazovat i stabilní +6 a +4 oxidační stavy . Unhexquadium by tedy měl být schopen vytvářet sloučeniny jako Uhq ( CO ) 4 , Uhq ( PF 3 ) 4 (oba čtyřstěnné jako odpovídající sloučeniny palladia) a Uhq ( CN )2-
2( lineární ), což je velmi odlišné chování od olova , které by nehexquadium bylo těžším homologem, nebýt relativistických efektů. Nicméně dvojmocný stav by byl hlavním stavem ve vodném roztoku (ačkoli stavy +4 a +6 by byly možné u silnějších ligandů) a unhexquadium (II) by se měl k olovu chovat podobněji než nehexquadium (IV) a unhexquadium (VI ).
Očekává se, že unhexquadium bude měkká Lewisova kyselina a bude mít parametr měkkosti Ahrlands blízký 4 eV . Unhexquadium by měl být maximálně mírně reaktivní, s první ionizační energií, která by měla být kolem 685 kJ/mol, srovnatelná s molybdenem . Vzhledem ke kontrakcím lanthanidu, aktinidu a superaktinidu by unhexquadium měl mít kovový poloměr pouze 158 pm , velmi blízký poloměru mnohem lehčího hořčíku , a to navzdory jeho očekávané atomové hmotnosti kolem 474 u, což je asi 19,5násobek atomové hmotnosti hořčík. Tento malý poloměr a vysoká hmotnost způsobují, že lze očekávat extrémně vysokou hustotu kolem 46 g · cm −3 , což je více než dvojnásobek osmiia , v současnosti nejhustšího známého prvku, při 22,61 g · cm −3 ; unhexquadium by měl být druhým nejhustším prvkem v prvních 172 prvcích v periodické tabulce, přičemž hustší bude pouze jeho sousední nehextrium (prvek 163) (při 47 g · cm −3 ). Kovový nehexquadium by měl mít díky svým kovalentním vazbám velmi velkou soudržnou energii ( entalpii krystalizace) , což pravděpodobně povede k vysoké teplotě tání. V kovovém stavu by měl být nehexquadium docela ušlechtilý a analogický s palladiem a platinou . Fricke a kol. navrhl určité formální podobnosti s oganessonem , protože oba prvky mají konfigurace uzavřeného pláště a podobné ionizační energie, i když poznamenávají, že zatímco oganesson by byl velmi špatným vzácným plynem, unhexquadium by byl dobrým ušlechtilým kovem.
Prvky 165 (unhexpentium) a 166 (unhexhexium), poslední dvě 7d kovy, by se chovají podobně jako alkalických a kovů alkalických zemin , když v oxidačních stavech +1 a +2, resp. 9s elektrony by měly mít ionizační energie srovnatelné s 3s elektrony sodíku a hořčíku , vzhledem k relativistickým efektům způsobujícím, že 9s elektrony budou mnohem silněji vázány, než by předpovídaly nerelativistické výpočty. Prvky 165 a 166 by normálně měly vykazovat oxidační stavy +1 a +2, i když ionizační energie elektronů 7d jsou dostatečně nízké, aby umožňovaly vyšší oxidační stavy, jako je +3 pro prvek 165. Oxidační stav +4 pro prvek 166 je menší pravděpodobně vytvoří situaci podobnou lehčím prvkům ve skupinách 11 a 12 (zejména zlato a rtuť ). Očekává se, že stejně jako u rtuti, ale nikoli copernicium, ionizace prvku 166 na Uhh 2+ povede ke konfiguraci 7d 10, která odpovídá ztrátě s-elektronů, ale nikoli d-elektronů, čímž bude analogičtější s lehčím „méně relativistickým“ „Prvky skupiny 12 zinek, kadmium a rtuť, které v podstatě nemají přechodný kovový charakter.
Některé predikované vlastnosti prvků 156–166
Kovové poloměry a hustoty jsou první aproximace.
Nejdříve je uvedena nejpodobnější skupina a poté další podobné skupiny.Vlastnictví 156 157 158 159 160 161 162 163 164 165 166 Standardní atomová hmotnost [445] [448] [452] [456] [459] [463] [466] [470] [474] [477] [481] Skupina Skupina Yb
(4)3
(5)4
(6)5
(7)6
(8)7
(9)8
(10)9
(11)10
(12, 14, 18)11
(1, 13)12
(2, 14)Valence elektronová konfigurace 7d 2 7d 3 7d 4 7d 5 7d 6 7d 7 7d 8 7d 9 7d 10 7d 10 9s 1 7d 10 9s 2 Stabilní oxidační stavy 2 3 4 1 , 5 2 , 6 3 , 7 4 , 8 5 0 , 2 , 4 , 6 1 , 3 2 První ionizační energie 400 kJ/mol 450 kJ/mol 520 kJ/mol 340 kJ/mol 420 kJ/mol 470 kJ/mol 560 kJ/mol 620 kJ/mol 690 kJ/mol 520 kJ/mol 630 kJ/mol Kovový rádius 170 hod 163 hod 157 hodin 152 hodin 148 hod 148 hod 149 hodin 152 hodin 158 hodin 250 hod 200 hod Hustota 26 g / cm 3 28 g / cm 3 30 g / cm 3 33 g / cm 3 36 g / cm 3 40 g / cm 3 45 g / cm 3 47 g / cm 3 46 g / cm 3 7 g / cm 3 11 g / cm 3
Prvky 167 až 172
Očekává se, že následujících šest prvků v periodické tabulce bude posledními prvky hlavní skupiny v jejich období a pravděpodobně budou podobné prvkům 5p indium až xenon . V prvcích 167 až 172 budou vyplněny skořepiny 9p 1/2 a 8p 3/2 . Jejich energetická vlastní čísla jsou tak blízko u sebe, že se chovají jako jeden kombinovaný p-subshell, podobný nerelativistickým 2p a 3p subshellům. To znamená, že inertní dvojice efektu nedochází a nejčastější oxidační stavy prvků 167 až 170 se očekává, že se 3, 4, 5, a 6, resp. Očekává se, že prvek 171 (unseptunium) bude vykazovat určité podobnosti s halogeny a bude vykazovat různé oxidační stavy v rozmezí od -1 do +7, i když se očekává, že jeho fyzikální vlastnosti budou blíže kovovým. Očekává se, že jeho elektronová afinita bude 3,0 eV , což mu umožní vytvořit HUsu, analogický s halogenovodíkem . Usu - ion by měl být s měkkou základnu , srovnatelnou s jodid (I - ). Očekává se, že prvek 172 (unseptbium) bude vzácný plyn s chemickým chováním podobným chování xenonu, protože jejich ionizační energie by měly být velmi podobné (Xe, 1170,4 kJ/mol; Usb, 1090 kJ/mol). Jediným hlavním rozdílem mezi nimi je to, že u prvku 172 se na rozdíl od xenonu očekává, že bude kapalinou nebo pevnou látkou při standardní teplotě a tlaku díky mnohem vyšší atomové hmotnosti. Očekává se, že unseptbium bude silná Lewisova kyselina , tvořící fluoridy a oxidy, podobně jako jeho lehčí kongenerový xenon. Kvůli analogii prvků 165–172 k obdobím 2 a 3 Fricke a kol. považoval je za vytvoření deváté periody periodické tabulky, zatímco osmou dobu považovali za konec u prvku z ušlechtilého kovu 164. Toto deváté období by bylo podobné druhému a třetímu období, protože se očekává, že nebude mít žádný přechod kovy.
Některé predikované vlastnosti prvků 167–172
Kovové nebo kovalentní poloměry a hustoty jsou první aproximace.Vlastnictví 167 168 169 170 171 172 Standardní atomová hmotnost [485] [489] [493] [496] [500] [504] Skupina 13 14 15 16 17 18 Valence elektronová konfigurace 9s 2 9p 1 9s 2 9p 2 9s 2 9p 2 8p 1 9s 2 9p 2 8p 2 9s 2 9p 2 8p 3 9s 2 9p 2 8p 4 Stabilní oxidační stavy 3 4 5 6 −1 , 3 , 7 0 , 4 , 6 , 8 První ionizační energie 620 kJ/mol 720 kJ/mol 800 kJ/mol 890 kJ/mol 984 kJ/mol 1090 kJ/mol Kovový nebo kovalentní poloměr 190 hodin 180 hod 175 hod 170 hod 165 hodin 220 hodin Hustota 17 g / cm 3 19 g / cm 3 18 g / cm 3 17 g / cm 3 16 g / cm 3 9 g / cm 3
Za prvkem 172
Očekává se, že prvek 172, prvek poslední periody 8, bude prvním vzácným plynem po oganessonu (prvek poslední periody 7). Kromě toho by měla začít další řada dlouhých přechodů, jako jsou superaktinidy, vyplňující alespoň 6g, 7f a 8d skořápky (s 10s, 10p 1/2 a 6h 11/2 příliš vysokou energií, aby mohly přispět na začátku série). Tyto elektrony by byly velmi volně vázány, což by potenciálně způsobilo dosažení extrémně vysokých oxidačních stavů, ačkoli se elektrony stanou pevnějšími vazbami, když iontový náboj stoupá.
V prvku 173 (unsepttrium) by nejvzdálenější elektron vstoupil do subshell 6g 7/2 . Protože interakce na oběžné dráze by vytvořily velmi velkou energetickou mezeru mezi subplášti 8p 3/2 a 6g 7/2 , očekává se, že tento nejvzdálenější elektron bude velmi volně vázán a velmi snadno ztracen za vzniku kationtu Ust + . V důsledku toho se očekává, že se prvek 173 bude chovat chemicky jako alkalický kov a bude mnohem reaktivnější než dokonce cesium (francium a prvek 119 jsou díky relativistickým efektům méně reaktivní než cesium).
Element 184 (unoctquadium) byl významně zaměřen v raných predikcích, protože se původně spekulovalo, že 184 bude protonové magické číslo: předpovídá se, že bude mít elektronovou konfiguraci [Usb] 6g 5 7f 4 8d 3 , přičemž alespoň 7f a 8d elektrony chemicky aktivní. Očekává se, že jeho chemické chování bude podobné uranu a neptuniu , protože další ionizace kolem stavu +6 (což odpovídá odstranění 6g elektronů) bude pravděpodobně nerentabilní; stav +4 by měl být nejběžnější ve vodném roztoku, s +5 a +6 dosažitelnými v pevných sloučeninách.
Konec periodické tabulky
Počet fyzicky možných prvků není znám. Nízký odhad je, že periodická tabulka může skončit brzy po ostrůvku stability , u kterého se očekává, že se bude soustředit na Z = 126, protože rozšíření periodických a nuklidových tabulek je omezeno protonovými a neutronovými odkapávacími liniemi a stabilitou vůči alfa rozpad a spontánní štěpení. Jeden výpočet Y. Gambhir et al. „Analýza jaderné vazebné energie a stability v různých rozpadových kanálech navrhuje omezení existence vázaných jader na Z = 146. Někteří, například Walter Greiner , předpovídali, že periodické tabulce nemusí být konec. Mezi další předpovědi konce periodické tabulky patří Z = 128 ( John Emsley ) a Z = 155 (Albert Khazan).
Prvky nad atomovým číslem 137
Mezi fyziky je „lidovou legendou“, že Richard Feynman navrhl, že neutrální atomy nemohou existovat pro atomová čísla větší než Z = 137, na základě toho, že relativistická Diracova rovnice předpovídá, že energie základního stavu nejvnitřnějšího elektronu v takovém atom by byl imaginární číslo . Zde číslo 137 vzniká jako převrácená hodnota konstanty jemné struktury . Tímto argumentem nemohou neutrální atomy existovat mimo untriseptium, a proto se v tomto bodě rozpadá periodická tabulka prvků založená na elektronových orbitalech. Tento argument však předpokládá, že atomové jádro je bodové. Přesnější výpočet musí vzít v úvahu malou, ale nenulovou velikost jádra, u které se předpokládá posunutí hranice dále na Z ≈ 173.
Bohrův model
Bohrův model vykazuje problém pro atomů s atomovým číslem vyšším než 137, pro rychlost elektronu v několika 1s elektronových orbitální , V , je dána vztahem
kde Z je atomové číslo a α je konstanta jemné struktury , míra síly elektromagnetických interakcí. Podle této aproximace by jakýkoli prvek s atomovým číslem větším než 137 vyžadoval 1 s elektronů, aby se pohybovaly rychleji než c , rychlost světla . Nerelativistický Bohrův model je tedy při použití na takový prvek nepřesný.
Relativistická Diracova rovnice

Relativistická Dirac rovnice dává energie základního stavu jako
kde m je klidová hmotnost elektronu. Pro Z > 137 je vlnová funkce základního stavu Diracova spíše oscilační než vázaná a mezi spektry pozitivní a negativní energie není mezera, jako v Kleinově paradoxu . Přesnější výpočty s přihlédnutím k účinkům konečné velikosti jádra naznačují, že vazebná energie nejprve překročí 2 mc 2 pro Z > Z cr ≈ 173. Pro Z > Z cr , pokud není vyplněn nejvnitřnější orbitál (1 s), elektrické pole jádra vytáhne elektron z vakua , což má za následek spontánní emisi pozitronu . Toto ponoření 1s subshell do negativního kontinua bylo často považováno za „konec“ periodické tabulky, ačkoli podrobnější zpracování naznačuje méně ponurý výsledek.
Atomy s atomovými čísly nad Z cr ≈ 173 byly označeny jako superkritické atomy. Nadkritické atomy nelze zcela ionizovat, protože jejich 1s podskořápka by byla vyplněna spontánním vytvořením páru, ve kterém je z negativního kontinua vytvořen pár elektron-pozitron, přičemž elektron je vázán a pozitron uniká. Silné pole kolem atomového jádra je však omezeno na velmi malou oblast prostoru, takže Pauliho vylučovací princip zakazuje další spontánní vytváření párů, jakmile jsou subshells, které se ponořily do negativního kontinua, naplněny. Prvky 173–184 byly nazvány slabě nadkritickými atomy, protože pro ně se pouze 1s skořápka ponořila do negativního kontinua; Očekává se, že skořepina 2p 1/2 se spojí kolem prvku 185 a skořápky 2s kolem prvku 245. Experimentům se dosud nepodařilo detekovat spontánní tvorbu dvojice od sestavování superkritických nábojů přes srážku těžkých jader (např. srážení olova s uranem na okamžik dát efektivní Z 174; uran s uranem dává efektivní Z = 184 a uran s kaliforniem dává efektivní Z = 190). Jelikož se očekává, že superkritické atomy nepředstavují žádné potíže s jejich elektronickou strukturou, může být konec periodické tabulky určen spíše jadernou nestabilitou než nestabilitou elektronového obalu.
Záleží na kvarku
Rovněž se předpokládalo, že v oblasti za A > 300 může existovat celý „ kontinent stability “ sestávající z hypotetické fáze stabilní kvarkové hmoty , zahrnující volně tekoucí nahoru a dolů kvarky spíše než kvarky vázané na protony a neutrony. Taková forma hmoty je teoreticky považována za základní stav baryonické hmoty s větší vazebnou energií na baryon než jaderná hmota , což upřednostňuje rozpad jaderné hmoty přesahující tento hmotnostní práh na kvarkovou hmotu. Pokud tento stav hmoty existuje, mohl by být syntetizován ve stejných fúzních reakcích vedoucích k normálním supertěžkým jádrům a byl by stabilizován proti štěpení v důsledku jeho silnější vazby, která je dostatečná k překonání Coulombova odpuzování.
Nedávné výpočty naznačují stabilitu nugetů vzhůru dolů kvarkové hmoty (udQM) proti konvenčním jádrům mimo A ~ 266 a také ukazují, že nugety udQM se stanou superkritickými dříve ( Z cr ~ 163, A ~ 609) než konvenční jádra ( Z cr ~ 177, A ~ 480).
Jaderné vlastnosti
Kouzelná čísla a ostrov stability
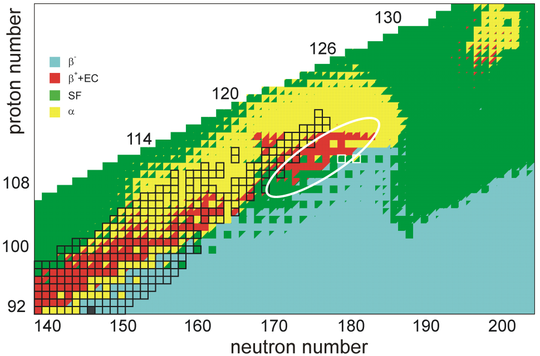
Stabilita jader výrazně klesá s nárůstem atomového čísla za kuriem , prvek 96, takže všechny izotopy s atomovým číslem nad 101 se rozpadají radioaktivně s poločasem pod jeden den, s výjimkou dubia -268. Žádné prvky s atomovými čísly nad 82 (za olovem ) nemají stabilní izotopy. Nicméně z dosud nepříliš dobře pochopených důvodů dochází k mírnému zvýšení jaderné stability kolem atomových čísel 110 - 114 , což vede ke vzniku toho, co je v jaderné fyzice známé jako „ ostrov stability “. Tento koncept, navržený profesorem Kalifornské univerzity Glennem Seaborgem , vysvětluje, proč supertěžké prvky vydrží déle, než se předpokládalo.
Výpočty metodou Hartree – Fock – Bogoliubov pomocí nerelativistické interakce Skyrme navrhly Z = 126 jako uzavřený protonový obal . V této oblasti periodické tabulky byly N = 184, N = 196 a N = 228 navrženy jako uzavřené neutronové obaly. Nejzajímavější izotopy jsou tedy 310 126, 322 126 a 354 126, protože tyto mohou mít podstatně delší životnost než jiné izotopy. Prvek 126, který má magické číslo z protonů , se předpokládá, že stabilnější než jiné prvky v této oblasti, a může mít jaderné izomery s velmi dlouhým poločasem rozpadu . Je také možné, že ostrov stability je místo toho soustředěn na 306 122 , což může být sférické a dvojnásob magické .
Když vezmeme v úvahu jadernou deformaci a relativistické efekty, analýza úrovní jednotlivých částic předpovídá nová magická čísla pro supertěžká jádra na Z = 126, 138, 154 a 164 a N = 228, 308 a 318. Proto kromě ostrov stability soustředěný na 291 Cn, 293 Cn a 298 Fl, další ostrovy stability mohou existovat kolem dvojnásobně magických 354 126 a také 472 164 nebo 482 164. Tato jádra jsou podle předpovědi beta-stabilní a rozpadají se emisí alfa nebo spontánní štěpení s relativně dlouhými poločasy a uděluje dodatečnou stabilitu sousedním N = 228 izotonům a prvkům 152–168. Na druhou stranu stejná analýza naznačuje, že uzávěry protonových obalů mohou být v některých případech, například 354 126, relativně slabé nebo dokonce neexistující , což znamená, že taková jádra nemusí být dvojnásob magická a stabilita bude místo toho primárně určena silnými uzávěry neutronových obalů. Navíc díky enormně větším silám elektromagnetického odpuzování, které musí překonat silná síla na druhém ostrově ( Z = 164), je možné, že jádra kolem této oblasti existují pouze jako rezonance a nemohou zůstat pohromadě po smysluplné množství čas. Je také možné, že některé superaktinidy mezi těmito řadami ve skutečnosti nemusí existovat, protože jsou příliš daleko od obou ostrovů, v takovém případě může periodická tabulka končit kolem Z = 130.
Za prvkem 164 se linie štěpnosti definující hranici stability s ohledem na spontánní štěpení může sbíhat s linií odkapávání neutronů , což představuje limit pro existenci těžších prvků. Přesto byla předpovězena další magická čísla na Z = 210, 274 a 354 a N = 308, 406, 524, 644 a 772, přičemž dvě beta-stabilní dvojnásobná magická jádra byla nalezena na 616 210 a 798 274; stejná metoda výpočtu reprodukovala předpovědi pro 298 Fl a 472 164 (Dvojnásobně magická jádra predikovaná pro Z = 354 jsou beta-nestabilní, přičemž 998 354 je neutronově deficitních a 1126 354 je bohatých na neutrony.) Ačkoli další stabilita vůči alfa rozpad a štěpení jsou předpovídány pro 616 210 a 798 274, s poločasy rozpadu až stovky mikrosekund pro 616 210, nebudou existovat ostrovy stability tak významné jako předpovídané při Z = 114 a 164. Protože existence supertěžkých prvků je velmi silně závislá na stabilizačních účincích uzavřených skořepin, jaderná nestabilita a štěpení pravděpodobně určí konec periodické tabulky za těmito ostrovy stability.
Predikované vlastnosti rozpadu neobjevených prvků
Jelikož se předpokládá, že hlavní ostrov stability leží kolem 291 Cn a 293 Cn, neobjevené prvky za hranicí oganessonu mohou být velmi nestabilní a podléhají alfa rozpadu nebo spontánnímu štěpení v mikrosekundách nebo méně. Přesná oblast, ve které poločasy přesahují jednu mikrosekundu, není známa, ačkoli různé modely naznačují, že izotopy prvků těžších než unbinilium, které mohou vznikat při fúzních reakcích s dostupnými cíli a projektily, budou mít poločasy pod jednu mikrosekundu, a proto nemusí být detekován. Důsledně se předpovídá, že budou existovat oblasti stability při N = 184 a N = 228 a případně také při Z ~ 124 a N ~ 198. Tato jádra mohou mít poločasy několik sekund a podléhají převážně alfa rozpadu a spontánnímu štěpení, i když mohou existovat i menší větve rozpadu beta-plus (nebo zachycování elektronů ). Mimo tyto oblasti se zvýšenou stabilitou se očekává , že štěpné bariéry výrazně poklesnou v důsledku ztráty stabilizačních účinků, což povede k poločasům štěpení pod 10 −18 sekund, zejména v sudých sudých jádrech, u nichž je překážka ještě nižší kvůli párování nukleonů . Obecně se očekává, že poločasy rozpadu alfa se budou zvyšovat s počtem neutronů, od nanosekund v nejvíce izotopech s nedostatkem neutronů po sekundy blíže k linii beta-stability . U jader s pouze několika neutrony více než magickým číslem vazebná energie podstatně klesá, což má za následek přerušení trendu a kratší poločasy rozpadu. Izotopy těchto prvků s největším počtem neutronů mohou být také nevázané a mohou procházet emisí protonů . Klastrový rozpad (emise těžkých částic) byl také navržen jako alternativní způsob rozpadu pro některé izotopy, což představuje další překážku identifikace těchto prvků.
Elektronové konfigurace
Následuje očekávaná elektronová konfigurace prvků 119–173 a 184. Symbol [Og] označuje pravděpodobnou elektronovou konfiguraci oganessonu (Z = 118), což je v současné době poslední známý prvek. Konfigurace prvků v této tabulce jsou zapsány počínaje [Og], protože se očekává, že oganesson bude posledním předchozím prvkem s konfigurací uzavřeného pláště (inertního plynu), 1s 2 2s 2 2p 6 3s 2 3p 6 3d 10 4s 2 4p 6 4d 10 4f 14 5s 2 5p 6 5d 10 5f 14 6s 2 6p 6 6d 10 7s 2 7p 6 .
Kromě prvku 123 nejsou k dispozici žádné úplné výpočty, a proto musí být data v této tabulce považována za předběžná . V případě prvku 123 a možná i těžších prvků se předpokládá, že několik možných elektronových konfigurací bude mít velmi podobné energetické hladiny, takže je velmi obtížné předpovědět základní stav . Zahrnuty jsou všechny navržené konfigurace (protože se chápalo, že pravidlo Madelung zde pravděpodobně přestane fungovat).
Předpokládané přiřazení bloků až 172 je Kulsha, podle očekávaných dostupných valenčních orbitálů. V literatuře však neexistuje shoda v tom, jak by bloky měly po prvku 138 fungovat.
Chemický prvek Blok Předpokládané konfigurace elektronů 119 Uue Ununenium s-blok [Og] 8 s 1 120 Ubn Unbinilium s-blok [Og] 8 s 2 121 Ubu Unbiunium g-blok [Og] 8 s 2 8 s1
1/2122 Ubb Unbibium g-blok [Og] 8 s 2 8 s2
1/2
[Og] 7d 1 8s 2 8p1
1/2123 Ubt Unbitrium g-blok [Og] 6f 1 8s 2 8p2
1/2
[Og] 6f 1 7d 1 8s 2 8p1
1/2
[Og] 6f 2 8s 2 8p1
1/2
[Og] 8 s 2 8 s2
1/2 8 str1
3/2124 Ubq Unbiquadium g-blok [Og] 6f 2 8s 2 8p2
1/2
[Og] 6f 3 8s 2 8p1
1/2125 Ubp Unbipentium g-blok [Og] 6f 4 8s 2 8p1
1/2
[Og] 5g 1 6f 2 8s 2 8p2
1/2
[Og] 5g 1 6f 3 8s 2 8p1
1/2
[Og] 8 s 2 0,81 (5 g 1 6f 2 8 str2
1/2) + 0,17 (5g 1 6f 1 7d 2 8p1
1/2) + 0,02 (6f 3 7d 1 8 s.)1
1/2)126 Ubh Unbihexium g-blok [Og] 5g 1 6f 4 8s 2 8p1
1/2
[Og] 5g 2 6f 2 8s 2 8p2
1/2
[Og] 5g 2 6f 3 8s 2 8p1
1/2
[Og] 8 s 2 0,998 (5 g 2 6f 3 8 str1
1/2) + 0,002 (5 g 2 6f 2 8 str2
1/2)127 Ubs Unbiseptium g-blok [Og] 5g 2 6f 3 8s 2 8p2
1/2
[Og] 5g 3 6f 2 8s 2 8p2
1/2
[Og] 8 s 2 0,88 (5 g 3 6f 2 8 str2
1/2) + 0,12 (5g 3 6f 1 7d 2 8p1
1/2)128 Ubo Unbioctium g-blok [Og] 5g 3 6f 3 8s 2 8p2
1/2
[Og] 5g 4 6f 2 8s 2 8p2
1/2
[Og] 8 s 2 0,88 (5 g 4 6f 2 8 str2
1/2) + 0,12 (5g 4 6f 1 7d 2 8p1
1/2)129 Ube Unbiennium g-blok [Og] 5g 4 6f 3 7d 1 8s 2 8p1
1/2
[Og] 5g 4 6f 3 8s 2 8p2
1/2
[Og] 5g 5 6f 2 8s 2 8p2
1/2
[Og] 5g 4 6f 3 7d 1 8s 2 8p1
1/2130 Utn Untrinilium g-blok [Og] 5g 5 6f 3 7d 1 8s 2 8p1
1/2
[Og] 5g 5 6f 3 8s 2 8p2
1/2
[Og] 5g 6 6f 2 8s 2 8p2
1/2
[Og] 5g 5 6f 3 7d 1 8s 2 8p1
1/2131 Utu Untriunium g-blok [Og] 5g 6 6f 3 8s 2 8p2
1/2
[Og] 5g 7 6f 2 8s 2 8p2
1/2
[Og] 8 s 2 0,86 (5 g 6 6f 3 8 str2
1/2) + 0,14 (5g 6 6f 2 7d 2 8p1
1/2)132 Utb Untribium g-blok [Og] 5g 7 6f 3 8s 2 8p2
1/2
[Og] 5g 8 6f 2 8s 2 8p2
1/2133 Utt Untritrium g-blok [Og] 5g 8 6f 3 8s 2 8p2
1/2134 Utq Untriquadium g-blok [Og] 5g 8 6f 4 8s 2 8p2
1/2135 Utp Untripentium g-blok [Og] 5g 9 6f 4 8s 2 8p2
1/2136 Uth Untrihexium g-blok [Og] 5g 10 6f 4 8s 2 8p2
1/2137 Uts Untriseptium g-blok [Og] 5g 11 6f 4 8s 2 8p2
1/2138 Uto Untrioctium g-blok [Og] 5g 12 6f 4 8s 2 8p2
1/2
[Og] 5g 12 6f 3 7d 1 8s 2 8p2
1/2139 Ute Untrienium g-blok [Og] 5g 13 6f 3 7d 1 8s 2 8p2
1/2
[Og] 5g 13 6f 2 7d 2 8s 2 8p2
1/2140 Uqn Unquadnilium g-blok [Og] 5g 14 6f 3 7d 1 8s 2 8p2
1/2
[Og] 5g 15 6f 1 8s 2 8p2
1/2 8 str2
3/2141 Uqu Unquadunium g-blok [Og] 5g 15 6f 2 7d 2 8s 2 8p2
1/2142 Uqb Unquadbium g-blok [Og] 5g 16 6f 2 7d 2 8s 2 8p2
1/2143 Uqt Unquadtrium f-blok [Og] 5g 17 6f 2 7d 2 8s 2 8p2
1/2144 Uqq Unquadquadium f-blok [Og] 5g 18 6f 2 7d 2 8s 2 8p2
1/2
[Og] 5g 18 6f 1 7d 3 8s 2 8p2
1/2
[Og] 5g 17 6f 2 7d 3 8s 2 8p2
1/2
[Og] 8 s 2 0,95 (5 g 17 6f 2 7d 3 8 str2
1/2) + 0,05 (5g 17 6f 4 7d 1 8p2
1/2)145 Uqp Unquadpentium f-blok [Og] 5g 18 6f 3 7d 2 8s 2 8p2
1/2146 Uqh Unquadhexium f-blok [Og] 5g 18 6f 4 7d 2 8s 2 8p2
1/2147 Uqs Unquadseptium f-blok [Og] 5g 18 6f 5 7d 2 8s 2 8p2
1/2148 Uqo Unquadoctium f-blok [Og] 5g 18 6f 6 7d 2 8s 2 8p2
1/2149 Uqe Unquadennium f-blok [Og] 5g 18 6f 6 7d 3 8s 2 8p2
1/2150 Upn Unpentnilium f-blok [Og] 5g 18 6f 6 7d 4 8s 2 8p2
1/2
[Og] 5g 18 6f 7 7d 3 8s 2 8p2
1/2151 Upu Unpentunium f-blok [Og] 5g 18 6f 8 7d 3 8s 2 8p2
1/2152 Upb Unpentbium f-blok [Og] 5g 18 6f 9 7d 3 8s 2 8p2
1/2153 Upt Unpenttrium f-blok [Og] 5g 18 6f 10 7d 3 8s 2 8p2
1/2
[Og] 5g 18 6f 11 7d 2 8s 2 8p2
1/2154 Upq Unpentquadium f-blok [Og] 5g 18 6f 11 7d 3 8s 2 8p2
1/2
[Og] 5g 18 6f 12 7d 2 8s 2 8p2
1/2155 Upp Unpentpentium f-blok [Og] 5g 18 6f 12 7d 3 8s 2 8p2
1/2
[Og] 5g 18 6f 13 7d 2 8s 2 8p2
1/2156 Uph Unpenthexium f-blok [Og] 5g 18 6f 13 7d 3 8s 2 8p2
1/2
[Og] 5g 18 6f 14 7d 2 8s 2 8p2
1/2157 UPS Unpentseptium d-blok [Og] 5g 18 6f 14 7d 3 8s 2 8p2
1/2158 Upo Unpentoctium d-blok [Og] 5g 18 6f 14 7d 4 8s 2 8p2
1/2159 Upe Unpentenium d-blok [Og] 5g 18 6f 14 7d 5 8s 2 8p2
1/2
[Og] 5g 18 6f 14 7d 4 8s 2 8p2
1/29s 1160 Uhn Unhexnilium d-blok [Og] 5g 18 6f 14 7d 6 8s 2 8p2
1/2
[Og] 5g 18 6f 14 7d 5 8s 2 8p2
1/29s 1161 Uhu Unhexunium d-blok [Og] 5g 18 6f 14 7d 7 8s 2 8p2
1/2
[Og] 5g 18 6f 14 7d 6 8s 2 8p2
1/29s 1162 Uhb Unhexbium d-blok [Og] 5g 18 6f 14 7d 8 8s 2 8p2
1/2
[Og] 5g 18 6f 14 7d 7 8s 2 8p2
1/29s 1163 Uht Nehextrium d-blok [Og] 5g 18 6f 14 7d 9 8s 2 8p2
1/2
[Og] 5g 18 6f 14 7d 8 8s 2 8p2
1/29s 1164 Uhq Nehexquadium d-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2165 Uhp Unhexpentium d-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/29s 1166 Uhh Unhexhexium d-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/29s 2167 Uhs Nehexseptium p-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/29 s 2 9 s1
1/2
[Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str1
3/29s 2168 Uho Unhexoctium p-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/29 s 2 9 s2
1/2
[Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str2
3/29s 2169 Uhe Nehexenium p-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str1
3/29 s 2 9 s2
1/2
[Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str3
3/29s 2170 Usn Unseptnilium p-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str2
3/29 s 2 9 s2
1/2
[Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str4
3/29s 2171 Usu Unseptunium p-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str3
3/29 s 2 9 s2
1/2
[Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str4
3/29 s 2 9 s1
1/2172 USB Unseptbium p-blok [Og] 5g 18 6f 14 7d 10 8s 2 8p2
1/2 8 str4
3/29 s 2 9 s2
1/2173 Ust Neseptrium ? [USB] 6g 1
[USB] 9str1
3/2... ... ... ... ... 184 Uoq Unoctquadium ? [USB] 6g 5 7f 4 8d 3
Viz také
Reference
Další čtení
- Kaldor, U. (2005). „Superheavy Elements - chemie a spektroskopie“. Encyklopedie počítačové chemie . doi : 10,1002/0470845015.cu0044 . ISBN 978-0470845011.
- Seaborg, GT (1968). „Prvky nad 100, současný stav a budoucí vyhlídky“ . Výroční přehled jaderné vědy . 18 : 53–152. Bibcode : 1968ARNPS..18 ... 53S . doi : 10,1146/annurev.ns.18.120168.000413 .
- Scerri, Eric. (2011). Velmi krátký úvod do periodické tabulky, Oxford University Press, Oxford . ISBN 978-0-19-958249-5.
externí odkazy
- Holler, Jim. „Obrázky g-orbitálů“ . University of Kentucky.
- Rihani, Jeries A. „Rozšířená periodická tabulka prvků“ .
- Scerri, Eric. „Web Erica Scerriho pro prvky a periodickou tabulku“ .