Folding@home - Folding@home
 | |
| Původní autoři | Vijay Pande |
|---|---|
| Vývojáři | Pande Laboratory, Sony , Nvidia , ATI Technologies, Joseph Coffland, Cauldron Development |
| První vydání | 1. října 2000 |
| Stabilní uvolnění | 7.6.21 / 23. října 2020
|
| Operační systém | Microsoft Windows , macOS , Linux , PlayStation 3 (ukončeno od verze firmwaru 4.30) |
| Plošina | IA-32 , x86-64 |
| K dispozici v | Angličtina |
| Typ | Distribuované výpočty |
| Licence | Proprietární software |
| webová stránka | skládací dům |
Folding@home ( FAH nebo F@h ) je distribuovaný počítačový projekt, jehož cílem je pomoci vědcům vyvinout novou terapeutiku pro různé choroby pomocí simulace dynamiky bílkovin. To zahrnuje proces skládání bílkovin a pohyby proteinů a je závislé na simulacích spuštěných na osobních počítačích dobrovolníků. Folding@home v současné době sídlí na Washingtonské univerzitě v St. Louis a vede ji Greg Bowman, bývalý student Vijay Pande .
Projekt využívá pro distribuované výpočty a vědecký výzkum grafické procesorové jednotky (GPU), centrální procesorové jednotky (CPU) a procesory ARM podobné těm na Raspberry Pi . Projekt využívá metodologii statistické simulace, která je posunem paradigmatu od tradičních výpočetních metod. Jako součást síťové architektury modelu klient -server každý dobrovolný stroj obdrží části simulace (pracovní jednotky), dokončí je a vrátí je na databázové servery projektu , kde jsou jednotky sestaveny do celkové simulace. Dobrovolníci mohou sledovat své příspěvky na webových stránkách Folding@home, což činí účast dobrovolníků konkurenceschopnou a podporuje dlouhodobé zapojení.
Folding@home je jedním z nejrychlejších výpočetních systémů na světě. Se zvýšeným zájmem o projekt v důsledku pandemie COVID-19 systém dosáhl rychlosti přibližně 1,22 exaflops do konce března 2020 a dosáhl 2,43 exaflops do 12. dubna 2020, což z něj činí první výpočetní systém exaflop na světě . Tato úroveň výkonu jeho rozsáhlé výpočetní sítě umožnila výzkumným pracovníkům spouštět výpočetně nákladné simulace atomové úrovně skládání proteinů tisíckrát déle, než bylo dříve dosaženo. Od svého spuštění 1. října 2000 Pande Lab vyrobila 225 vědeckých výzkumných prací jako přímý výsledek Folding@home. Výsledky simulací projektu dobře souhlasí s experimenty.
Pozadí
Proteiny jsou nezbytnou součástí mnoha biologických funkcí a účastní se prakticky všech procesů v biologických buňkách . Často působí jako enzymy a provádějí biochemické reakce včetně buněčné signalizace , molekulárního transportu a buněčné regulace . Jako strukturální prvky některé proteiny fungují jako typ kostry pro buňky a jako protilátky , zatímco jiné proteiny se účastní imunitního systému . Než může protein převzít tyto role, musí se složit do funkční trojrozměrné struktury , což je proces, který často probíhá spontánně a je závislý na interakcích v rámci své aminokyselinové sekvence a interakcích aminokyselin s jejich okolím. Skládání bílkovin je řízeno hledáním, aby se našla energeticky nejpříznivější konformace proteinu, tj. Jeho nativní stav . Pochopení skládání bílkovin je tedy zásadní pro pochopení toho, co protein dělá a jak funguje, a je považováno za svatý grál výpočetní biologie . Navzdory skládání v přeplněném buněčném prostředí obvykle probíhá hladce. Kvůli chemickým vlastnostem proteinu nebo jiným faktorům se však proteiny mohou špatně skládat , tj. Složit špatnou cestu a skončit deformací. Pokud buněčné mechanismy nemohou zničit nebo znovu složit nesprávně složené proteiny, mohou se následně agregovat a způsobit řadu oslabujících nemocí. Laboratorní experimenty studující tyto procesy mohou mít omezený rozsah a atomové detaily, což vede vědce k používání počítačových modelů založených na fyzice, které se při doplňování experimentů snaží poskytnout úplnější obraz o skládání proteinů, nesprávném skládání a agregaci.
Vzhledem ke složitosti konformačního nebo konfiguračního prostoru proteinů (množina možných tvarů, které může protein nabývat) a omezením výpočetního výkonu byly simulace molekulární dynamiky všech atomů v časových intervalech, které mohou studovat, značně omezeny. Zatímco většina proteinů se obvykle skládá v řádu milisekund, před rokem 2010 mohly simulace dosáhnout pouze časových období nanosekund až mikrosekund. Ke simulaci skládání proteinů byly použity superpočítače obecného určení , ale takové systémy jsou skutečně nákladné a obvykle jsou sdíleny mezi mnoha výzkumnými skupinami. Dále, protože výpočty v kinetických modelech probíhají sériově, silné škálování tradičních molekulárních simulací na tyto architektury je výjimečně obtížné. Navíc, protože skládání bílkovin je stochastický proces (tj. Náhodný) a může se statisticky v průběhu času měnit, je náročné výpočetně používat dlouhé simulace pro komplexní pohled na proces skládání.
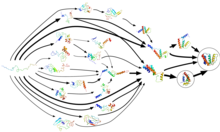
K skládání bílkovin nedochází v jednom kroku. Místo toho, proteiny tráví většinu času skládací, téměř 96% v některých případech, čeká v různých mezilehlých konformačních stavů, z nichž každý lokální termodynamická volná energie minimálně v proteinu energie krajiny . Prostřednictvím procesu známého jako adaptivní vzorkování jsou tyto konformace používány Folding@home jako výchozí body pro sadu trajektorií simulace. Protože simulace objevují více konformací, trajektorie se z nich restartují a z tohoto cyklického procesu se postupně vytváří Markovův stavový model (MSM). MSM jsou diskrétní modely hlavních rovnic, které popisují konformační a energetickou krajinu biomolekuly jako soubor odlišných struktur a krátké přechody mezi nimi. Metoda adaptivního vzorkování Markovova stavového modelu výrazně zvyšuje účinnost simulace, protože se vyhýbá výpočtu uvnitř samotného lokálního energetického minima, a je přístupná distribuovanému výpočtu (včetně GPUGRID ), protože umožňuje statistickou agregaci krátkých, nezávislých simulačních trajektorií. Množství času, které zabere vytvoření Markovova stavového modelu, je nepřímo úměrné počtu spuštěných paralelních simulací, tj. Počtu dostupných procesorů. Jinými slovy, dosahuje lineární paralelizace , což vede ke zhruba čtyř řádů snížením celkové sériové době výpočtu. Dokončená MSM může obsahovat desítky tisíc stavů vzorků z fázového prostoru proteinu (všechny konformace, které může protein nabývat) a přechody mezi nimi. Model ukazuje skládací události a cesty (tj. Trasy) a výzkumníci mohou později použít kinetické shlukování k zobrazení hrubozrnné reprezentace jinak vysoce detailního modelu. Mohou tyto MSM použít k odhalení chybného skládání proteinů a ke kvantitativnímu porovnávání simulací s experimenty.
Mezi lety 2000 a 2010 se délka proteinů, které Folding@home studoval, zvýšila čtyřnásobně, zatímco jeho časové rámce pro simulace skládání proteinů se zvýšily o šest řádů. V roce 2002 společnost Folding@home použila státní modely Markov k dokončení přibližně milionu CPU dní simulací během několika měsíců a v roce 2011 paralyzovaly MSM další simulaci, která vyžadovala souhrnně 10 milionů CPU hodin práce na počítači. V lednu 2010 společnost Folding@home pomocí MSM simulovala dynamiku pomalu se skládajícího 32- zbytkového proteinu NTL9 na 1,52 milisekundy, což je časový harmonogram konzistentní s experimentálními předpověďmi rychlosti skládání, ale tisíckrát delší, než se dříve dosáhlo. Model se skládal z mnoha jednotlivých trajektorií, z nichž každý byl o dva řády kratší, a poskytoval nebývalou úroveň detailů v energetické krajině proteinu. V roce 2010 získal výzkumný pracovník Folding@home Gregory Bowman ocenění Thomas Kuhn Paradigm Shift Award od American Chemical Society za vývoj softwaru MSMBuilder s otevřeným zdrojovým kódem a za dosažení kvantitativní shody mezi teorií a experimentem. Za svou práci získal Pande Cenu Michaela a Kate Bárányových pro mladé vyšetřovatele za rok 2012 za „vývoj výpočetních metod definujících pole a měnící pole za účelem vytvoření předních teoretických modelů pro skládání proteinů a RNA “ a Cenu Irving Sigal Young Investigator 2006 za jeho výsledky simulace, které „stimulovaly opětovné prozkoumání významu měření v souhrnu i v jedné molekule, což Pandeho úsilí propaguje jako hlavní příspěvek k metodice simulace“.
Příklady aplikace v biomedicínském výzkumu
Nesprávné skládání bílkovin může mít za následek řadu onemocnění, včetně Alzheimerovy choroby, rakoviny , Creutzfeldt – Jakobovy choroby , cystické fibrózy , Huntingtonovy choroby, srpkovité anémie a diabetu II . Buněčná infekce viry, jako je HIV a chřipka, také zahrnuje skládání na buněčných membránách . Jakmile je nesprávné skládání bílkovin lépe pochopeno, mohou být vyvinuty terapie, které posilují přirozenou schopnost buněk regulovat skládání bílkovin. Takové terapie zahrnují použití upravených molekul ke změně produkce daného proteinu, pomáhají zničit špatně složený protein nebo pomáhají při skládání. Kombinace výpočetního molekulárního modelování a experimentální analýzy má možnost zásadně utvářet budoucnost molekulární medicíny a racionální návrh terapeutik , jako je urychlování a snižování nákladů na objevování léčiv . Cílem prvních pěti let Folding@home bylo dosáhnout pokroku v porozumění skládání, zatímco současným cílem je porozumět nesprávnému skládání a souvisejícím chorobám, zejména Alzheimerově chorobě.
Simulace spuštěné na Folding@home se používají ve spojení s laboratorními experimenty, ale vědci je mohou použít ke studiu toho, jak se skládání in vitro liší od skládání v nativním buněčném prostředí. To je výhodné při studiu aspektů skládání, chybného skládání a jejich vztahů k chorobám, které je obtížné pozorovat experimentálně. Například v roce 2011 Folding@home simuloval skládání bílkovin uvnitř ribozomálního výstupního tunelu, aby vědcům pomohl lépe porozumět tomu, jak může přirozené uzavření a tlačení ovlivnit proces skládání. Kromě toho vědci obvykle používají chemické denaturanty k rozvinutí proteinů ze stabilního nativního stavu. Není obecně známo, jak denaturant ovlivňuje refolding proteinu, a je obtížné experimentálně určit, zda tyto denaturované stavy obsahují zbytkové struktury, které mohou ovlivnit chování skládání. V roce 2010 Folding@home použil GPU k simulaci rozvinutých stavů proteinu L a předpovídal jeho kolaps v silné shodě s experimentálními výsledky.
Velké datové sady z projektu jsou volně dostupné pro ostatní výzkumné pracovníky k použití na vyžádání a k některým lze přistupovat z webových stránek Folding@home. Laboratoř Pande spolupracovala s dalšími systémy molekulární dynamiky, jako je superpočítač Blue Gene , a sdílejí klíčový software Folding@home s dalšími výzkumníky, takže algoritmy, z nichž má Folding@home prospěch, mohou pomáhat dalším vědeckým oblastem. V roce 2011 vydali open-source software Copernicus, který je založen na MSM Folding@home a dalších paralelních metodách a má za cíl zlepšit účinnost a škálování molekulárních simulací na velkých počítačových klastrech nebo superpočítačích . Souhrny všech vědeckých poznatků z Folding@home jsou po zveřejnění zveřejněny na webových stránkách Folding@home.
Alzheimerova choroba
Alzheimerova choroba je nevyléčitelné neurodegenerativní onemocnění, které nejčastěji postihuje starší lidi a tvoří více než polovinu všech případů demence . Jeho přesná příčina zůstává neznámá, ale toto onemocnění je identifikováno jako onemocnění s nesprávným složením bílkovin . Alzheimerova choroba je spojena s toxickými agregace na amyloid beta (Ap) peptidu , způsobené Ap misfolding a shlukování s jinými Ap peptidů. Tyto agregáty Ap pak rostou do výrazně větších senilních plaků , což je patologický marker Alzheimerovy choroby. Vzhledem k heterogenní povaze těchto agregátů mají experimentální metody, jako je rentgenová krystalografie a nukleární magnetická rezonance (NMR), potíže charakterizovat jejich struktury. Atomové simulace agregace Ap jsou navíc vzhledem ke své velikosti a složitosti výpočetně velmi náročné.
Prevence agregace Ap je slibnou metodou vývoje terapeutických léčiv pro Alzheimerovu chorobu, podle Naeem a Fazili v článku o přehledu literatury . V roce 2008 Folding@home simuloval dynamiku agregace Ap v atomových detailech v časových intervalech řádově desítky sekund. Předchozí studie dokázaly simulovat pouze asi 10 mikrosekund. Folding@home dokázal simulovat skládání Ap o šest řádů déle, než bylo dříve možné. Vědci použili výsledky této studie k identifikaci beta vlásenky, která byla hlavním zdrojem molekulárních interakcí uvnitř struktury. Studie pomohla připravit laboratoř Pande pro budoucí agregační studie a pro další výzkum najít malý peptid, který může stabilizovat agregační proces.
V prosinci 2008 našel Folding@home několik malých kandidátů na léky, které zřejmě inhibovaly toxicitu agregátů Ap. V roce 2010 se v úzké spolupráci s Centrem pro skládací stroje na proteiny začaly tyto přívody léčiv testovat na biologické tkáni . V roce 2011 společnost Folding@home dokončila simulace několika mutací Ap, které zřejmě stabilizují tvorbu agregátů, což by mohlo pomoci při vývoji terapeutických léčebných terapií pro toto onemocnění a výrazně pomoci při experimentálních studiích nukleární magnetické rezonanční spektroskopie Ap oligomerů . Později téhož roku zahájila společnost Folding@home simulace různých fragmentů Ap, aby zjistila, jak různé přírodní enzymy ovlivňují strukturu a skládání Ap.
Huntingtonova nemoc
Huntingtonova choroba je neurodegenerativní genetická porucha, která je spojena s chybným skládáním a agregací proteinů. Nadměrné opakuje z glutaminu aminokyseliny na N-konci o huntingtin proteinu způsobují agregaci, a i když chování repetic není zcela znám, ale vedou k kognitivního úpadku spojeného s onemocněním. Stejně jako u jiných agregátů je obtížné experimentálně určit jeho strukturu. Vědci používají Folding@home ke studiu struktury proteinového agregátu huntingtinu a k předpovědi jeho vzniku , přičemž pomáhají s racionálními metodami navrhování léčiv k zastavení tvorby agregátů. Fragment N17 proteinu huntingtin urychluje tuto agregaci, a přestože bylo navrženo několik mechanismů, jeho přesná role v tomto procesu zůstává do značné míry neznámá. Folding@home simuloval tento a další fragmenty, aby objasnil jejich roli v nemoci. Od roku 2008 se její metody navrhování léčiv pro Alzheimerovu chorobu používají u Huntingtonových.
Rakovina
Více než polovina všech známých rakovin zahrnují mutace z p53 , je nádorový supresor protein přítomen v každé buňce, která reguluje buněčný cyklus a signály buněčné smrti v případě poškození DNA . Specifické mutace v p53 mohou tyto funkce narušit, což umožňuje abnormální buňce pokračovat v nekontrolovaném růstu, což vede ke vzniku nádorů . Analýza těchto mutací pomáhá vysvětlit základní příčiny rakoviny související s p53. V roce 2004 byla společnost Folding@home použita k provedení první studie molekulární dynamiky refoldingu proteinového dimeru p53 při simulaci vody na všech atomech . Výsledky simulace souhlasily s experimentálními pozorováními a poskytly pohledy na přetváření dimeru, které byly dříve nedosažitelné. Jednalo se o první recenzovanou publikaci o rakovině z projektu distribuovaných počítačů. Následující rok Folding@home vytvořil novou metodu pro identifikaci aminokyselin klíčových pro stabilitu daného proteinu, která byla poté použita ke studiu mutací p53. Tato metoda byla poměrně úspěšná při identifikaci mutací podporujících rakovinu a určovala účinky specifických mutací, které by jinak nebylo možné experimentálně změřit.
Folding@home se také používá ke studiu proteinových chaperonů , proteinů tepelného šoku, které hrají zásadní roli v přežití buněk tím, že pomáhají skládat další proteiny v přeplněném a chemicky stresujícím prostředí v buňce. Rychle rostoucí rakovinné buňky se spoléhají na specifické chaperony a některé chaperony hrají klíčovou roli v odolnosti vůči chemoterapii . Inhibice těchto specifických chaperonů jsou považovány za potenciální způsoby účinku účinných chemoterapeutických léků nebo snižování šíření rakoviny. Laboratoř Pande pomocí Folding@home a úzké spolupráce s Centrem pro skládací stroje na bílkoviny doufá, že najde lék, který inhibuje tyto chaperony zapojené do rakovinotvorných buněk. Výzkumníci také používají Folding@home ke studiu dalších molekul souvisejících s rakovinou, jako je enzym Src kináza a některé formy engrailed homeodomény : velký protein, který se může podílet na mnoha chorobách, včetně rakoviny. V roce 2011 zahájila společnost Folding@home simulace dynamiky malého knottinového proteinu EETI, který dokáže identifikovat karcinomy v zobrazovacích skenech vazbou na povrchové receptory rakovinných buněk.
Interleukin 2 (IL-2) je protein, který pomáhá T buňky jednotlivých imunitního systému útoku patogenů a nádory. Jeho použití jako léčby rakoviny je však omezeno kvůli závažným vedlejším účinkům, jako je plicní edém . IL-2 se váže na tyto plicní buňky jinak než na T buňky, takže výzkum IL-2 zahrnuje pochopení rozdílů mezi těmito vazebnými mechanismy. V roce 2012 pomohl Folding@home s objevem mutantní formy IL-2, která je třistokrát účinnější v roli imunitního systému, ale nese méně vedlejších účinků. V experimentech tato změněná forma významně překonala přirozený IL-2 v bránění růstu nádoru. Farmaceutické společnosti projevily zájem o mutantní molekulu a National Institutes of Health ji testuje na celé řadě nádorových modelů, aby se pokusila urychlit její vývoj jako terapeutika.
Osteogenesis imperfecta
Osteogenesis imperfecta , známá jako onemocnění křehkých kostí, je nevyléčitelná genetická kostní porucha, která může být smrtelná. Lidé s touto nemocí nejsou schopni vytvořit funkční pojivovou kostní tkáň. Nejčastěji je to způsobeno mutací kolagenu typu I , který plní řadu strukturních rolí a je nejhojnějším proteinem u savců . Mutace způsobuje deformaci struktury trojité šroubovice kolagenu , která, pokud není přirozeně zničena, vede k abnormální a oslabené kostní tkáni. V roce 2005 Folding@home testoval novou kvantově mechanickou metodu, která se zlepšila po předchozích simulačních metodách a která může být užitečná pro budoucí výpočetní studie kolagenu. Ačkoli vědci použili Folding@home ke studiu skládání a chybného skládání kolagenu, zájem stojí ve srovnání s Alzheimerovým a Huntingtonovým výzkumem jako pilotní projekt .
Viry
Folding@home pomáhá při výzkumu s cílem zabránit některým virům , jako je chřipka a HIV , rozpoznávat biologické buňky a vstupovat do nich . V roce 2011 zahájila společnost Folding@home simulace dynamiky enzymu RNázy H , klíčové složky HIV, s cílem pokusit se navrhnout léky k jeho deaktivaci. Folding@home byl také použit ke studiu membránové fúze , zásadní události pro virovou infekci a široké škály biologických funkcí. Tato fúze zahrnuje konformační změny virových fúzních proteinů a dokování proteinů , ale přesné molekulární mechanismy fúze zůstávají do značné míry neznámé. Fúzní události se mohou skládat z více než půl milionu atomů interagujících po stovky mikrosekund. Tato složitost omezuje typické počítačové simulace na přibližně deset tisíc atomů během desítek nanosekund: rozdíl několika řádů. Vývoj modelů pro předpovídání mechanismů membránové fúze pomůže při vědeckém porozumění tomu, jak zacílit proces pomocí antivirotik. V roce 2006 vědci použili státní modely Markov a síť Folding@home, aby objevili dvě cesty pro fúzi a získali další mechanistické poznatky.
Po podrobných simulacích z Folding@home malých buněk známých jako vezikuly představila v roce 2007 laboratoř Pande novou výpočetní metodu pro měření topologie jejích strukturálních změn během fúze. V roce 2009 vědci použili Folding@home ke studiu mutací chřipkového hemaglutininu , proteinu, který váže virus na svou hostitelskou buňku a pomáhá při vstupu viru. Mutace hemaglutininu ovlivňují, jak dobře se protein váže na molekuly receptoru buněčného povrchu hostitele , což určuje, jak infekční je kmen viru pro hostitelský organismus. Znalost účinků hemaglutininových mutací pomáhá při vývoji antivirotik . Od roku 2012 pokračuje Folding@home v simulaci skládání a interakcí hemaglutininu, což doplňuje experimentální studie na University of Virginia .
V březnu 2020 zahájila společnost Folding@home program na pomoc výzkumným pracovníkům z celého světa, kteří pracují na nalezení léku a dozvědí se více o pandemii koronaviru . Počáteční vlna projektů simuluje potenciálně léčitelné proteinové cíle z viru SARS-CoV-2 a souvisejícího viru SARS-CoV, o nichž je k dispozici podstatně více údajů.
Drogový design
Léky fungují tak, že se navážou na konkrétní místa na cílových molekulách a způsobí nějakou požadovanou změnu, jako je deaktivace cíle nebo způsobení konformační změny . V ideálním případě by lék měl působit velmi specificky a vázat se pouze na svůj cíl, aniž by zasahoval do jiných biologických funkcí. Je však obtížné přesně určit, kde a jak pevně se dvě molekuly budou vázat. Kvůli limitům ve výpočetním výkonu musí metody proudu v silico obvykle měnit rychlost kvůli přesnosti ; např. místo výpočtově nákladných výpočtů volné energie použijte metody rychlého dokování proteinů . Výpočetní výkon Folding@home umožňuje výzkumným pracovníkům použít obě metody a vyhodnotit jejich účinnost a spolehlivost. Počítačem podporovaný návrh léků má potenciál urychlit a snížit náklady na objevování léků. V roce 2010 společnost Folding@home použila MSM a výpočty volné energie k předpovědi nativního stavu villinového proteinu do střední odchylky odmocniny (RMSD) od 1,8 angstromu (A ) od krystalické struktury experimentálně stanoveného pomocí rentgenové krystalografie . Tato přesnost má důsledky pro budoucí metody predikce struktury proteinů , včetně pro vnitřně nestrukturované proteiny . Vědci použili Folding@home k výzkumu odolnosti vůči lékům studiem vankomycinu , antibiotika poslední instance a beta-laktamázy , proteinu, který dokáže rozkládat antibiotika jako penicilin .
Chemická aktivita probíhá podél aktivního místa proteinu . Tradiční metody navrhování léčiv zahrnují pevnou vazbu na toto místo a blokování jeho aktivity za předpokladu, že cílový protein existuje v jedné rigidní struktuře. Tento přístup však funguje přibližně u 15% všech proteinů. Proteiny obsahují alosterická místa, která, když jsou vázána malými molekulami, mohou změnit konformaci proteinu a v konečném důsledku ovlivnit jeho aktivitu. Tyto stránky jsou atraktivní drogové cíle, ale jejich umístění je velmi výpočetně nákladné . V roce 2012, Folding @ home a msms byly použity k identifikaci alosterické míst ve třech lékařsky relevantních proteinů: beta-laktamázy, interleukin-2 , a RNase H .
Přibližně polovina ze všech známých antibiotik zasahovat workings baktérií ribosomu , velké a složité biochemické stroje, který vykonává biosyntéza proteinů podle překlady messenger RNA do proteinů. Makrolidová antibiotika ucpávají výstupní tunel ribozomů, což brání syntéze esenciálních bakteriálních proteinů. V roce 2007 získala laboratoř Pande grant na studium a návrh nových antibiotik. V roce 2008 použili Folding@home ke studiu vnitřku tohoto tunelu a toho, jak jej mohou ovlivnit konkrétní molekuly. Plná struktura ribozomu byla stanovena až od roku 2011 a Folding@home také simuloval ribozomální proteiny , protože mnoho jejich funkcí zůstává do značné míry neznámých.
Potenciální aplikace v biomedicínském výzkumu
Existuje mnoho dalších nemocí podporovaných nesprávným skládáním bílkovin, které mohou být prospěšné z Folding@home, aby buď rozeznaly špatně složenou strukturu bílkovin nebo kinetiku chybného skládání a pomohly v budoucnosti při navrhování léčiv. Často smrtelná prionová onemocnění patří k nejvýznamnějším.
Prionové nemoci
Prion (PrP) je transmembránový buněčný protein našel široce v eukaryotických buňkách . U savců je hojnější v centrálním nervovém systému . Ačkoli jeho funkce není známa, jeho vysoká ochrana mezi druhy naznačuje důležitou roli v buněčné funkci. Konformační změna z normálního prionového proteinu (PrPc, zkratka pro buněčnou) na nemoc způsobující izoformu PrPSc (zkratka pro prototypová prionová choroba - scrapie ) způsobuje řadu nemocí souhrnně známých jako přenosné spongiformní encefalopatie (TSE), včetně hovězí spongiformní encefalopatie ( BSE) u skotu, Creutzfeldt-Jakobova choroba (CJD) a fatální nespavost u člověka, chronické chřadnutí (CWD) v rodině jelenů. Konformační změna je široce přijímána v důsledku nesprávného skládání bílkovin . To, co odlišuje TSE od jiných chorob chybného skládání bílkovin, je jeho přenosná povaha. 'Očkování' infekčního PrPSc, ať už spontánně, dědičně nebo získané expozicí kontaminovaným tkáním, může způsobit řetězovou reakci transformace normálního PrPc na agregáty fibril nebo plaky podobné amyloidu sestávající z PrPSc.
Molekulární struktura PrPSc nebyla plně charakterizována kvůli její agregované povaze. Není známo mnoho o mechanismu nesprávného skládání bílkovin ani o jeho kinetice . S využitím známé struktury PrPc a výsledků níže popsaných studií in vitro a in vivo by Folding@home mohl být cenný při objasňování toho, jak se tvoří PrPSc a jak se infekční protein zařizuje tak, aby vytvářel fibrily a plaky podobné amyloidu, a obcházel tak požadavek k čištění PrPSc nebo rozpuštění agregátů.
PrPc byl enzymaticky disociován z membrány a purifikován, jeho struktura byla studována pomocí technik charakterizujících strukturu, jako je NMR spektroskopie a rentgenová krystalografie . Posttranslační PrPc má 231 aminokyselin (aa) v myších. Molekula se skládá z dlouhé a nestrukturované aminokoncové oblasti zahrnující až aa zbytek 121 a strukturované karboxyterminální domény. Tato kulová doména obsahuje dva krátké archotvorné antiparalelní β-řetězce (aa 128 až 130 a aa 160 až 162 v myším PrPc) a tři α-helixy (šroubovice I: aa 143 až 153; šroubovice II: aa 171 až 192 ; helix III: aa 199 až 226 v myších PrPc), Helices II a III jsou orientovány antiparalelně a spojeny krátkou smyčkou. Jejich strukturní stabilitu podporuje disulfidový můstek , který je rovnoběžný s oběma beta-vlákny vytvářejícími list. Tyto a-helixy a β-list tvoří tuhé jádro kulové domény PrPc.
Nemoc způsobující PrPSc je proteinázou K odolná a nerozpustná. Pokusy o jeho čištění z mozku infikovaných zvířat vždy poskytnou heterogenní směsi a agregované stavy, které nelze charakterizovat NMR spektroskopií nebo rentgenovou krystalografií. Existuje však obecná shoda v tom, že PrPSc obsahuje vysoké procento pevně naskládaných β-listů než normální PrPc, což činí protein nerozpustným a odolným vůči proteináze. Pomocí technik kryoelektronové mikroskopie a strukturního modelování založeného na podobných společných proteinových strukturách bylo zjištěno, že PrPSc obsahuje ß-listy v oblasti aa 81–95 až aa 171, zatímco karboxylová koncová struktura je údajně zachována a zachovává disulfidový spojená α-helikální konformace v normálním PrPc. Tyto ß-listy tvoří paralelní levotočivou beta-šroubovici. Předpokládá se, že tři molekuly PrPSc tvoří primární jednotku, a proto vytvářejí základ pro takzvané fibrily spojené se scrapie. Katalytická aktivita závisí na velikosti částice. Částice PrPSc, které se skládají pouze z 14-28 molekul PrPc, vykazují nejvyšší míru infekčnosti a konverze.
Navzdory obtížnosti čištění a charakterizování PrPSc, ze známé molekulární struktury PrPc a za použití transgenních myší a delece N-konce, bylo možné odvodit potenciální „horká místa“ chybného skládání proteinů vedoucí k patogennímu PrPSc a Folding@home má velkou cenu tyto potvrdit. Studie zjistily, že jak primární, tak sekundární struktura prionového proteinu může být významná pro konverzi.
Existuje více než dvacet mutací genu prionového proteinu ( PRNP ), o nichž je známo, že jsou asociovány s dědičnou formou lidských TSE nebo jsou přímo spojeny s dědičnou formou lidských TSE [56], což indikuje jednotlivé aminokyseliny v určité poloze, pravděpodobně v karboxylové doméně , z PrPc může ovlivnit citlivost na TSE.
Posttranslační aminokoncová oblast PrPc se skládá ze zbytků 23-120, které tvoří téměř polovinu aminokyselinové sekvence vyzrálého PrPc v plné délce. V amino -koncové oblasti jsou dvě sekce, které mohou ovlivnit konverzi. Za prvé, zbytky 52-90 obsahují oblast opakování oktapeptidu (5krát), která pravděpodobně ovlivňuje počáteční vazbu (prostřednictvím oktapeptidových opakování) a také skutečnou konverzi prostřednictvím druhé sekce aa 108–124. Vysoce hydrofobní AGAAAAGA se nachází mezi zbytkem 113 a 120 a je popsáno jako domnělé agregační místo, ačkoli tato sekvence vyžaduje, aby její lemující části vytvářely fibrilární agregáty.
V karboxy globulární doméně, mezi třemi šroubovicemi, studie ukazují, že šroubovice II má významně vyšší sklon ke konformaci beta-řetězce. Vzhledem k vysoké konformační pružnosti viditelné mezi zbytky 114-125 (část nestrukturovaného řetězce N-konce) a vysokému sklonu β-vlákna helixu II mohou k vyvolání chybného skládání PrPc stačit pouze mírné změny podmínek prostředí nebo interakce a následná tvorba vláken.
Jiné studie NMR struktur PrPc ukázaly, že tyto zbytky (~ 108–189) obsahují většinu skládané domény včetně obou beta řetězců, prvních dvou α-šroubovic a oblastí smyčky/otočky, které je spojují, ale ne šroubovice III . Malé změny ve strukturách smyčky/odbočky samotného PrPc by mohly být důležité i při převodu. V jiné studii Riek et al. ukázal, že dvě malé oblasti P-řetězce proti směru od oblastí smyčky působí jako nukleační místo pro konformační konverzi smyčky/otočení a a-šroubovicových struktur v PrPc na β-list.
Energetický práh pro konverzi nemusí být nutně vysoký. Stabilita skládání, tj. Volná energie globulárního proteinu v jeho prostředí je v rozmezí jedné nebo dvou vodíkových vazeb, tedy umožňuje přechod na izoformu bez požadavku vysoké přechodové energie.
Z příslušných interakcí mezi molekulami PrPc hrají hydrofobní interakce zásadní roli při tvorbě P-listů, což je charakteristický znak PrPSc, protože listy přinášejí fragmenty polypeptidových řetězců do těsné blízkosti. Kutznetsov a Rackovsky skutečně ukázali, že mutace podporující onemocnění v lidském PrPc měly statisticky významnou tendenci ke zvyšování lokální hydrofobicity.
Experimenty in vitro ukázaly, že kinetika chybného skládání má počáteční zpožďovací fázi, po níž následuje fáze rychlého růstu tvorby vláken. Je pravděpodobné, že PrPc prochází některými přechodnými stavy, jako je alespoň částečně rozvinutý nebo degradovaný, než nakonec skončí jako součást amyloidního vlákna.
Vzory účasti
Stejně jako ostatní projekty distribuované výpočetní techniky je Folding@home online projekt občanské vědy . V těchto projektech přispívají nespecialisté na výpočetní výkon počítače nebo pomáhají analyzovat data vytvořená profesionálními vědci. Účastníci dostávají malou nebo žádnou zjevnou odměnu.
Byl proveden výzkum motivací občanských vědců a většina těchto studií zjistila, že účastníci jsou motivováni k účasti z altruistických důvodů; to znamená, že chtějí pomoci vědcům a přispět k pokroku jejich výzkumu. Mnoho účastníků občanské vědy má základní zájem o téma výzkumu a tíhne k projektům, které jsou v oborech, které je zajímají. Folding@home se v tomto ohledu neliší. Výzkum, který byl nedávno proveden na více než 400 aktivních účastnících, odhalil, že chtějí přispět k výzkumu a že mnozí měli přátele nebo příbuzné postižené chorobami, které vědci Folding@home zkoumají.
Folding@home láká účastníky, kteří jsou nadšenci počítačového hardwaru. Tyto skupiny přinášejí do projektu značné odborné znalosti a jsou schopné stavět počítače s pokročilým výpočetním výkonem. Jiné projekty distribuované výpočetní techniky přitahují tyto typy účastníků a projekty se často používají ke srovnávání výkonu upravených počítačů a tento aspekt záliby je přizpůsoben konkurenční povaze projektu. Jednotlivci a týmy mohou soutěžit o to, kdo dokáže zpracovat nejvíce počítačových procesorových jednotek (CPU).
Tento nejnovější výzkum Folding@home zahrnující rozhovory a etnografické pozorování online skupin ukázal, že týmy hardwarových nadšenců mohou někdy spolupracovat a sdílet osvědčené postupy s ohledem na maximalizaci výstupu zpracování. Takové týmy se mohou stát komunitami praxe , se sdíleným jazykem a online kulturou. Tento model účasti byl pozorován v jiných projektech distribuované výpočetní techniky.
Dalším klíčovým pozorováním účastníků Folding@home je, že mnozí jsou muži. To bylo také pozorováno u jiných distribuovaných projektů. Kromě toho mnoho účastníků pracuje v zaměstnání a kariéře založených na počítačích a technologiích.
Ne všichni účastníci Folding@home jsou hardwaroví nadšenci. Mnoho účastníků provozuje projektový software na nemodifikovaných strojích a účastní se konkurenčně. Do Folding@home je zapojeno více než 100 000 účastníků. Je však těžké zjistit, jaká část účastníků jsou hardwaroví nadšenci. Ačkoli podle projektových manažerů je přínos komunity nadšenců z hlediska výpočetního výkonu podstatně větší.
Výkon

Výkon superpočítače FLOPS se hodnotí spuštěním staršího benchmarku LINPACK . Toto krátkodobé testování má potíže přesně odrážet trvalý výkon na úkolech v reálném světě, protože LINPACK efektivněji mapuje hardware superpočítačů. Výpočetní systémy se liší architekturou a designem, takže přímé srovnání je obtížné. Navzdory tomu FLOPS zůstává primární metrikou rychlosti používanou v superpočítačích. Naproti tomu Folding@home určuje své FLOPS pomocí času na nástěnných hodinách měřením toho, kolik času zabere dokončení jeho pracovních jednotek.
16. září 2007, z velké části díky účasti konzolí PlayStation 3, dosáhl projekt Folding@home oficiálně vyšší úrovně výkonu než jeden nativní petaFLOPS , čímž se stal prvním počítačovým systémem jakéhokoli druhu, který tak učinil. V té době byl nejrychlejší superpočítač Top500 BlueGene/L s 0,280 petaFLOPS. Následující rok, 7. května 2008, dosáhl projekt úrovně udržitelného výkonu vyšší než dva nativní petaFLOPS, následované třemi a čtyřmi nativními milníky petaFLOPS v srpnu 2008 a 28. září 2008. Dne 18. února 2009 dosáhl Folding@home pěti nativních petaFLOPS a byl prvním počítačovým projektem, který těchto pět úrovní splnil. Pro srovnání, nejrychlejším superpočítačem listopadu 2008 byl Roadrunner společnosti IBM s 1,105 petaFLOPS. Dne 10. listopadu 2011 výkon Folding@home překročil šest nativních petaFLOPS s ekvivalentem téměř osmi x86 petaFLOPS. V polovině května 2013 dosáhl Folding@home přes sedm nativních petaFLOPS, což odpovídá 14,87 x86 petaFLOPS. Poté dosáhla 21. června osmi nativních petaFLOPS, 9. září toho roku devíti, petaFLOPS 17,9 x86. 11. května 2016 Folding@home oznámil, že se pohybuje směrem k dosažení značky 100 x86 petaFLOPS.
Další využití vzrostlo díky lepší informovanosti a účasti na projektu z důvodu pandemie koronaviru v roce 2020. 20. března 2020 společnost Folding@home prostřednictvím Twitteru oznámila, že běží s více než 470 nativními petaFLOPS, což je ekvivalent 958 x86 petaFLOPS. Do 25. března dosáhl 768 petaFLOPS nebo 1,5 x86 exaFLOPS, což z něj činí první výpočetní systém exaFLOP . 20. listopadu 2020 má Folding@home kvůli chybě výpočtu pouze exaFLOPS 0,2 x86.
Body
Podobně jako u jiných distribuovaných výpočetních projektů Folding@home kvantitativně hodnotí příspěvky uživatelů k projektu prostřednictvím úvěrového systému. Všechny jednotky z daného proteinového projektu mají jednotný základní kredit, který je určen porovnáním jedné nebo více pracovních jednotek z tohoto projektu na oficiálním referenčním stroji před vydáním projektu. Každý uživatel dostává tyto základní body za absolvování každé pracovní jednotky, ačkoli pomocí klíče může získat přidané bonusové body za spolehlivé a rychlé dokončení jednotek, které jsou náročnější na výpočetní výkon nebo mají větší vědeckou prioritu. Uživatelé mohou také získat kredit za svou práci klienti na více počítačích. Tento bodový systém se pokouší sladit udělený kredit s hodnotou vědeckých výsledků.
Uživatelé mohou své příspěvky registrovat pod týmem, který kombinuje body všech jejich členů. Uživatel může založit vlastní tým nebo se může připojit ke stávajícímu týmu. V některých případech může mít tým vlastní zdroje pomoci nebo náboru řízené komunitou, například internetové fórum . Body mohou podpořit přátelskou soutěž mezi jednotlivci a týmy o maximální využití projektu, což může přinést prospěch skládající se komunitě a urychlit vědecký výzkum. Statistiky jednotlivců a týmů jsou zveřejněny na webových stránkách Folding@home.
Pokud uživatel nevytvoří nový tým nebo se nepřipojí ke stávajícímu týmu, tento uživatel se automaticky stane součástí týmu „Výchozí“. Tento „výchozí“ tým má číslo týmu „0“. Statistiky se shromažďují pro tento tým „Výchozí“ i pro speciálně pojmenované týmy.
Software
Software Folding@home na konci uživatele zahrnuje tři primární komponenty: pracovní jednotky, jádra a klient.
Pracovní jednotky
Pracovní jednotka je proteinová data, která má klient zpracovat. Pracovní jednotky jsou zlomkem simulace mezi stavy v Markovově modelu . Poté, co byla pracovní jednotka stažena a kompletně zpracována dobrovolnickým počítačem, je vrácena na servery Folding@home, které poté dobrovolníkovi udělí kreditní body. Tento cyklus se automaticky opakuje. Všechny pracovní jednotky mají přidružené termíny a pokud je tento termín překročen, uživatel nemusí získat kredit a jednotka bude automaticky znovu vydána jinému účastníkovi. Protože skládání bílkovin probíhá sériově a mnoho pracovních jednotek je generováno z jejich předchůdců, umožňuje to celkovému procesu simulace běžet normálně, pokud se pracovní jednotka nevrátí po přiměřené době. Vzhledem k těmto termínům je minimální systémový požadavek pro Folding@home procesor Pentium 3 450 MHz s rozšířením Streaming SIMD Extensions (SSE). Pracovní jednotky pro vysoce výkonné klienty však mají mnohem kratší termín než ty pro klienta s jedním procesorem, protože hlavní část vědeckého přínosu závisí na rychlém dokončení simulací.
Před zveřejněním projdou pracovní jednotky několika kroky k zajištění kvality, aby ty problematické nebyly plně dostupné. Tyto testovací fáze zahrnují interní, beta a pokročilé, před finálním úplným vydáním ve Folding@home. Pracovní jednotky Folding@home jsou obvykle zpracovávány pouze jednou, s výjimkou vzácných případů, kdy během zpracování dojde k chybám. Pokud k tomu dojde u tří různých uživatelů, jednotka se automaticky stáhne z distribuce. Fórum podpory Folding@home lze použít k rozlišení problémů způsobených problematickým hardwarem a špatnými pracovními jednotkami.
Jádra
Specializované programy molekulární dynamiky, označované jako „FahCores“ a často zkráceně „jádra“, provádějí výpočty na pracovní jednotce jako proces na pozadí . Velká většina jader Folding@home je založena na systému GROMACS , jednom z nejrychlejších a nejpopulárnějších softwarových balíčků molekulární dynamiky, který do značné míry sestává z ručně optimalizovaného kódu jazyka sestavení a hardwarových optimalizací. Přestože je GROMACS software s otevřeným zdrojovým kódem a existuje spolupráce mezi laboratoří Pande a vývojáři GROMACS, Folding@home k zajištění platnosti dat používá licenci uzavřeného zdroje . Mezi méně aktivní jádra patří ProtoMol a SHARPEN. Folding@home používá AMBER , CPMD , Desmond a TINKER , ale od té doby byly v důchodu a již nejsou v aktivní službě. Některá z těchto jader provádějí explicitní solvatační výpočty, ve kterých je modelováno obklopující rozpouštědlo (obvykle voda) atom po atomu; zatímco jiní provádějí implicitní solvatační metody, kde je rozpouštědlo považováno za matematické kontinuum. Jádro je oddělené od klienta, aby bylo možné automaticky aktualizovat vědecké metody bez nutnosti aktualizace klienta. Jádra pravidelně vytvářejí kontrolní body výpočtu, takže pokud jsou přerušeny, mohou po spuštění pokračovat v práci od tohoto bodu.
Klient
Účastník Folding@home si nainstaluje klientský program na svůj osobní počítač . Uživatel komunikuje s klientem, který spravuje ostatní softwarové komponenty na pozadí. Prostřednictvím klienta může uživatel pozastavit proces skládání, otevřít protokol událostí, zkontrolovat postup práce nebo zobrazit osobní statistiky. Počítačoví klienti běží nepřetržitě na pozadí s velmi nízkou prioritou a využívají nečinný výpočetní výkon, takže normální používání počítače není ovlivněno. Maximální využití CPU lze upravit pomocí nastavení klienta. Klient se připojí k programu Folding @ home serverem a získá pracovní jednotku a mohou také stáhnout příslušnou jádro pro nastavení klienta, operační systém a základní hardwarovou architekturu. Po zpracování je pracovní jednotka vrácena na servery Folding@home. Počítačoví klienti jsou přizpůsobeni jednoprocesorovým a vícejádrovým procesorovým systémům a jednotkám pro zpracování grafiky . Rozmanitost a síla každé hardwarové architektury poskytuje Folding@home schopnost efektivně a včas dokončit mnoho typů simulací (za několik týdnů nebo měsíců, nikoli let), což má značnou vědeckou hodnotu. Tito klienti společně umožňují výzkumným pracovníkům studovat biomedicínské otázky, které byly dříve považovány za nepraktické pro výpočetní řešení.
Profesionální vývojáři softwaru jsou zodpovědní za většinu kódu Folding@home, a to jak na straně klienta, tak na straně serveru. Vývojový tým zahrnuje programátory z Nvidia , ATI , Sony a Cauldron Development. Klienty je možné stahovat pouze z oficiálních webových stránek Folding@home nebo od jejich obchodních partnerů a budou komunikovat pouze se soubory počítače Folding@home. Budou nahrávat a stahovat data pomocí datových serverů Folding@home (přes port 8080, 80 jako alternativa) a komunikace se ověřuje pomocí 2048bitových digitálních podpisů . Zatímco grafické uživatelské rozhraní (GUI) klienta je open-source, klient je proprietární software, který jako důvod uvádí bezpečnost a vědeckou integritu.
Toto odůvodnění používání proprietárního softwaru je však sporné, protože i když je licence zpětně vymahatelná v legální oblasti, prakticky to nebrání modifikaci (také známé jako oprava ) spustitelných binárních souborů . Podobně distribuce pouze binárně nebrání svévolné modifikaci spustitelného binárního kódu, a to buď prostřednictvím útoku typu man-in-the-middle při stahování přes internet, nebo přerozdělováním binárních souborů třetí stranou, která byla dříve upraveny buď v jejich binárním stavu (tj. záplatované ), nebo jejich dekompilací a překompilováním po úpravě. Tyto úpravy jsou možné, pokud nejsou binární soubory - a přenosový kanál - podepsány a příjemce/systém příjemce je schopen ověřit digitální podpis, v takovém případě by měly být nezjistitelné úpravy zjistitelné, ale ne vždy. Ať tak či onak, protože v případě Folding@home jsou vstupní data a výstupní výsledky zpracované klientským softwarem digitálně podepsány, integritu práce lze ověřit nezávisle na integritě samotného klientského softwaru.
Folding@home používá pro vytváření sítí softwarové knihovny Cosm . Folding@home byl spuštěn 1. října 2000 a byl prvním distribuovaným počítačovým projektem zaměřeným na bio-molekulární systémy. Jeho prvním klientem byl spořič obrazovky , který běžel, zatímco počítač nebyl jinak používán. V roce 2004 laboratoř Pande spolupracovala s Davidem P. Andersonem na testování doplňkového klienta na open-source rámci BOINC . Tento klient byl propuštěn do uzavřené beta verze v dubnu 2005; metoda se však stala nepoužitelnou a byla v červnu 2006 odložena.
Jednotky pro zpracování grafiky
Specializovaný hardware grafických procesorových jednotek (GPU) je navržen tak, aby urychlil vykreslování 3-D grafických aplikací, jako jsou videohry, a může u některých typů výpočtů výrazně překonat CPU. GPU jsou jednou z nejvýkonnějších a rychle rostoucích výpočetních platforem a mnoho vědců a výzkumných pracovníků se věnuje obecnému využití výpočetních jednotek na grafických procesorových jednotkách (GPGPU). Hardware GPU se však obtížně používá pro negrafické úlohy a obvykle vyžaduje významnou restrukturalizaci algoritmu a pokročilé porozumění základní architektuře. Takové přizpůsobení je náročné, spíše pro výzkumníky s omezenými zdroji pro vývoj softwaru. Folding@home používá open-source knihovnu OpenMM , která k propojení softwaru molekulární simulace s podkladovou hardwarovou architekturou používá vzor návrhu můstku se dvěma úrovněmi rozhraní API (Application Programming Interface ). S přidáním hardwarových optimalizací nepotřebují simulace GPU založené na OpenMM žádné významné úpravy, ale dosahují výkonu téměř stejného jako ručně vyladěný kód GPU a výrazně překonávají implementace CPU.
Před rokem 2010 byla výpočetní spolehlivost hardwaru GPGPU pro spotřebitele do značné míry neznámá a nepřímé důkazy týkající se nedostatku vestavěné detekce a opravy chyb v paměti GPU vyvolávaly obavy ohledně spolehlivosti. V prvním rozsáhlém testu vědecké přesnosti GPU studie z roku 2010 s více než 20 000 hostiteli v domácí síti Folding@home odhalila měkké chyby v paměťových subsystémech dvou třetin testovaných GPU. Tyto chyby silně korelovaly s architekturou desek, ačkoli studie dospěla k závěru, že spolehlivé výpočty GPU byly velmi proveditelné, pokud byla věnována pozornost hardwarovým vlastnostem, jako je detekce chyb na straně softwaru.
První generace klienta GPU Folding@home (GPU1) byla vydána veřejnosti 2. října 2006 a přinesla 20–30násobné zrychlení některých výpočtů oproti protějškům systému GROMACS na bázi CPU . Bylo to vůbec poprvé, kdy byly GPU použity buď pro distribuované výpočty, nebo pro výpočty hlavní molekulární dynamiky. GPU1 poskytl výzkumníkům značné znalosti a zkušenosti s vývojem softwaru GPGPU , ale v reakci na vědecké nepřesnosti s DirectX byl 10. dubna 2008 následován GPU2, druhou generací klienta. Po zavedení GPU2 byl GPU1 oficiálně vyřazen 6. června. Ve srovnání s GPU1 byl GPU2 vědecky spolehlivější a produktivnější, běžel na grafických kartách Nvidia podporujících ATI a CUDA a podporoval pokročilejší algoritmy, větší proteiny a vizualizaci v reálném čase. simulace proteinů. V návaznosti na to byla 25. května 2010 vydána třetí generace klienta GPU Folding@home (GPU3). Přestože byl GPU3 zpětně kompatibilní s GPU2, byl stabilnější, efektivnější a flexibilnější ve svých vědeckých schopnostech a používal OpenMM nad rámec OpenCL framework. Přestože tito klienti GPU3 nativně nepodporovali operační systémy Linux a macOS , uživatelé Linuxu s grafickými kartami Nvidia je mohli spustit prostřednictvím softwarové aplikace Wine . GPU zůstávají nejsilnější platformou Folding@home ve FLOPS . V listopadu 2012 tvořili klienti GPU 87% propustnosti celého projektu x86 FLOPS.
Nativní podpora grafických karet Nvidia a AMD pod Linuxem byla zavedena s FahCore 17, který používá spíše OpenCL než CUDA.
PlayStation 3
Od března 2007 do listopadu 2012 využívala Folding@home výpočetní výkon PlayStation 3s . V době svého vzniku poskytl jeho hlavní streamovací procesor Cell u některých výpočtů 20násobné zvýšení rychlosti oproti počítačům, přičemž výpočetní výkon nebyl k dispozici u jiných systémů, jako je Xbox 360 . Vysoká rychlost a účinnost PS3 přinesla další příležitosti pro hodnotné optimalizace podle Amdahlova zákona a významně změnila kompromis mezi výpočetní účinností a celkovou přesností, což umožnilo použití složitějších molekulárních modelů za malé přidané výpočetní náklady. To umožnilo Folding@home provádět biomedicínské výpočty, které by jinak byly výpočetně nemožné.
Klient PS3 byl vyvinut ve spolupráci mezi společností Sony a laboratoří Pande a poprvé byl vydán jako samostatný klient 23. března 2007. Jeho vydání způsobilo, že se Folding@home stal prvním distribuovaným počítačovým projektem využívajícím PS3. 18. září následujícího roku se klient PS3 stal kanálem Life s PlayStation při jeho spuštění. V typech výpočtů, které může provádět, se klient v době svého zavedení vešel mezi flexibilitu CPU a rychlost GPU. Na rozdíl od klientů běžících na osobních počítačích však uživatelé nemohli při spuštění Folding@home provádět na PS3 jiné činnosti. Jednotné konzolové prostředí PS3 usnadnilo technickou podporu a učinilo Folding@home uživatelsky přívětivější . PS3 měl také schopnost rychle streamovat data do svého GPU, který byl použit pro vizualizaci aktuální dynamiky proteinů na atomové úrovni v reálném čase.
6. listopadu 2012 společnost Sony ukončila podporu pro klienta Folding@home PS3 a další služby dostupné v rámci hry Life with PlayStation. Za dobu pěti let a sedmi měsíců přispělo více než 15 milionů uživatelů více než 100 milionů hodin práce na počítači Folding@home, což projektu výrazně pomohlo s výzkumem nemocí. Po diskusích s laboratoří Pande se Sony rozhodlo aplikaci ukončit. Pande považoval klienta PlayStation 3 za „měnič hry“ projektu.
Vícejádrový klient pro zpracování
Folding@home může využívat paralelní výpočetní schopnosti moderních vícejádrových procesorů. Možnost používat několik jader CPU současně umožňuje dokončení simulace mnohem rychleji. Tato jádra CPU spolupracují a dokončují jednotlivé pracovní jednotky proporcionálně rychleji než standardní uniprocesorový klient. Tato metoda je vědecky cenná, protože umožňuje provádět mnohem delší simulační trajektorie za stejnou dobu a snižuje tradiční potíže se škálováním velké simulace na mnoho samostatných procesorů. Publikace z roku 2007 v časopise Journal of Molecular Biology spoléhala na vícejádrové zpracování, které simulovalo skládání části villinového proteinu přibližně 10krát déle, než bylo možné u klienta s jedním procesorem, v souladu s experimentálními rychlostmi skládání.
V listopadu 2006 byli klienti první generace symetrického vícenásobného zpracování (SMP) veřejně uvolněni pro otevřené beta testování, označované jako SMP1. Tito klienti používali pro paralelní zpracování komunikační protokoly MPI ( Message Passing Interface ), protože v té době jádra GROMACS nebyla navržena pro použití s více vlákny. Toto bylo poprvé, kdy projekt distribuovaných počítačů použil MPI. Přestože si klienti vedli dobře v operačních systémech založených na Unixu , jako jsou Linux a macOS, v systému Windows byly problematické . 24. ledna 2010, SMP2, druhé generace klientů SMP a nástupce SMP1, byl propuštěn jako otevřený beta a nahradil složité MPI s spolehlivější vlákna založeném realizaci.
SMP2 podporuje zkoušku speciální kategorie bigadv pracovních jednotek, navržených pro simulaci proteinů, které jsou neobvykle velké a výpočetně náročné a mají velkou vědeckou prioritu. Tyto jednotky původně vyžadovaly minimálně osm jader CPU, což bylo zvýšeno na šestnáct později, 7. února 2012. Spolu s těmito přidanými hardwarovými požadavky oproti standardním pracovním jednotkám SMP2 vyžadují více systémových prostředků, jako je paměť s náhodným přístupem (RAM) a šířku pásma internetu . Na oplátku jsou uživatelé, kteří je provozují, odměněni 20% zvýšením oproti systému bonusových bodů SMP2. Kategorie bigadv umožňuje Folding@home spouštět obzvláště náročné simulace po dlouhou dobu, které dříve vyžadovaly použití superpočítačových klastrů a nemohly být prováděny nikde jinde na Folding@home. Mnoha uživatelům s hardwarem schopným provozovat jednotky bigadv později jejich nastavení hardwaru bylo považováno za nezpůsobilé pro pracovní jednotky bigadv, když byla zvýšena minimální jádra procesoru, takže byli schopni provozovat pouze normální pracovní jednotky SMP. To frustrovalo mnoho uživatelů, kteří investovali značné množství peněz do programu, jen aby jejich hardware byl zastaralý pro účely bigadv krátce poté. V důsledku toho Pande v lednu 2014 oznámil, že program bigadv skončí 31. ledna 2015.
V7

Klient V7 je sedmou a nejnovější generací klientského softwaru Folding@home a je úplným přepsáním a sjednocením předchozích klientů pro operační systémy Windows , macOS a Linux . Byla vydána 22. března 2012. Stejně jako její předchůdci může V7 spouštět Folding@home na pozadí s velmi nízkou prioritou , což umožňuje jiným aplikacím využívat prostředky CPU, jak potřebují. Je navržen tak, aby instalace, spouštění a provoz byl uživatelsky přívětivější pro nováčky a nabízel vědcům větší vědeckou flexibilitu než předchozí klienti. V7 používá Trac ke správě svých chybových lístků , aby uživatelé viděli jeho vývojový proces a poskytovali zpětnou vazbu.
V7 se skládá ze čtyř integrovaných prvků. Uživatel obvykle komunikuje s otevřeným zdrojovým rozhraním V7 s názvem FAHControl. Toto má režimy uživatelského rozhraní Nováček, Pokročilý a Expert a má schopnost monitorovat, konfigurovat a ovládat mnoho vzdálených skládacích klientů z jednoho počítače. FAHControl řídí FAHClient, back- endovou aplikaci, která zase spravuje každý FAHSlot (nebo slot ). Každý slot funguje jako náhrada dříve odlišných počítačových klientů Folding@home v6 uniprocessor, SMP nebo GPU, protože dokáže nezávisle stahovat, zpracovávat a nahrávat pracovní jednotky. Funkce FAHViewer, vytvořená podle prohlížeče PS3, zobrazuje 3D vykreslování aktuálně zpracovávaného proteinu v reálném čase, je-li k dispozici.
Google Chrome
V roce 2014 byl vydán klient pro webové prohlížeče Google Chrome a Chromium , který uživatelům umožňuje spouštět Folding@home ve svém webovém prohlížeči. Klient používá Google ‚s Native Client funkci (NaCl) na bázi chromu webových prohlížečů pro spuštění programu Folding @ home kód na téměř nativní rychlostí v karanténě na počítači uživatele. Kvůli postupnému vyřazování NaCL a změnám ve Folding@home byl webový klient v červnu 2019 trvale ukončen.
Android
V červenci 2015 byl na Google Play vydán klient pro mobilní telefony Android pro zařízení se systémem Android 4.4 KitKat nebo novějším.
16. února 2018 byl z Google Play odebrán klient Android, který byl nabízen ve spolupráci se společností Sony . Byly oznámeny plány nabídnout v budoucnu alternativu open source.
Srovnání s jinými molekulárními simulátory
Rosetta@home je distribuovaný výpočetní projekt zaměřený na predikci proteinové struktury a je jedním z nejpřesnějších prediktorů terciární struktury . Konformační stavy ze softwaru Rosetta lze použít k inicializaci Markovova stavového modelu jako výchozích bodů pro simulace Folding@home. Algoritmy predikce struktury lze naopak zlepšit pomocí termodynamických a kinetických modelů a vzorkovacích aspektů simulací skládání proteinů. Protože se Rosetta pokouší předpovědět pouze konečný skládaný stav, a nikoli, jak probíhá skládání, Rosetta@home a Folding@home se doplňují a řeší velmi odlišné molekulární otázky.
Anton je superpočítač pro speciální účely vytvořený pro simulace molekulární dynamiky. V říjnu 2011 byly Anton a Folding@home dva nejsilnější systémy molekulární dynamiky. Anton je jedinečný ve své schopnosti produkovat jednotlivé extrémně dlouhé výpočetně nákladné molekulární trajektorie, jako je ta v roce 2010, která dosáhla milisekundového rozsahu. Tyto dlouhé trajektorie mohou být zvláště užitečné u některých typů biochemických problémů. Anton však pro analýzu nepoužívá Markovovy státní modely (MSM). V roce 2011 laboratoř Pande zkonstruovala MSM ze dvou 100 µs Antonových simulací a našla alternativní skládací cesty, které nebyly viditelné Antonovou tradiční analýzou. Došli k závěru, že existuje malý rozdíl mezi MSM konstruovanými z omezeného počtu dlouhých trajektorií nebo sestavenými z mnoha kratších trajektorií. V červnu 2011 Folding@home přidal vzorkování simulace Anton ve snaze lépe určit, jak jsou její metody srovnatelné s Antonovými. Na rozdíl od kratších trajektorií Folding@home, které jsou přístupnější distribuovaným výpočtům a jiným metodám paralelizace, však delší trajektorie nevyžadují adaptivní vzorkování, aby dostatečně vzorkovaly fázový prostor proteinu . Z tohoto důvodu je možné, že kombinace simulačních metod Anton a Folding@home by poskytla důkladnější vzorkování tohoto prostoru.
Viz také
Reference
Prameny
- Folding@home (nde), „About“ , Folding@home , vyvoláno 26. dubna 2020
- Mims, Christopher (8. listopadu 2010), „Proč je čínský nový superpočítač technicky nejrychlejší pouze na světě“ , Technology Review , MIT, archivováno z originálu 21. září 2012 , vyvoláno 20. září 2012
- News 12 Long Island (13. května 2020), Univerzita Hofstra půjčuje laboratoř zdrojů pro celosvětový výzkum COVID-19 , získáno 24. května 2020
- Pande, Vijay S. (10. listopadu 2008), „Re: Statistiky ATI a NVIDIA vs. čísla PPD“ , Folding Forum , pátý příspěvek zdola, archivováno z originálu 21. září 2012 , vyvoláno 26. dubna 2020
externí odkazy






