Isopropylalkohol - Isopropyl alcohol
|
|
|||
| Jména | |||
|---|---|---|---|
|
Preferovaný název IUPAC
Propan-2-ol |
|||
| Ostatní jména | |||
| Identifikátory | |||
|
3D model ( JSmol )
|
|||
| 635639 | |||
| ČEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Informační karta ECHA |
100 000,601 |
||
| 1464 | |||
| KEGG | |||
|
PubChem CID
|
|||
| Číslo RTECS | |||
| UNII | |||
| UN číslo | 1219 | ||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Vlastnosti | |||
| C 3 H 8 O | |||
| Molární hmotnost | 60,096 g/mol | ||
| Vzhled | Bezbarvá kapalina | ||
| Zápach | Štiplavý alkoholický zápach | ||
| Hustota | 0,786 g/cm 3 (20 ° C) | ||
| Bod tání | -89 ° C (-128 ° F, 184 K) | ||
| Bod varu | 82,6 ° C (180,7 ° F; 355,8 K) | ||
| Mísitelný s vodou | |||
| Rozpustnost | Mísitelný s benzenem , chloroformem , ethanolem , etherem , glycerinem ; rozpustný v acetonu | ||
| log P | −0,16 | ||
| Kyselost (p K a ) | 16.5 | ||
| −45,794 · 10 −6 cm 3 /mol | |||
|
Index lomu ( n D )
|
1,3776 | ||
| Viskozita | 2,86 cP při teplotě 15 ° C 1,96 cP při teplotě 25 ° C 1,77 c P při 30 ° C
|
||
| 1,66 D (plyn) | |||
| Farmakologie | |||
| D08AX05 ( WHO ) | |||
| Nebezpečí | |||
| Hlavní nebezpečí | Hořlavý | ||
| Bezpečnostní list |
Viz: datová stránka Externí MSDS |
||
| Piktogramy GHS |
 
|
||
| Signální slovo GHS | Nebezpečí | ||
| H225 , H319 , H336 | |||
| P210 , P261 , P305+351+338 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | Otevřený pohár: 11,7 ° C (53,1 ° F; 284,8 K) Zavřený pohár: 13 ° C (55 ° F) |
||
| 399 ° C (750 ° F; 672 K) | |||
| Výbušné limity | 2–12,7% | ||
|
Mezní hodnota prahu (TLV)
|
980 mg/m 3 (TWA), 1225 mg/m 3 (STEL) | ||
| Smrtelná dávka nebo koncentrace (LD, LC): | |||
|
LD 50 ( střední dávka )
|
|||
|
LC 50 ( střední koncentrace )
|
|||
|
LC Lo ( nejnižší publikované )
|
|||
| NIOSH (limity expozice USA pro zdraví): | |||
|
PEL (přípustné)
|
PEL 400 ppm (980 mg/m 3 ) | ||
|
REL (doporučeno)
|
PEL 400 ppm (980 mg/m 3 ), ST 500 ppm (1225 mg/m 3 ) | ||
|
IDLH (bezprostřední nebezpečí)
|
2 000 ppm | ||
| Související sloučeniny | |||
|
Související alkoholy
|
1-propanol , ethanol , 2-butanol | ||
| Stránka doplňkových údajů | |||
|
Index lomu ( n ), dielektrická konstanta (ε r ) atd. |
|||
|
Termodynamická
data |
Fázové chování pevná látka – kapalina – plyn |
||
| UV , IR , NMR , MS | |||
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Reference na infobox | |||
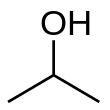
Isopropylalkohol ( IUPAC název propan-2-ol a také nazývaný isopropanol nebo 2-propanol ) je bezbarvá , hořlavá chemická sloučenina ( chemický vzorec CH 3 CHOHCH 3 ) se silným zápachem . Jako isopropylová skupina navázaná na hydroxylovou skupinu je to nejjednodušší příklad sekundárního alkoholu , kde je atom uhlíku alkoholu připojen ke dvěma dalším atomům uhlíku. Jedná se o strukturální izomer z 1-propanolu a ethyl-methyl-etherem .
Používá se při výrobě široké škály průmyslových a domácích chemikálií a je běžnou součástí chemikálií, jako jsou antiseptika , dezinfekční prostředky a detergenty .
Vlastnosti
Isopropylalkohol je mísitelný s vodou, ethanolem , etherem a chloroformem . Rozpouští ethylcelulózu , polyvinylbutyral , mnoho olejů, alkaloidy, gumy a přírodní pryskyřice. Na rozdíl od ethanolu nebo methanolu není isopropylalkohol mísitelný s roztoky solí a lze jej oddělit od vodných roztoků přidáním soli, jako je chlorid sodný . Tento proces se hovorově nazývá vysolení a způsobí, že se koncentrovaný isopropylalkohol oddělí do odlišné vrstvy.
Isopropylalkohol tvoří s vodou azeotrop , který dává bod varu 80,37 ° C (176,67 ° F) a složení 87,7% hmotnostních (91% objemových) isopropylalkoholu. Směsi vody a isopropylalkoholu mají snížené teploty tání. Má mírně nahořklou chuť a není bezpečné ho pít.
Isopropylalkohol se s klesající teplotou stává stále viskóznějším a mrzne při -89 ° C (-128 ° F).
Isopropylalkohol má maximální absorbance při 205 nm v ultrafialově viditelném spektru.
Reakce
Isopropylalkohol lze oxidovat na aceton , což je odpovídající keton . Toho lze dosáhnout použitím oxidačních činidel, jako je kyselina chromová , nebo dehydrogenací isopropylalkoholu na zahřátém měděném katalyzátoru :
- (CH 3 ) 2 CHOH → (CH 3 ) 2 CO + H 2
Isopropylalkohol se často používá jako zdroj rozpouštědel i hydridů při redukčních a jiných přenosových reakcích Meerwein-Ponndorf-Verley . Isopropylalkohol lze převést na 2-brompropan pomocí bromidu fosforitého nebo dehydratovat na propen zahříváním s kyselinou sírovou .
Jako většina alkoholů, isopropylalkohol reaguje s aktivními kovy, jako je draslík, za vzniku alkoxidů, které lze nazvat isopropoxidy . Reakce s hliníkem (iniciovaná stopou rtuti ) se používá k přípravě katalyzátoru isopropoxidu hlinitého .
Dějiny
V roce 1920 společnost Standard Oil poprvé vyrobila izopropylalkohol hydratací propenu . Isopropylalkohol byl oxidován na aceton za účelem přípravy korditu , bezdýmného, málo výbušného paliva.
Výroba
V roce 1994 bylo ve Spojených státech, Evropě a Japonsku vyrobeno 1,5 milionu tun isopropylalkoholu. Primárně se vyrábí kombinací vody a propenu v hydratační reakci nebo hydrogenací acetonu . Hydratační proces má dvě cesty a oba způsoby vyžadují, aby byl isopropylalkohol separován z vody a dalších vedlejších produktů destilací . Isopropylalkohol a voda tvoří azeotrop a jednoduchou destilací se získá materiál, který je 87,9% hmotn. Izopropylalkoholu a 12,1% hmotn. Vody. Čistý ( bezvodý ) isopropylalkohol se vyrábí azeotropickou destilací mokrého isopropylalkoholu za použití diizopropyletheru nebo cyklohexanu jako azeotropních činidel.
Biologický
Při diabetické ketoacidóze se v těle produkuje malé množství isopropylalkoholu .
Nepřímá hydratace
Nepřímá hydratace reaguje propen s kyselinou sírovou za vzniku směsi esterů sulfátu. Tento proces může používat nekvalitní propen a převládá v USA. Tyto procesy dávají primárně izopropylalkohol spíše než 1-propanol, protože přidání vody nebo kyseliny sírové k propenu se řídí Markovnikovovým pravidlem . Následnou hydrolýzou těchto esterů párou vzniká isopropylalkohol destilací. Diisopropylether je významným vedlejším produktem tohoto procesu; recykluje se zpět do procesu a hydrolyzuje za získání požadovaného produktu.
- CH 3 CH = CH 2 + H 2 O(CH 3 ) 2 CHOH
Přímá hydratace
Přímá hydratace reaguje na propen a vodu, buď v plynné nebo kapalné fázi , za vysokých tlaků v přítomnosti pevných nebo nanesených kyselých katalyzátorů . Tento typ postupu obvykle vyžaduje propylen s vyšší čistotou (> 90%). Přímá hydratace se v Evropě používá častěji.
Hydrogenace acetonu
Isopropylalkohol, mohou být připraveny pomocí hydrogenace z acetonu , avšak tento postup zahrnuje další krok, ve srovnání s výše uvedenými metodami, jako aceton, je sama o sobě běžně připravují z propenu prostřednictvím procesu kumen . V závislosti na hodnotě produktů může zůstat ekonomický. Známým problémem je tvorba MIBK a dalších produktů vlastní kondenzace. Raney nikl byl jedním z původních průmyslových katalyzátorů, moderní katalyzátory jsou často podporované bimetalické materiály. Jedná se o efektivní a snadný proces
Využití

V roce 1990 bylo ve Spojených státech použito 45 000 metrických tun isopropylalkoholu, většinou jako rozpouštědlo pro nátěry nebo pro průmyslové procesy. V tomto roce bylo 5400 metrických tun použito pro domácí účely a ve výrobcích osobní péče. Isopropylalkohol je oblíbený zejména pro farmaceutické aplikace, kvůli své nízké toxicitě. Část izopropylalkoholu se používá jako chemický meziprodukt. Isopropylalkohol lze převést na aceton, ale proces kumenu je významnější.
Solventní
Isopropylalkohol rozpouští širokou škálu nepolárních sloučenin. Ve srovnání s ethanolem se také rychle odpařuje, zanechává téměř nulové stopy oleje a ve srovnání s alternativními rozpouštědly je relativně netoxický. Proto se široce používá jako rozpouštědlo a jako čisticí tekutina, zejména pro rozpouštění olejů. Spolu s ethanolem , n -butanolem a methanolem patří do skupiny alkoholových rozpouštědel.
Isopropylalkohol se běžně používá k čištění brýlí , elektrických kontaktů , audio nebo video páskových hlav , DVD a dalších optických diskových čoček, odstraňování tepelné pasty z chladičů na CPU a dalších obalech IC .
středně pokročilí
Isopropylalkohol se esterifikuje za vzniku isopropylacetátu , dalšího rozpouštědla. Reaguje se sirouhlíkem a hydroxidem sodným za vzniku isopropylxanthátu sodného , herbicidu a činidla pro flotaci rudy . Isopropylalkohol reaguje s chloridem titaničitým a hliníkového kovu, čímž se získá titanu a hliníku isopropoxides , respektive bývalé katalyzátor a druhou chemickou činidla. Tato sloučenina může sama o sobě sloužit jako chemické činidlo tím, že působí jako donor dihydrogenu při transferové hydrogenaci .
Lékařský
Třecí alkohol , dezinfekce rukou a dezinfekční tampony obvykle obsahují 60–70% roztok isopropylalkoholu nebo ethanolu ve vodě . Voda je nutná k otevření membránových pórů bakterií, které působí jako brána pro isopropylalkohol. Jako dezinfekci rukou lze použít 75% v/v roztok ve vodě. Isopropylalkohol se používá jako pomocný prostředek při sušení vody k prevenci otitis externa , známějšího jako ucho plavce.
Počáteční použití jako anestetikum
Ačkoli isopropylalkohol lze použít k anestezii, jeho mnoho negativních vlastností nebo nevýhod toto použití zakazuje. Isopropylalkohol lze také použít podobně jako rozpouštědlo nebo jako anestetikum vdechováním výparů nebo orálně. Včasná použití zahrnovala použití rozpouštědla jako celkového anestetika pro malé savce a hlodavce vědci a některými veterináři. Brzy však byl přerušen, protože nastalo mnoho komplikací, včetně podráždění dýchacích cest, vnitřního krvácení a problémů se zrakem a sluchem. Ve vzácných případech bylo pozorováno respirační selhání vedoucí ke smrti zvířat.
Automobilový průmysl
Isopropylalkohol je hlavní přísadou do aditiv do „plynových sušáren“ . Voda je ve značném množství problémem v palivových nádržích, protože se odděluje od benzínu a při nízkých teplotách může v přívodních potrubích zmrznout. Alkohol neodstraňuje vodu z benzínu, ale alkohol solubilizuje vodu v benzínu. Jakmile je voda rozpustná , nepředstavuje stejné riziko jako nerozpustná voda, protože se již nehromadí v přívodních potrubích a zmrzne, ale je rozpuštěna v samotném palivu. Isopropylalkohol se často prodává v aerosolových plechovkách jako odmrazovač předního skla nebo dveří. Isopropylalkohol se také používá k odstranění stop brzdové kapaliny z hydraulických brzdových systémů, takže brzdová kapalina (obvykle DOT 3 , DOT 4 nebo minerální olej ) nekontaminuje brzdové destičky a nezpůsobuje špatné brzdění. Směsi isopropylalkoholu a vody se také běžně používají v domácí kapalině do ostřikovačů.
Laboratoř
Jako konzervant biologických vzorků poskytuje isopropylalkohol poměrně netoxickou alternativu k formaldehydu a jiným syntetickým konzervantům. K uchování vzorků se používají roztoky isopropylalkoholu 70–99%.
Při extrakci DNA se často používá isopropylalkohol . Laboratorní pracovník jej přidá do roztoku DNA, aby vysrážel DNA, která poté po odstředění vytvoří peletu. To je možné, protože DNA je nerozpustná v isopropylalkoholu.
Bezpečnost
Pára isopropylalkoholu je hustší než vzduch a je hořlavá , s rozsahem hořlavosti mezi 2 a 12,7% ve vzduchu. Mělo by být chráněno před teplem a otevřeným ohněm. Destilace isopropylalkoholu na hořčík byla hlášena za vzniku peroxidů , které mohou po koncentraci explodovat. Isopropylalkohol způsobuje podráždění očí a je potenciálním alergenem. Doporučuje se používat ochranné rukavice.
Toxikologie
Isopropylalkohol je prostřednictvím svých metabolitů o něco toxičtější než ethanol, ale podstatně méně toxický než ethylenglykol nebo methanol. Smrt při požití nebo absorpci i relativně velkého množství je vzácná. Isopropanol i jeho metabolit , aceton , působí jako látky tlumící centrální nervový systém (CNS) . Otrava může nastat při požití, vdechnutí nebo absorpci kůží. Mezi příznaky otravy isopropylalkoholem patří návaly horka , bolest hlavy , závratě , deprese CNS , nevolnost , zvracení , anestezie , hypotermie , nízký krevní tlak , šok , respirační deprese a kóma . Předávkování může způsobit ovocný zápach v dechu v důsledku jeho metabolismu na aceton . Isopropylalkohol nezpůsobuje acidózu aniontové mezery , ale vytváří osmolalovou mezeru mezi vypočtenými a naměřenými osmolalitami séra, stejně jako ostatní alkoholy.
Isopropylalkohol je oxidován za vzniku acetonu alkohol dehydrogenázou v játrech a má biologický poločas u lidí mezi 2,5 a 8,0 hodinami. Na rozdíl od otravy methanolem nebo ethylenglykolem jsou metabolity isopropylalkoholu podstatně méně toxické a léčba je do značné míry podpůrná. Kromě toho neexistují žádné indikace pro použití fomepizolu , inhibitoru alkohol dehydrogenázy, pokud není podezření na společné požití methanolu nebo ethylenglykolu.
Ve forenzní patologii mají lidé, kteří zemřeli v důsledku diabetické ketoacidózy, obvykle koncentrace isopropylalkoholu v krvi desítky mg/dl, zatímco u smrtelného požití isopropylalkoholu mají obvykle koncentrace v krvi stovky mg/dl.