Lakmus - Litmus

Lakmus je ve vodě rozpustná směs různých barviv extrahovaná z lišejníků . Často se absorbuje na filtrační papír za vzniku jedné z nejstarších forem indikátoru pH , která se používá k testování kyselosti materiálů .
Dějiny
Slovo „lakmus“ pochází ze starého severského slova pro „barvivo“ nebo „barvu“. Lakmus poprvé použil asi v roce 1300 španělský lékař Arnaldus de Villa Nova . Od 16. století bylo modré barvivo extrahováno z některých lišejníků, zejména v Nizozemsku .
Přírodní zdroje
Lakmus lze nalézt u různých druhů lišejníků. Barviva se získávají z takových druhů, jako je Roccella tinctoria (jihoamerické), Roccella fuciformis (Angola a Madagaskar), Roccella pygmaea (Alžírsko), Roccelly phycopsis , Lecanora tartarea (Norsko, Švédsko), Variolaria dealbata , Ochrolechia Parella , Parmotrema tinctorum a Parmelia . V současné době jsou hlavními zdroji Roccella montagnei (Mozambik) a Dendrographa leucophoea (Kalifornie).
Využití
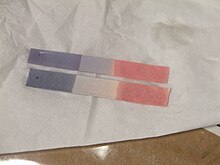
Lakmus se používá hlavně k testování, zda je roztok kyselý nebo zásaditý . Světle modrý lakmusový papír se za kyselých podmínek zbarví do červena a červený lakmusový papír do modra za zásaditých nebo zásaditých podmínek, přičemž ke změně barvy dojde v rozmezí pH 4,5–8,3 při 25 ° C (77 ° F). Neutrální lakmusový papír je fialový. Mokrý lakmusový papír lze také použít k testování plynů rozpustných ve vodě, které ovlivňují kyselost nebo zásaditost ; plyn se rozpustí ve vodě a výsledný roztok barví lakmusový papír. Například plynný čpavek , který je zásaditý, změní lakmusový papír na modrou. Zatímco veškerý lakmusový papír funguje jako papír pH, opak není pravdou.
Lakmus lze také připravit jako vodný roztok, který funguje podobně. Za kyselých podmínek je roztok červený a za zásaditých je roztok modrý.
| Lakmus ( indikátor pH ) | ||
| pod pH 4,5 | nad pH 8,3 | |
| 4.5 | ⇌ | 8.3 |
Chemické reakce jiné než acidobazické mohou také způsobit změnu barvy lakmusového papíru. Například plynný chlór zmodrá lakmusový papír na bílý; lakmusové barvivo se bělí, protože jsou přítomny ionty chlornanu . Tato reakce je nevratná, takže lakmus v této situaci nepůsobí jako indikátor.
Chemie
Lakmusová směs má číslo CAS 1393-92-6 a obsahuje 10 až přibližně 15 různých barviv. Všechny chemické složky lakmusu budou pravděpodobně stejné jako složky související směsi známé jako orcein , ale v různých poměrech. Na rozdíl od orceinu má hlavní složka lakmusu průměrnou molekulovou hmotnost 3 300. Acidobazické indikátory lakmusu vděčí za své vlastnosti chromoforu 7-hydroxyfenoxazonu . Některé frakce lakmusu dostaly specifická jména, včetně erythrolitminu (nebo erythroleinu), azolitminu, spaniolitminu, leucoorceinu a leucazolitminu. Azolitmin vykazuje téměř stejný účinek jako lakmus.
Mechanismus
Červený lakmus obsahuje slabou diprotickou kyselinu . Když je vystavena zásadité sloučenině, vodíkové ionty reagují s přidanou bází. Konjugovaná báze vytvořená z kyseliny lakmusové má modrou barvu, takže mokrý červený lakmusový papír v alkalickém roztoku zmodrá.