Lysin - Lysine

Kosterní vzorec z L lysin
|
|||
|
|
|||
| Jména | |||
|---|---|---|---|
|
Název IUPAC
( 2S ) -2,6-Diaminohexanová kyselina ( L -lysin ) ( 2R ) -2,6-Diaminohexanoic acid ( D -lysine )
|
|||
| Ostatní jména
Lysin, D -lysin, L -lysin, LYS, h -Lys -OH
|
|||
| Identifikátory | |||
|
3D model ( JSmol )
|
|||
| ČEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Informační karta ECHA |
100 000,673 |
||
| KEGG | |||
|
PubChem CID
|
|||
| UNII | |||
|
|||
|
|||
| Vlastnosti | |||
| C 6 H 14 N 2 O 2 | |||
| Molární hmotnost | 146,190 g · mol −1 | ||
| 1,5 kg/l | |||
| Farmakologie | |||
| B05XB03 ( WHO ) | |||
| Stránka doplňkových údajů | |||
|
Index lomu ( n ), dielektrická konstanta (ε r ) atd. |
|||
|
Termodynamická
data |
Fázové chování pevná látka – kapalina – plyn |
||
| UV , IR , NMR , MS | |||
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Reference na infobox | |||
Lysin (symbol Lys nebo K ) je α-aminokyselina, která se používá při biosyntéze proteinů . Obsahuje a-aminoskupinu, (která je v protonované -NH 3 + formě za biologických podmínek), tak kyselinovou skupinu, a-karboxylové (který je v deprotonované -COO - forma za biologických podmínek) a lysyl postranního řetězce ( (CH 2 ) 4 NH 2 ), klasifikující ji jako zásaditou , nabitou (při fyziologickém pH), alifatickou aminokyselinou. To je kódována pomocí kodonů AAA a AAG. Stejně jako téměř všechny ostatní aminokyseliny je a-uhlík chirální a lysin může označovat buď enantiomer nebo racemickou směs obou. Pro účely tohoto článku bude lysin odkazovat na biologicky aktivní enantiomer L-lysin, kde a-uhlík je v konfiguraci S.
Lidské tělo nedokáže syntetizovat lysin. Je nezbytný u lidí a musí být získáván ze stravy. V organismech, které syntetizují lysin, má dvě hlavní biosyntetické dráhy , diaminopimelátovou a α-aminoadipátovou cestu, která využívá odlišné enzymy a substráty a nachází se v různých organismech. Lysinový katabolismus probíhá jednou z několika cest, z nichž nejběžnější je dráha sacharopin .
Lysin hraje u lidí několik rolí, nejdůležitější je proteinogeneze , ale také při síťování kolagenových polypeptidů, příjmu základních minerálních živin a při výrobě karnitinu , který je klíčový v metabolismu mastných kyselin . Lysin je také často zapojen do modifikací histonu , a tak ovlivňuje epigenom . Skupina e -amino se často účastní vodíkových vazeb a jako obecná báze při katalýze . Ε- amonný skupina (NH 3 + ), je připojena ke čtvrté uhlíku z a-uhlíku, který je připojen na karboxylovou skupinu (C = OOH).
Vzhledem k jeho důležitosti v několika biologických procesech může nedostatek lysinu vést k několika chorobným stavům, včetně vadných pojivových tkání, zhoršeného metabolismu mastných kyselin, anémie a systémového nedostatku energie z bílkovin. Naproti tomu nadbytek lysinu způsobený neúčinným katabolismem může způsobit závažné neurologické poruchy .
Lysin byl poprvé izolován německým biologickým chemikem Ferdinandem Heinrichem Edmundem Drechselem v roce 1889 z bílkovinného kaseinu v mléce. Pojmenoval ho „ lysin “. V roce 1902 němečtí chemici Emil Fischer a Fritz Weigert určili chemickou strukturu lysinu jeho syntézou.
Biosyntéza
V přírodě byly pro syntézu lysinu identifikovány dvě cesty. Diaminopimelátová (DAP) dráha patří do biosyntetické rodiny odvozené od aspartátu , která se také podílí na syntéze threoninu , methioninu a isoleucinu . Zatímco a-aminoadipátová (AAA) dráha je součástí biosyntetické rodiny glutamátu .
DAP dráha se nachází v prokaryotech i rostlinách a začíná kondenzační reakcí katalyzovanou dihydrodipikolinát syntázou (DHDPS) (EC 4.3.3.7) mezi derivátem aspartátu, L- aspartát semialdehydu a pyruvátem za vzniku ( 4S ) -4-hydroxy -2,3,4,5-tetrahydro- ( 2S ) -dipikolinová kyselina (HTPA). Produkt se pak sníží o dihydrodipikolinát reduktázu (DHDPR) (ES 1.3.1.26), s NAD (P) H jako donor protonu, čímž se získá 2,3,4,5-tetrahydrodipicolinate (THDP). Od této chvíle byly nalezeny čtyři varianty dráhy, a to acetyláza, aminotransferáza, dehydrogenáza a sukcinyláza. Jak varianty acetylázy, tak sukcinylázy používají čtyři enzymy katalyzované kroky, cesta aminotransferázy používá dva enzymy a cesta dehydrogenázy používá jeden enzym. Tyto čtyři varianty cest konvergují za vzniku předposledního produktu, meso -diaminopimelátu, který je následně enzymaticky dekarboxylován v ireverzibilní reakci katalyzované diaminopimelát dekarboxylázou (DAPDC) (EC 4.1.1.20) za vzniku L -lysinu. DAP dráha je regulována na několika úrovních, včetně předřazených enzymů zapojených do zpracování aspartátu, stejně jako v počátečním kondenzačním kroku katalyzovaném DHDPS. Lysin dodává těmto enzymům silnou smyčku negativní zpětné vazby a následně reguluje celou dráhu.
Dráha AAA zahrnuje kondenzaci a-ketoglutarátu a acetyl-CoA prostřednictvím meziproduktu AAA pro syntézu L- lysinu. Bylo prokázáno, že tato cesta je přítomna u několika druhů kvasinek , stejně jako u prvoků a vyšších hub. Bylo také oznámeno, že u Thermus thermophilus a Pyrococcus horikoshii byla nalezena alternativní varianta cesty AAA , což by mohlo naznačovat, že tato cesta je v prokaryotech rozšířenější, než se původně navrhovalo. První a rychlost omezující krok v AAA dráhy je kondenzační reakce mezi acetyl-CoA a alfa-ketoglutarátu katalyzované homocitrate-synthasy (HCS) (ES 2.3.3.14), čímž se získá meziprodukt homocitryl-CoA, který je hydrolyzovaný By the stejný enzym pro produkci homocitrátu . Homocitrate je enzymaticky dehydratuje podle homoaconitase (HAC) (ES 4.2.1.36), čímž se získá cis- -homoaconitate . HAc pak katalyzuje druhou reakci, při které cis -homoconitát podléhá rehydrataci za vzniku homoisocitrátu . Výsledný produkt podléhá oxidační dekarboxylaci homoisocitrát dehydrogenázou (HIDH) (EC 1.1.1.87) za vzniku α -ketoadipátu. AAA se pak vytvoří prostřednictvím pyridoxal 5'-fosfátové (PLP) závislé aminotransferázy (PLP-AT) (EC 2.6.1.39) za použití glutamátu jako donoru aminoskupiny. Od tohoto okamžiku se cesta AAA mění podle [něco zde chybí? -> přinejmenším záhlaví sekce! ] o království. V houbách, AAA se sníží na a-aminoadipate-semialdehyd přes AAA reduktázy (EC 1.2.1.95) v jedinečném proces mezi polyadenylační a redukce, který se aktivuje pomocí phosphopantetheinyl transferázou (ES 2.7.8.7). Jakmile se vytvoří semialdehyd, saccharopine reduktázy (EC 1.5.1.10) katalyzuje kondenzační reakci s glutamátu a NAD (P) H jako donor protonu a imin se redukuje za vzniku předposlední produkt, saccharopine. Poslední krok cesty v houbách zahrnuje sacharopin dehydrogenázu (SDH) (EC 1.5.1.8) katalyzovanou oxidační deaminaci sacharopinu , což vede k L -lysinu. U varianty AAA nalezené u některých prokaryot je AAA nejprve převedena na N -acetyl-a-aminoadipát, který je fosforylován a poté reduktivně defosforylován na e-aldehyd. Aldehyd je pak transaminován na N -acetyl -lysin, který je deacetylován za vzniku L -lysinu. Enzymy zahrnuté v této variantní cestě však vyžadují další validaci.
Katabolismus
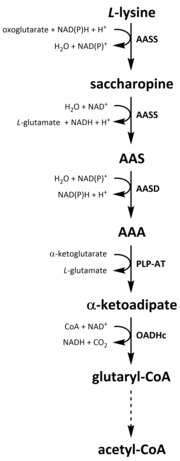
Jako všechny aminokyseliny je katabolismus lysinu iniciován příjmem lysinu v potravě nebo rozkladem intracelulárního proteinu. Katabolismus se také používá jako prostředek ke kontrole intracelulární koncentrace volného lysinu a udržování rovnovážného stavu, aby se zabránilo toxickým účinkům nadměrného množství volného lysinu. Katabolismu lysinu se účastní několik cest, ale nejčastěji se používá dráha sacharopinu, která u zvířat probíhá primárně v játrech (a ekvivalentních orgánech), konkrétně v mitochondriích . Toto je opak dříve popsané cesty AAA. U zvířat a rostlin jsou první dva kroky dráhy sacharopinu katalyzovány bifunkčním enzymem, α-aminoadipovou semialdehyd syntázou (AASS) , které mají lysin-ketoglutarát reduktázu (LKR) (EC 1.5.1.8) a SDH aktivity, zatímco v jiných organismech, jako jsou bakterie a houby, jsou oba tyto enzymy kódovány samostatnými geny . První krok zahrnuje redukci L -lysinu katalyzovanou LKR v přítomnosti a -ketoglutarátu za vzniku sacharopinu, přičemž NAD (P) H působí jako donor protonů. Saccharopin pak podstoupí dehydratační reakci, katalyzovanou SDH v přítomnosti NAD + , za vzniku AAS a glutamátu. AAS dehydrogenáza (AASD) (EC 1.2.1.31) poté dále dehydratuje molekulu na AAA. Následně PLP-AT katalyzuje reverzní reakci na reakci biosyntetické dráhy AAA, což vede k přeměně AAA na α-ketoadipát. Produkt, α-ketoadipát, je dekarboxylován v přítomnosti NAD + a koenzymu A za vzniku glutaryl-CoA, avšak enzym, který je v tom zahrnut, bude ještě zcela objasněn. Některé důkazy naznačují, že za dekarboxylační reakci je zodpovědný komplex 2-oxoadipát dehydrogenázy (OADHc), který je strukturně homologní s podjednotkou E1 komplexu oxoglutarát dehydrogenázy (OGDHc) (EC 1.2.4.2). Nakonec je glutaryl-CoA oxidativně dekarboxylován na krotony-CoA pomocí glutaryl-CoA dehydrogenázy (EC 1.3.8.6), která je dále zpracovávána několika enzymatickými kroky za vzniku acetyl-CoA; esenciální uhlíkový metabolit zapojený do cyklu trikarboxylových kyselin (TCA) .
Nutriční hodnota
Lysin je esenciální aminokyselina u lidí. Nutriční požadavky na člověka se pohybují od ~ 60 mg · kg −1 · d −1 v kojeneckém věku do ~ 30 mg · kg −1 · d −1 u dospělých. Tento požadavek je v západní společnosti běžně splňován příjmem lysinu z masných a zeleninových zdrojů, který výrazně překračuje doporučený požadavek. Ve vegetariánské stravě je příjem lysinu menší kvůli omezenému množství lysinu v obilných plodinách ve srovnání se zdroji masa.
Vzhledem k omezující koncentraci lysinu v obilných plodinách se již dlouho spekulovalo, že obsah lysinu lze zvýšit postupy genetické modifikace . Tyto postupy často zahrnovaly záměrnou dysregulaci dráhy DAP zavedením ortologů enzymu DHDPS necitlivých na zpětnou vazbu lysinu . Tyto metody dosáhly omezeného úspěchu pravděpodobně kvůli toxickým vedlejším účinkům zvýšeného volného lysinu a nepřímým účinkům na cyklus TCA. Rostliny akumulují lysin a jiné aminokyseliny ve formě proteinů pro skladování osiva , které se nacházejí v semenech rostliny, což představuje jedlou složku obilných plodin. To zdůrazňuje potřebu nejen zvýšit volný lysin, ale také nasměrovat lysin k syntéze stabilních proteinů pro skladování osiva a následně zvýšit nutriční hodnotu konzumní složky plodin. Přestože se postupy genetické modifikace setkaly s omezeným úspěchem, tradičnější selektivní šlechtitelské techniky umožnily izolaci „ kvalitní proteinové kukuřice “, která významně zvýšila hladiny lysinu a tryptofanu , rovněž esenciální aminokyseliny. Toto zvýšení obsahu lysinu je přičítán na neprůhledný-2 mutací, která snižuje! Transkripci lysinu s chybějícím zein příbuzné skladování osiva proteinů a, jako výsledek, zvýšené hojnost jiných proteinů, které jsou bohaté na lysin. Obvykle se k překonání omezujícího množství lysinu v krmivech pro hospodářská zvířata přidává průmyslově vyráběný lysin. Průmyslový proces zahrnuje fermentační kultivaci Corynebacterium glutamicum a následnou purifikaci lysinu.
Dietní zdroje
Dobrým zdrojem lysinu jsou potraviny s vysokým obsahem bílkovin, jako jsou vejce, maso (konkrétně červené maso, jehněčí, vepřové a drůbež), sója , fazole a hrášek, sýr (zejména parmezán) a některé ryby (například treska a sardinky ). Lysin je limitující aminokyselina (esenciální aminokyselina nacházející se v nejmenším množství v konkrétní potravině) ve většině obilných zrn , ale je hojná ve většině luštěnin (luštěnin). Vegetariánská strava nebo dieta s nízkým obsahem živočišných bílkovin může být pro bílkoviny, včetně lysinu, adekvátní, pokud obsahuje obilná zrna i luštěniny, ale není nutné, aby byly obě skupiny potravin konzumovány ve stejných jídlech.
Potravina má dostatek lysinu, pokud obsahuje alespoň 51 mg lysinu na gram bílkoviny (takže bílkovina je 5,1% lysinu). L-lysin HCl se používá jako doplněk stravy , který poskytuje 80,03% L-lysinu. 1 g L-lysinu je obsažen v 1,25 g L-lysinu HCl.
Biologické role
Nejběžnější rolí lysinu je proteinogeneze. Lysin často hraje důležitou roli ve struktuře bílkovin . Protože jeho postranní řetězec obsahuje na jednom konci kladně nabitou skupinu a dlouhý hydrofobní uhlíkový ocas v blízkosti páteře, je lysin považován za poněkud amfipatický . Z tohoto důvodu lze lysin nalézt pohřbený i běžněji v rozpouštědlových kanálech a na vnější straně proteinů, kde může interagovat s vodním prostředím. Lysin může také přispět ke stabilitě proteinu, protože jeho e-aminoskupina se často účastní vodíkových vazeb , solných můstků a kovalentních interakcí za vzniku Schiffovy báze .
Druhá hlavní role lysinu je v epigenetické regulaci pomocí histonové modifikace . Existuje několik typů kovalentních histonových modifikací, které běžně zahrnují lysinové zbytky nacházející se ve vyčnívajícím ocasu histonů. Modifikace často zahrnují přidání nebo odebrání jako acetyl (CH 3 CO) tvořící acetyllysin nebo vrácení k lysinu, až tři methyl (CH 3 ) , ubikvitin nebo sumo proteinové skupiny. Různé modifikace mají navazující účinky na genovou regulaci , ve které mohou být geny aktivovány nebo potlačovány.
Lysin také hraje klíčovou roli v jiných biologických procesech, včetně; strukturní proteiny pojivových tkání , homeostáza vápníku a metabolismus mastných kyselin . Bylo prokázáno, že lysin se podílí na zesítění mezi třemi šroubovicovými polypeptidy v kolagenu , což má za následek jeho stabilitu a pevnost v tahu. Tento mechanismus je podobný roli lysinu v bakteriálních buněčných stěnách , ve kterých jsou lysin (a meso -diaminopimelát) rozhodující pro tvorbu příčných vazeb, a tedy pro stabilitu buněčné stěny. Tento koncept byl dříve zkoumán jako prostředek k obcházení nechtěného uvolňování potenciálně patogenních geneticky modifikovaných bakterií. Bylo navrženo, aby pro všechny postupy genetické modifikace mohl být použit auxotrofní kmen Escherichia coli ( X 1776), protože kmen není schopen přežít bez suplementace DAP, a proto nemůže žít mimo laboratorní prostředí. Bylo také navrženo, aby se lysin podílel na absorpci vápníku ve střevě a retenci ledvin, a proto může hrát roli v homeostáze vápníku . Nakonec se ukázalo, že lysin je prekurzorem karnitinu , který transportuje mastné kyseliny do mitochondrií , kde je lze oxidovat za uvolňování energie. Karnitin je syntetizován z trimethyllysinu , který je produktem degradace určitých proteinů, protože takový lysin musí být nejprve převeden do proteinů a před přeměnou na karnitin musí být methylován. U savců je však primárním zdrojem karnitinu spíše dietní zdroje než konverze lysinu.
U opsinů, jako je rhodopsin a vizuální opsiny (kódované geny OPN1SW , OPN1MW a OPN1LW ), retinaldehyd tvoří Schiffovu bázi se zachovaným lysinovým zbytkem a interakce světla se skupinou retinylidenu způsobuje transdukci signálu v barevném vidění (viz vizuální cyklus pro detaily).
Sporné role
Dlouho se diskutovalo o tom, že lysin, podávaný intravenózně nebo orálně, může významně zvýšit uvolňování růstových hormonů . To vedlo k tomu, že sportovci používali lysin jako prostředek k podpoře růstu svalů při tréninku, ale dosud nebyl nalezen žádný významný důkaz na podporu této aplikace lysinu.
Protože proteiny viru herpes simplex (HSV) jsou bohatší na arginin a chudší na lysin než buňky, které infikují, byly lysinové doplňky vyzkoušeny jako léčba. Protože jsou tyto dvě aminokyseliny absorbovány ve střevě, regenerovány v ledvinách a přesunuty do buněk stejnými transportéry aminokyselin , množství lysinu by teoreticky omezilo množství argininu dostupného pro replikaci viru. Klinické studie neposkytují dostatečné důkazy o účinnosti jako profylaktické nebo při léčbě ohnisek HSV. V reakci na tvrzení o produktu, že lysin může zlepšit imunitní reakce na HSV, přezkoumání Evropského úřadu pro bezpečnost potravin nenalezlo žádné důkazy o vztahu příčiny a následku. Stejný přehled, publikovaný v roce 2011, nenašel žádný důkaz na podporu tvrzení, že lysin by mohl snížit hladinu cholesterolu, zvýšit chuť k jídlu, přispět k syntéze bílkovin v jakékoli jiné roli než jako běžná živina nebo zvýšit absorpci nebo retenci vápníku.
Role v nemoci
Nemoci související s lysinem jsou výsledkem následného zpracování lysinu, tj. Začlenění do proteinů nebo modifikace do alternativních biomolekul. Role lysinu v kolagenu byla naznačena výše, nicméně nedostatek lysinu a hydroxylysinu zapojeného do zesíťování kolagenových peptidů byl spojen s chorobným stavem pojivové tkáně. Protože je karnitin klíčovým metabolitem odvozeným od lysinu, který se podílí na metabolismu mastných kyselin, může nestandardní strava postrádající dostatek karnitinu a lysinu vést ke snížení hladin karnitinu, což může mít významné kaskádové účinky na zdraví jedince. Bylo také prokázáno , že lysin hraje roli při anémii , protože je podezření, že lysin má vliv na příjem železa a následně na koncentraci feritinu v krevní plazmě . Přesný mechanismus účinku je však třeba ještě objasnit. Nedostatek lysinu je nejčastěji pozorován v nezápadních společnostech a projevuje se jako podvýživa energetických bílkovin , která má hluboké a systémové účinky na zdraví jednotlivce. Existuje také dědičné genetické onemocnění, které zahrnuje mutace enzymů odpovědných za lysinový katabolismus, konkrétně bifunkční enzym AASS sacharopinové dráhy. Kvůli nedostatku lysinového katabolismu se aminokyselina hromadí v plazmě a u pacientů se vyvine hyperlysinémie , která se může projevovat jako asymptomatická až závažná neurologická postižení , včetně epilepsie , ataxie , spasticity a psychomotorického poškození . Klinický význam hyperlysinémie je předmětem debaty v této oblasti, přičemž některé studie nezjistily žádnou korelaci mezi tělesným nebo mentálním postižením a hyperlysinémií. Kromě toho se mutace v genech souvisejících s metabolizmem lysinu podílejí na několika chorobných stavech, včetně epilepsie závislé na pyridoxinu ( gen ALDH7A1 ), α-ketoadipické a α-aminoadipové acidurie ( gen DHTKD1 ) a glutarové acidurie typu 1 ( GCDH gen ).
Hyperlysinurie se vyznačuje vysokým množstvím lysinu v moči. Často je to způsobeno metabolickým onemocněním, kdy je protein podílející se na rozpadu lysinu nefunkční kvůli genetické mutaci. Může se také objevit v důsledku selhání renálního tubulárního transportu.
Použití lysinu v krmivech pro zvířata
Produkce lysinu pro krmení zvířat je významným globálním průmyslovým odvětvím a v roce 2009 dosáhla téměř 700 000 tun za tržní hodnotu přes 1,22 miliardy EUR. Lysin je důležitou přísadou do krmiv pro zvířata, protože je limitující aminokyselinou při optimalizaci růstu některých zvířat, jako jsou prasata a kuřata, na produkci masa. Suplementace lysinem umožňuje použití levnějších rostlinných bílkovin (například kukuřice, nikoli sóji ) při zachování vysokých rychlostí růstu a omezení znečištění vylučováním dusíku. Pokud je však kukuřice používána jako krmivo pro drůbež a prasata, je znečištění fosfáty naopak významnou ekologickou zátěží.
Lysin se průmyslově vyrábí mikrobiální fermentací, zejména na bázi cukru. Výzkum genetického inženýrství aktivně sleduje kmeny bakterií, aby zlepšil účinnost produkce a umožnil výrobu lysinu z jiných substrátů.
V populární kultuře
Film z roku 1993 Jurský park (podle stejnojmenného románu Michaela Crichtona z roku 1990 ) představuje dinosaury, kteří byli geneticky pozměněni tak, že nemohli produkovat lysin, což je příklad inženýrské auxotrofie . Toto bylo známé jako „lysinová událost“ a mělo zabránit klonovaným dinosaurům přežít mimo park a nutit je tak být závislí na lysinových doplňcích poskytovaných veterinárním personálem parku. Ve skutečnosti žádná zvířata nejsou schopna produkovat lysin (je to esenciální aminokyselina ).
V roce 1996 se lysin stal ohniskem případu určování cen , největšího v historii USA. Společnost Archer Daniels Midland zaplatila pokutu 100 milionů USD a tři její vedoucí pracovníci byli odsouzeni a sloužili ve vězení. Vinnými v případě určování cen byly také dvě japonské firmy ( Ajinomoto , Kyowa Hakko) a jihokorejská firma (Sewon). Tajné videonahrávky spiklenců, kteří stanovují cenu lysinu, lze nalézt online nebo na vyžádání videa od amerického ministerstva spravedlnosti, antimonopolní divize. Tento případ posloužil jako základ filmu Informátor! , a knihu se stejným názvem .
Reference
![]() Tento článek byl převzat z následujícího zdroje pod licencí CC BY 4.0 ( 2018 ) ( zprávy recenzenta ):
Cody J Hall; Tatiana P. Soares da Costa (1. června 2018). „Lysin: biosyntéza, katabolismus a role“ (PDF) . WikiJournal of Science . 1 (1): 4. doi : 10,15347/WJS/2018.004 . ISSN 2470-6345 . Wikidata Q55120301 .
Tento článek byl převzat z následujícího zdroje pod licencí CC BY 4.0 ( 2018 ) ( zprávy recenzenta ):
Cody J Hall; Tatiana P. Soares da Costa (1. června 2018). „Lysin: biosyntéza, katabolismus a role“ (PDF) . WikiJournal of Science . 1 (1): 4. doi : 10,15347/WJS/2018.004 . ISSN 2470-6345 . Wikidata Q55120301 .