Membránový potenciál - Membrane potential

Membránový potenciál (také transmembránový potenciál nebo membránové napětí ) je rozdíl v elektrickém potenciálu mezi vnitřkem a vnějškem biologické buňky . K vnější straně buňky, typické hodnoty membránového potenciálu, obvykle v jednotkách mili voltů a označeny jako mV, rozsah od -40 mV do -80 mV.
Všechny živočišné buňky jsou obklopeny membránou složenou z lipidové dvojvrstvy s vloženými proteiny . Membrána slouží jako izolátor i jako difúzní bariéra pohybu iontů . Transmembránové proteiny , také známé jako iontový transportér nebo proteiny iontové pumpy , aktivně tlačí ionty přes membránu a vytvářejí koncentrační gradienty přes membránu a iontové kanály umožňují iontům pohyb po membráně dolů těmito koncentračními gradienty. Iontová čerpadla a iontové kanály jsou elektricky ekvivalentní sadě baterií a odporů vložených do membrány, a proto vytvářejí napětí mezi oběma stranami membrány.
Téměř všechny plazmatické membrány mají přes sebe elektrický potenciál, přičemž vnitřek je obvykle negativní vůči vnějšímu prostředí. Membránový potenciál má dvě základní funkce. Za prvé, umožňuje buňce fungovat jako baterie a poskytuje energii pro provoz různých „molekulárních zařízení“ zabudovaných v membráně. Za druhé, v elektricky excitovatelných buňkách, jako jsou neurony a svalové buňky , se používá k přenosu signálů mezi různými částmi buňky. Signály jsou generovány otevřením nebo zavřením iontových kanálů v jednom bodě membrány, což způsobuje místní změnu membránového potenciálu. Tuto změnu elektrického pole lze rychle vycítit buď sousedními nebo vzdálenějšími iontovými kanály v membráně. Tyto iontové kanály se pak mohou otevřít nebo zavřít v důsledku potenciální změny a reprodukovat signál.
V neexcitabilních buňkách a v excitovatelných buňkách v jejich výchozích stavech je membránový potenciál udržován na relativně stabilní hodnotě, nazývané klidový potenciál . Pro neurony se typické hodnoty klidového potenciálu pohybují od –70 do –80 milivoltů; to znamená, že vnitřek článku má záporné základní napětí o něco méně než jednu desetinu voltu. Otevírání a zavírání iontových kanálů může vyvolat odklon od klidového potenciálu. Toto se nazývá depolarizace, pokud se vnitřní napětí stane méně záporným (řekněme od –70 mV do –60 mV), nebo hyperpolarizací, pokud se vnitřní napětí stane zápornějším (řekněme od –70 mV do –80 mV). V excitovatelných buňkách může dostatečně velká depolarizace vyvolat akční potenciál , ve kterém se membránový potenciál na krátkou dobu (řádově 1 až 100 milisekund) rychle a výrazně mění, přičemž často dochází k obrácení jeho polarity. Akční potenciály jsou generovány aktivací určitých napěťově řízených iontových kanálů .
V neuronech jsou faktory, které ovlivňují membránový potenciál, různé. Zahrnují řadu typů iontových kanálů, z nichž některé jsou chemicky uzavřené a některé napěťově řízené. Protože napěťově řízené iontové kanály jsou řízeny membránovým potenciálem, zatímco samotný membránový potenciál je ovlivňován stejnými iontovými kanály, vznikají zpětnovazební smyčky, které umožňují komplexní dočasnou dynamiku, včetně oscilací a regeneračních událostí, jako jsou akční potenciály.
Fyzický základ
Membránový potenciál v buňce je nakonec odvozen ze dvou faktorů: elektrické síly a difúze. Elektrická síla vzniká vzájemnou přitažlivostí mezi částicemi s opačnými elektrickými náboji (kladnými a zápornými) a vzájemným odpuzováním mezi částicemi se stejným typem náboje (obě kladné nebo obě záporné). Difúze vzniká na základě statistické tendence částic redistribuovat z oblastí, kde jsou vysoce koncentrované, do oblastí, kde je koncentrace nízká.
Napětí
Napětí, které je synonymem rozdílu v elektrickém potenciálu , je schopnost pohánět elektrický proud přes odpor. Skutečně nejjednodušší definice napětí je dána Ohmovým zákonem : V = IR, kde V je napětí, I je proud a R je odpor. Pokud je zdroj napětí, jako je baterie, umístěn v elektrickém obvodu, čím vyšší je napětí zdroje, tím větší bude proud, který bude proudit přes dostupný odpor. Funkční význam napětí spočívá pouze v potenciálních rozdílech mezi dvěma body v obvodu. Myšlenka napětí v jednom bodě nemá smysl. V elektronice je obvyklé přiřadit napětí nulu k libovolnému libovolně zvolenému prvku obvodu a poté přiřadit napětí pro jiné prvky měřené vzhledem k tomuto nulovému bodu. Neexistuje žádný význam, ve kterém je prvek vybrán jako nulový bod - funkce obvodu závisí pouze na rozdílech, nikoli na napětí jako takovém . Ve většině případů a podle konvence je však nulová úroveň nejčastěji přiřazena k části obvodu, která je v kontaktu se zemí.
Stejný princip platí pro napětí v buněčné biologii. V elektricky aktivní tkáni může být potenciální rozdíl mezi libovolnými dvěma body měřen vložením elektrody do každého bodu, například jednoho uvnitř a jednoho mimo článek, a spojením obou elektrod s vodiči toho, co je v podstatě specializovaným voltmetrem. Podle konvence je hodnota nulového potenciálu přiřazena vně buňky a znaménko rozdílu potenciálu mezi vnějškem a vnitřkem je určeno potenciálem vnitřku vůči vnější nule.
Matematicky řečeno, definice napětí začíná konceptem elektrického pole E , vektorového pole, které každému bodu v prostoru přiřadí velikost a směr. V mnoha situacích je elektrické pole je konzervativní oblast , což znamená, že může být vyjádřena jako gradientem skalární funkce V , který je, E = -∇ V . Toto skalární pole V se označuje jako distribuce napětí. Všimněte si, že definice umožňuje libovolnou integrační konstantu - proto absolutní hodnoty napětí nemají smysl. Obecně lze s elektrickými poli zacházet jako s konzervativními pouze tehdy, pokud je magnetická pole významně neovlivňují, ale tato podmínka obvykle platí dobře pro biologickou tkáň.
Protože elektrické pole je gradientem distribuce napětí, rychlé změny napětí v malé oblasti znamenají silné elektrické pole; na druhou stranu, pokud napětí zůstává ve velké oblasti přibližně stejné, elektrická pole v této oblasti musí být slabá. Silné elektrické pole, ekvivalentní silnému gradientu napětí, znamená, že na jakékoli nabité částice, které leží v oblasti, působí silná síla.
Iony a síly, které řídí jejich pohyb
Elektrické signály v biologických organismech jsou obecně poháněny ionty . Nejdůležitější kationty pro akční potenciál jsou sodík (Na + ) a draslík (K + ). Oba tyto jsou monovalentní kationty, které nesou jeden kladný náboj. Akční potenciály mohou také zahrnovat vápník (Ca 2+ ), což je dvojmocný kation, který nese dvojitý kladný náboj. Chlorid anion (Cl - ) hraje hlavní roli v akčním potenciálu některých řas , ale hraje zanedbatelnou roli v akčních potenciálů většiny zvířat.
Iony procházejí buněčnou membránou pod dvěma vlivy: difúzí a elektrickými poli . Jednoduchý příklad, kde jsou dva roztoky - A a B - odděleny porézní bariérou, ukazuje, že difúze zajistí, že se nakonec smíchají do stejných roztoků. K tomuto míchání dochází kvůli rozdílu v jejich koncentracích. Oblast s vysokou koncentrací bude difundovat směrem k oblasti s nízkou koncentrací. Abychom příklad rozšířili, nechť má roztok A 30 iontů sodíku a 30 chloridových iontů. Nechejte také roztok B mít pouze 20 iontů sodíku a 20 iontů chloridu. Za předpokladu, že bariéra umožňuje oběma druhům iontů cestovat přes ni, pak bude dosaženo ustáleného stavu, kdy oba roztoky mají 25 sodíkových iontů a 25 chloridových iontů. Pokud je však porézní bariéra selektivní, do které jsou propouštěny ionty, pak samotná difúze neurčí výsledný roztok. Vrátíme -li se k předchozímu příkladu, vytvořme nyní bariéru, která je propustná pouze pro sodné ionty. Nyní pouze sodík smí difundovat přes bariéru z jeho vyšší koncentrace v roztoku A do nižší koncentrace v roztoku B. To bude mít za následek větší akumulaci sodíkových iontů než chloridových iontů v roztoku B a menší počet sodíkových iontů než chloridové ionty v roztoku A.
To znamená, že v roztoku B je čistý kladný náboj z vyšší koncentrace kladně nabitých iontů sodíku než záporně nabitých chloridových iontů. Podobně je v roztoku A čistý záporný náboj z větší koncentrace negativních chloridových iontů než kladných iontů sodíku. Protože se opačné náboje přitahují a podobné náboje odpuzují, jsou ionty nyní také ovlivněny elektrickými poli a silami difúze. Proto bude kladné ionty sodíku méně pravděpodobně cestovat do nyní pozitivnějšího roztoku B a zůstanou v nyní negativnějším roztoku A. Bod, ve kterém síly elektrických polí zcela působí proti síle způsobené difúzí, se nazývá rovnovážný potenciál. V tomto okamžiku je čistý tok specifického iontu (v tomto případě sodíku) nulový.
Plazmatické membrány

Každá buňka je uzavřena v plazmatické membráně , která má strukturu lipidové dvojvrstvy a je v ní uloženo mnoho typů velkých molekul. Protože je plazmatická membrána vyrobena z lipidových molekul, má ve své podstatě vysoký elektrický odpor, jinými slovy nízkou vnitřní propustnost pro ionty. Některé z molekul uložených v membráně jsou však schopné buď aktivně transportovat ionty z jedné strany membrány na druhou, nebo poskytovat kanály, kterými se mohou pohybovat.
V elektrické terminologii funguje plazmatická membrána jako kombinovaný odpor a kondenzátor . Odpor vzniká tím, že membrána brání pohybu nábojů po ní. Kapacita vyplývá ze skutečnosti, že lipidová dvojvrstva je tak tenká, že akumulace nabitých částic na jedné straně vede k elektrické síle, která táhne opačně nabité částice směrem k druhé straně. Kapacitní odpor membrány je relativně neovlivněn molekulami, které jsou v ní zapuštěny, takže má víceméně invariantní hodnotu odhadovanou přibližně na 2 μF/cm 2 (celková kapacita skvrny membrány je úměrná její ploše). Vodivost čisté lipidové dvojvrstvy je na druhou stranu tak nízká, že v biologických situacích vždy dominuje vodivost alternativních cest poskytovaných vloženými molekulami. Kapacitní odpor membrány je tedy víceméně pevný, ale odpor je velmi variabilní.
Tloušťka plazmatické membrány se odhaduje na přibližně 7-8 nanometrů. Protože je membrána tak tenká, nevyžaduje silné transmembránové napětí k vytvoření silného elektrického pole. Typické membránové potenciály v živočišných buňkách jsou řádově 100 milivoltů (tj. Jedna desetina voltu), ale výpočty ukazují, že toto generuje elektrické pole blízké maximu, které může membrána vydržet - bylo vypočítáno, že napětí rozdíl mnohem větší než 200 milivoltů by mohl způsobit dielektrické zhroucení , tj. oblouk přes membránu.
Usnadněná difúze a transport

Odolnost čisté lipidové dvojvrstvy vůči průchodu iontů přes ni je velmi vysoká, ale struktury vložené do membrány mohou výrazně zvýšit pohyb iontů, buď aktivně nebo pasivně , prostřednictvím mechanismů nazývaných usnadněný transport a usnadněná difúze . Dva typy struktury, které hrají největší roli, jsou iontové kanály a iontové pumpy , oba obvykle vytvořené ze soustav proteinových molekul. Iontové kanály poskytují průchody, kterými se mohou ionty pohybovat. Ve většině případů je iontový kanál propustný pouze pro určité typy iontů (například sodík a draslík, ale ne chlorid nebo vápník) a někdy se propustnost mění v závislosti na směru pohybu iontů. Iontové pumpy, známé také jako iontové transportéry nebo nosné proteiny, aktivně transportují specifické typy iontů z jedné strany membrány na druhou, někdy k tomu využívají energii získanou z metabolických procesů.
Iontové pumpy
Iontové pumpy jsou integrální membránové proteiny, které provádějí aktivní transport , tj. Využívají buněčnou energii (ATP) k „pumpování“ iontů proti jejich koncentračnímu gradientu. Takové iontové pumpy odebírají ionty z jedné strany membrány (snižují její koncentraci) a uvolňují je na druhé straně (zvyšují její koncentraci).
Iontová pumpa, která je pro akční potenciál nejrelevantnější, je pumpa sodík-draslík , která transportuje tři sodíkové ionty ven z buňky a dva ionty draslíku dovnitř. V důsledku toho je koncentrace iontů draslíku K + uvnitř neuronu zhruba 20krát vyšší větší než vnější koncentrace, zatímco vnější koncentrace sodíku je zhruba devětkrát větší než uvnitř. Podobným způsobem mají jiné ionty různé koncentrace uvnitř i vně neuronu, například vápník , chlorid a hořčík .
Pokud by byla čísla každého typu iontů stejná, pumpa sodík-draslík by byla elektricky neutrální, ale kvůli výměně tři za dva dává čistý pohyb jednoho kladného náboje z intracelulárního do extracelulárního pro každý cyklus, čímž přispívá k kladnému rozdílu napětí. Pumpa má tři účinky: (1) zvyšuje koncentraci sodíku v extracelulárním prostoru a nízkou v intracelulárním prostoru; (2) činí koncentraci draslíku vysokou v intracelulárním prostoru a nízkou v extracelulárním prostoru; (3) dává intracelulárnímu prostoru záporné napětí vzhledem k extracelulárnímu prostoru.
Čerpadlo sodno-draselné je v provozu relativně pomalé. Pokud by byla buňka inicializována všude se stejnými koncentracemi sodíku a draslíku, trvalo by hodinám, než by pumpa dosáhla rovnováhy. Čerpadlo pracuje nepřetržitě, ale postupně se stává méně účinným, protože koncentrace sodíku a draslíku dostupné pro čerpání se snižují.
Iontové pumpy ovlivňují akční potenciál pouze stanovením relativního poměru koncentrací intracelulárních a extracelulárních iontů. Akční potenciál zahrnuje hlavně otevírání a zavírání iontových kanálů, nikoli iontových pump. Pokud jsou iontová čerpadla vypnuta odstraněním jejich zdroje energie nebo přidáním inhibitoru, jako je ouabain , může axon ještě vystřelit stovky tisíc akčních potenciálů, než se jejich amplitudy začnou výrazně rozpadat. Zejména iontové pumpy nehrají významnou roli v repolarizaci membrány po akčním potenciálu.
Další funkčně důležitou iontovou pumpou je sodno-vápenatý výměník . Toto čerpadlo pracuje koncepčně podobným způsobem jako sodno-draselné čerpadlo, kromě toho, že v každém cyklu vyměňuje tři Na + z extracelulárního prostoru za jeden Ca ++ z intracelulárního prostoru. Protože čistý tok náboje je dovnitř, běží toto čerpadlo ve skutečnosti „z kopce“, a proto nevyžaduje žádný zdroj energie kromě membránového napětí. Jeho nejdůležitějším účinkem je pumpovat vápník ven-umožňuje také tok sodíku dovnitř, čímž působí proti pumpě sodíku a draslíku, ale protože celkové koncentrace sodíku a draslíku jsou mnohem vyšší než koncentrace vápníku, je tento účinek relativně nedůležité. Čistým výsledkem výměníku sodíku a vápníku je, že v klidovém stavu jsou intracelulární koncentrace vápníku velmi nízké.
Iontové kanály
Iontové kanály jsou integrální membránové proteiny s póry, kterými mohou ionty cestovat mezi extracelulárním prostorem a vnitřkem buňky. Většina kanálů je specifická (selektivní) pro jeden ion; například většina draslíkových kanálů se vyznačuje poměrem selektivity 1000: 1 pro draslík vůči sodíku, ačkoli ionty draslíku a sodíku mají stejný náboj a v poloměru se liší jen nepatrně. Pór kanálu je obvykle tak malý, že jím musí procházet ionty v pořadí jednoho souboru. Póry kanálu mohou být buď otevřené nebo uzavřené pro průchod iontů, ačkoli řada kanálů vykazuje různé úrovně subvodivosti. Když je kanál otevřený, ionty prostupují kanálem póry dolů transmembránovým koncentračním gradientem pro tento konkrétní ion. Rychlost iontového toku kanálem, tj. Jednokanálová amplituda proudu, je určena maximální vodivostí kanálu a elektrochemickou hnací silou pro tento iont, což je rozdíl mezi okamžitou hodnotou membránového potenciálu a hodnotou reverzního potenciálu .
Kanál může mít několik různých stavů (odpovídajících různým konformacím proteinu), ale každý takový stav je buď otevřený nebo uzavřený. Obecně platí, že uzavřené stavy odpovídají buď smrštění póru - čímž je pro iont neprůchodný - nebo oddělené části proteinu, která pór zazátkuje. Např. Sodíkový kanál závislý na napětí prochází inaktivací , při které se část proteinu otočí do póru a utěsní jej. Tato deaktivace vypne sodíkový proud a hraje klíčovou roli v akčním potenciálu.
Iontové kanály lze klasifikovat podle toho, jak reagují na své prostředí. Například iontové kanály zapojené do akčního potenciálu jsou kanály citlivé na napětí ; otvírají a zavírají se v reakci na napětí přes membránu. Ligandové brány tvoří další důležitou třídu; tyto iontové kanály se otevírají a zavírají v reakci na vazbu molekuly ligandu , jako je neurotransmiter . Ostatní iontové kanály se otevírají a zavírají mechanickými silami. Ještě další iontové kanály - například senzorické neurony - se otevírají a zavírají v reakci na jiné podněty, jako je světlo, teplota nebo tlak.
Netěsné kanály
Svodové kanály jsou nejjednodušším typem iontového kanálu v tom, že jejich propustnost je víceméně konstantní. Druhy únikových kanálů, které mají v neuronech největší význam, jsou draslíkové a chloridové kanály. Ani ty nejsou ve svých vlastnostech zcela konstantní: Za prvé, většina z nich je závislá na napětí v tom smyslu, že v jednom směru vedou lépe než ve druhém (jinými slovy, jsou to usměrňovače ); za druhé, některé z nich je možné uzavřít chemickými ligandy, přestože ke své činnosti ligandy nevyžadují.
Kanálové brány
Ligandem řízené iontové kanály jsou kanály, jejichž propustnost je značně zvýšena, když se nějaký typ chemického ligandu váže na proteinovou strukturu. Živočišné buňky obsahují stovky, ne -li tisíce, jejich typů. Velká podskupina funguje jako receptory neurotransmiterů - vyskytují se na postsynaptických místech a chemický ligand, který je brání, se uvolňuje presynaptickým axonovým terminálem . Jedním příkladem tohoto typu je AMPA receptor , receptor pro glutamát neurotransmiteru, který po aktivaci umožňuje průchod iontů sodíku a draslíku. Dalším příkladem je GABA receptor , receptor pro neurotransmiteru GABA , která, když je aktivována umožňuje průchod chloridových iontů.
Receptory neurotransmiterů jsou aktivovány ligandy, které se objevují v extracelulární oblasti, ale existují i jiné typy ligandem řízených kanálů, které jsou řízeny interakcemi na intracelulární straně.
Kanály závislé na napětí
Napěťově řízené iontové kanály , také známé jako napěťově závislé iontové kanály , jsou kanály, jejichž propustnost je ovlivněna membránovým potenciálem. Tvoří další velmi velkou skupinu, přičemž každý člen má určitou iontovou selektivitu a konkrétní závislost na napětí. Mnoho z nich je také závislých na čase-jinými slovy, nereagují okamžitě na změnu napětí, ale až po zpoždění.
Jedním z nejdůležitějších členů této skupiny je typ napěťově řízeného sodíkového kanálu, který je základem akčních potenciálů-někdy se jim říká sodíkové kanály Hodgkin-Huxley, protože je původně charakterizovali Alan Lloyd Hodgkin a Andrew Huxley při získávání Nobelovy ceny. studie fyziologie akčního potenciálu. Kanál je uzavřen na klidové úrovni napětí, ale náhle se otevře, když napětí překročí určitou prahovou hodnotu, což umožňuje velký příliv sodíkových iontů, který produkuje velmi rychlou změnu membránového potenciálu. Zotavení z akčního potenciálu je částečně závislé na typu napěťově řízeného draslíkového kanálu, který je uzavřen na úrovni klidového napětí, ale otevírá se v důsledku velké změny napětí vzniklé během akčního potenciálu.
Reverzní potenciál
Potenciální zvrat (nebo rovnovážný potenciál ) iontu je hodnota transmembránového napětí, při kterém difuzní a elektrické síly protiváha, takže není čistý iontový tok přes membránu. To znamená, že transmembránové napětí přesně oponuje síle difúze iontu, takže čistý proud iontu přes membránu je nulový a neměnný. Reverzní potenciál je důležitý, protože dává napětí, které působí na kanály propustné pro tento iont - jinými slovy, dává napětí, které gradient koncentrace iontů generuje, když funguje jako baterie .
Rovnovážný potenciál konkrétního iontu je obvykle označen iontem notace E. Rovnovážný potenciál pro jakýkoli ion lze vypočítat pomocí Nernstovy rovnice . Například potenciál reverze pro ionty draslíku bude následující:
kde
- E ekvivalenty, K + je rovnovážná potenciál pro draslík, měřeno ve voltech
- R je univerzální plynová konstanta rovná 8 314 joulů · K −1 · mol −1
- T je absolutní teplota měřená v kelvinech (= K = stupně Celsia + 273,15)
- z je počet elementárních nábojů dotyčného iontu zapojeného do reakce
- F je Faradayova konstanta , rovná se 96 485 coulombům · mol −1 nebo J · V −1 · mol −1
- [K + ] o je extracelulární koncentrace draslíku měřená v mol · m −3 nebo mmol·l −1
- [K + ] i je intracelulární koncentrace draslíku
I když mají dva různé ionty stejný náboj (tj. K + a Na + ), mohou mít stále velmi rozdílné rovnovážné potenciály za předpokladu, že se jejich vnější a/nebo vnitřní koncentrace liší. Vezměme si například rovnovážný potenciál draslíku a sodíku v neuronech. Potenciál rovnováhy draslíku E K je −84 mV s 5 mM draslíku venku a 140 mM uvnitř. Na druhé straně je potenciál rovnováhy sodíku, E Na , přibližně +66 mV s přibližně 12 mM sodíku uvnitř a 140 mM venku.
Změny membránového potenciálu během vývoje
Neuron je klidový membránový potenciál ve skutečnosti mění v průběhu vývoje organismu. Aby neuron nakonec přijal svou plnou funkci pro dospělé, musí být jeho potenciál během vývoje přísně regulován. Jak organismus postupuje vývojem, potenciál klidové membrány se stává negativnějším. Gliové buňky se také diferencují a množí, jak vývoj pokračuje v mozku . Přidání těchto gliových buněk zvyšuje schopnost organismu regulovat extracelulární draslík . Pokles extracelulárního draslíku může vést ke snížení membránového potenciálu o 35 mV.
Buňková excitabilita
Buňková excitabilita je změna membránového potenciálu, která je nezbytná pro buněčné reakce v různých tkáních. Buňková excitabilita je vlastnost, která je indukována během rané embriogeneze. Vzrušitelnost buňky byla také definována jako snadnost, s jakou může být spuštěna reakce. Klidový a prahový potenciál tvoří základ excitability buněk a tyto procesy jsou zásadní pro generování odstupňovaných a akčních potenciálů.
Nejdůležitějšími regulátory excitability buněk jsou koncentrace extracelulárních elektrolytů (tj. Na + , K + , Ca 2+ , Cl - , Mg 2+ ) a přidružené proteiny. Důležité proteinů, které regulují buněčný vzrušivost jsou iontové kanály napěťově řízené , iontové transportéry (např Na + / K + ATPázy , transportéry hořčíku , acidobazické transportéry ), membránové receptory a hyperpolarizace aktivované cyklické nukleotidové-řízené kanály . Například draslíkové kanály a receptory snímající vápník jsou důležitými regulátory excitability v neuronech , srdečních myocytech a mnoha dalších excitabilních buňkách, jako jsou astrocyty . Vápenatý iont je také nejdůležitějším druhým poslem v excitovatelné buněčné signalizaci . Aktivace synaptických receptorů iniciuje dlouhodobé změny v excitabilitě neuronů. Štítná žláza , nadledviny a další hormony také regulují excitabilitu buněk, například progesteron a estrogen modulují excitabilitu buněk hladkého svalstva myometria .
Mnoho typů buněk je považováno za excitabilní membránu. Excitovatelné buňky jsou neurony, myocyty (srdeční, kosterní, hladké ), vaskulární endoteliální buňky , pericyty , juxtaglomerulární buňky , intersticiální buňky Cajalu , mnoho typů epiteliálních buněk (např. Beta buňky , alfa buňky , delta buňky , enteroendokrinní buňky , plicní neuroendokrinní buňky , pinealocyty ), gliové buňky (např. astrocyty), mechanoreceptorové buňky (např. vláskové buňky a Merkelovy buňky ), chemoreceptorové buňky (např. glomusové buňky , chuťové receptory ), některé rostlinné buňky a případně imunitní buňky . Astrocyty vykazují formu neelektrické excitability na základě intracelulárních variací vápníku souvisejících s expresí několika receptorů, pomocí kterých mohou detekovat synaptický signál. V neuronech existují v některých částech buňky různé membránové vlastnosti, například dendritická excitabilita dodává neuronům schopnost detekce koincidence prostorově oddělených vstupů.
Ekvivalentní obvod
Elektrofyziologové modelují účinky rozdílů iontových koncentrací, iontových kanálů a membránové kapacity na základě ekvivalentního obvodu , který má reprezentovat elektrické vlastnosti malé části membrány. Ekvivalentní obvod se skládá z kondenzátoru paralelně se čtyřmi cestami, z nichž každý se skládá z baterie v sérii s proměnnou vodivostí. Kapacitní odpor je určen vlastnostmi lipidové dvojvrstvy a považuje se za pevný. Každá ze čtyř paralelních drah pochází z jednoho z hlavních iontů, sodíku, draslíku, chloridu a vápníku. Napětí každé iontové dráhy je určeno koncentracemi iontu na každé straně membrány; viz výše část Potenciál obrácení . Vodivost každé iontové dráhy v jakémkoli časovém okamžiku je určena stavy všech iontových kanálů, které jsou potenciálně pro tento ion propustné, včetně únikových kanálů, kanálů s ligandovou branou a napěťově řízených iontových kanálů.

Pro pevné koncentrace iontů a pevné hodnoty vodivosti iontového kanálu lze ekvivalentní obvod dále redukovat pomocí Goldmanovy rovnice, jak je popsáno níže, na obvod obsahující kapacitu paralelně s baterií a vodivostí. Z elektrického hlediska se jedná o typ RC obvodu (odpor-kapacitní obvod) a jeho elektrické vlastnosti jsou velmi jednoduché. Počínaje jakýmkoli počátečním stavem se proud tekoucí buď přes vodivost, nebo kapacitní rozkládá s exponenciálním časovým průběhem, s časovou konstantou τ = RC , kde C je kapacita membránové záplaty a R = 1/g síť je čistý odpor. U realistických situací se časová konstanta obvykle pohybuje v rozmezí 1–100 milisekund. Ve většině případů dochází ke změnám vodivosti iontových kanálů v rychlejším časovém měřítku, takže RC obvod není dobrou aproximací; diferenciální rovnice používaná k modelování membránové záplaty je však běžně upravenou verzí rovnice RC obvodu.
Klidový potenciál
Když membránový potenciál buňky trvá dlouhou dobu, aniž by se výrazně měnil, je označován jako klidový potenciál nebo klidové napětí. Tento termín se používá pro membránový potenciál neexcitabilních buněk, ale také pro membránový potenciál excitovatelných buněk bez excitace. V excitovatelných buňkách jsou dalšími možnými stavy odstupňované membránové potenciály (s proměnnou amplitudou) a akční potenciály, které jsou velké, v membránovém potenciálu stoupá vše nebo nic, které obvykle sledují pevný časový průběh. Mezi excitovatelné buňky patří neurony , svalové buňky a některé sekreční buňky ve žlázách . I v jiných typech buněk však může membránové napětí podléhat změnám v reakci na environmentální nebo intracelulární podněty. Například depolarizace plazmatické membrány se zdá být důležitým krokem v programované buněčné smrti .
Interakce, které generují klidový potenciál, jsou modelovány podle Goldmanovy rovnice . Tato forma je podobná výše uvedené Nernstově rovnici v tom, že je založena na nábojích dotyčných iontů a rozdílu mezi jejich vnitřní a vnější koncentrací. Zohledňuje však také relativní propustnost plazmatické membrány pro každý dotyčný iont.
Tři ionty, které se objevují v této rovnici, jsou draslík (K + ), sodík (Na + ) a chlorid (Cl - ). Vápník je vynechán, ale může být přidán k řešení situací, ve kterých hraje významnou roli. Protože jsou anionty, s chloridovými termíny se zachází odlišně než s kationtovými termíny; intracelulární koncentrace je v čitateli a extracelulární koncentrace ve jmenovateli, který je obrácen od kationtových pojmů. P i znamená relativní propustnost iontového typu i.
Goldmanův vzorec v podstatě vyjadřuje membránový potenciál jako vážený průměr reverzních potenciálů pro jednotlivé typy iontů vážený propustností. (Přestože se membránový potenciál během akčního potenciálu mění asi o 100 mV, koncentrace iontů uvnitř a vně buňky se významně nemění. Zůstávají blízko svých příslušných koncentrací, když je pak membrána v klidovém potenciálu.) Ve většině živočišných buněk je propustnost pro draslík je v klidovém stavu mnohem vyšší než propustnost pro sodík. V důsledku toho je klidový potenciál obvykle blízký potenciálu reverze draslíku. Propustnost pro chlorid může být dostatečně vysoká, aby byla významná, ale na rozdíl od ostatních iontů není chlorid aktivně čerpán, a proto ekvilibruje s reverzním potenciálem velmi blízkým klidovému potenciálu určenému ostatními ionty.
Hodnoty klidového membránového potenciálu ve většině zvířecích buněk se obvykle pohybují mezi potenciálem reverzace draslíku (obvykle kolem -80 mV) a kolem -40 mV. Klidový potenciál v excitovatelných buňkách (schopných vytvářet akční potenciály) je obvykle blízko -60 mV -více depolarizovaných napětí by vedlo k spontánní generaci akčních potenciálů. Nezralé nebo nediferencované články vykazují vysoce variabilní hodnoty klidového napětí, obvykle výrazně pozitivnější než v diferencovaných článcích. V takových článcích hodnota klidového potenciálu koreluje se stupněm diferenciace: nediferencované články v některých případech nemusí vykazovat vůbec žádný transmembránový rozdíl napětí.
Údržba klidového potenciálu může být pro buňku metabolicky nákladná kvůli jejímu požadavku na aktivní čerpání iontů proti ztrátám způsobeným únikovými kanály. Náklady jsou nejvyšší, když funkce článku vyžaduje zvláště depolarizovanou hodnotu membránového napětí. Například klidový potenciál fotoreceptorů blowfly ( Calliphora vicina ) přizpůsobených dennímu světlu může dosahovat až -30 mV. Tento zvýšený membránový potenciál umožňuje buňkám velmi rychle reagovat na vizuální vstupy; náklady jsou, že udržování klidového potenciálu může spotřebovat více než 20% celkového buněčného ATP .
Na druhou stranu vysoký klidový potenciál v nediferencovaných buňkách nemusí nutně znamenat vysoké metabolické náklady. Tento zjevný paradox je vyřešen zkoumáním původu tohoto klidového potenciálu. Málo diferencované buňky se vyznačují extrémně vysokým vstupním odporem, což znamená, že v této fázi života buněk je přítomno jen málo svodových kanálů. Jako zjevný výsledek se propustnost draslíku stává podobnou jako u sodíkových iontů, což klade klidový potenciál mezi reverzní potenciály pro sodík a draslík, jak bylo diskutováno výše. Snížené svodové proudy také znamenají, že je malá potřeba aktivního čerpání za účelem kompenzace, tedy nízkých metabolických nákladů.
Vyrovnané potenciály
Jak je vysvětleno výše, potenciál v kterémkoli bodě buněčné membrány je určen rozdíly v koncentraci iontů mezi intracelulárními a extracelulárními oblastmi a propustností membrány pro každý typ iontu. Koncentrace iontů se obvykle nemění příliš rychle (s výjimkou Ca 2+ , kde je základní intracelulární koncentrace tak nízká, že i malý příliv ji může zvýšit řádově), ale permeabilita iontů se může změnit za zlomek milisekundy, v důsledku aktivace ligandem řízených iontových kanálů. Změna membránového potenciálu může být buď velká nebo malá, v závislosti na tom, kolik iontových kanálů je aktivováno a o jaký typ se jedná, a může být buď dlouhá, nebo krátká, v závislosti na době, po kterou kanály zůstávají otevřené. Změny tohoto typu se označují jako gradované potenciály , na rozdíl od akčních potenciálů, které mají pevnou amplitudu a časový průběh.
Jak lze odvodit z výše uvedené Goldmanovy rovnice , účinek zvýšení propustnosti membrány na konkrétní typ iontu posouvá membránový potenciál směrem k reverznímu potenciálu pro tento iont. Otevření kanálů Na + tedy posouvá membránový potenciál směrem k reverznímu potenciálu Na + , který je obvykle kolem +100 mV. Stejně tak otevírací K + kanálů posune membránový potenciál k asi -90 mV, a otevírací Cl - kanály posouvá směrem asi -70 mV (klidový potenciál membrán většiny). Tak, Na + kanálů posune membránový potenciál v pozitivním směru, K + kanály posunout jej ve směru záporné (kromě případů, kdy je membrána Hyperpolarizované na hodnotu negativnější než K + reverzní potenciál), a Cl - kanály mají tendenci posunu směrem k klidovému potenciálu.
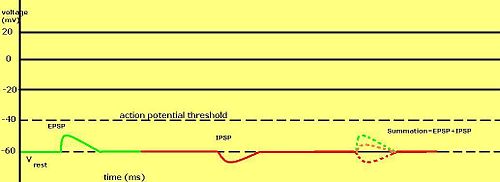
Odstupňované membránové potenciály jsou zvláště důležité v neuronech , kde jsou produkovány synapsemi - dočasná změna membránového potenciálu produkovaná aktivací synapsí jediným odstupňovaným nebo akčním potenciálem se nazývá postsynaptický potenciál . Neurotransmitery, které působí k otevření kanálů Na +, obvykle způsobí, že se membránový potenciál stane pozitivnějším, zatímco neurotransmitery, které aktivují K + kanály, obvykle způsobí, že se stane negativnějším; ty, které tyto kanály inhibují, mívají opačný účinek.
Zda je postsynaptický potenciál považován za excitační nebo inhibiční, závisí na reverzním potenciálu pro ionty tohoto proudu a na prahu, kdy buňka vystřelí akční potenciál (kolem –50 mV). Postsynaptický proud s reverzním potenciálem nad prahovou hodnotou, jako je typický proud Na + , je považován za excitační. Proud s reverzním potenciálem pod prahovou hodnotou, jako je typický proud K + , je považován za inhibiční. Proud s reverzním potenciálem nad klidovým potenciálem, ale pod prahem, nebude sám o sobě vyvolávat akční potenciály, ale bude produkovat podprahové oscilace potenciálu membrány . Neurotransmitery, které působí na otevření kanálů Na +, produkují excitační postsynaptické potenciály nebo EPSP, zatímco neurotransmitery, které působí na otevření kanálů K + nebo Cl - typicky produkují inhibiční postsynaptické potenciály nebo IPSP. Když je ve stejném časovém období otevřeno více typů kanálů, jejich postsynaptické potenciály se sčítají (sečtou).
Jiné hodnoty
Z hlediska biofyziky je klidový membránový potenciál pouze membránový potenciál, který vyplývá z membránových permeabilit, které převládají, když buňka odpočívá. Vždy platí výše uvedená rovnice vážených průměrů, ale následující přístup lze snadněji zobrazit. V každém daném okamžiku existují pro iont dva faktory, které určují, jaký vliv bude mít tento ion na membránový potenciál buňky:
- Ta iontová hnací síla
- Ta iontová propustnost
Pokud je hnací síla vysoká, pak je iont „tlačen“ přes membránu. Pokud je propustnost vysoká, bude pro iont snadnější difundovat přes membránu.
- Hnací síla je čistá elektrická síla, která je k dispozici k pohybu tohoto iontu přes membránu. Vypočítá se jako rozdíl mezi napětím, na kterém „chce“ iont (jeho rovnovážný potenciál), a skutečným membránovým potenciálem ( E m ). Formálně tedy hnací síla pro ion = E m - E ion
- Například při našem dříve vypočítaném klidovém potenciálu −73 mV je hnací síla na draslík 7 mV: (−73 mV) - (−80 mV) = 7 mV. Hnací síla na sodík by byla (-73 mV) - (60 mV) = -133 mV.
- Propustnost je měřítkem toho, jak snadno může iont projít membránou. Normálně se měří jako (elektrická) vodivost a jednotka siemens odpovídá 1 C · s −1 · V −1 , tj. Jeden coulomb za sekundu na volt potenciálu.
Takže v klidové membráně je hnací síla draslíku nízká, ale jeho propustnost je velmi vysoká. Sodík má obrovskou hnací sílu, ale téměř žádnou klidovou propustnost. V tomto případě, draslík nese asi 20 krát více proudu než sodík, a má tedy 20 krát větší vliv na E m , než je tomu sodíku.
Zvažte však další případ - vrchol akčního potenciálu. Zde je propustnost pro Na vysoká a K propustnost je relativně nízká. To znamená, že membrána se pohybuje do blízkosti E Na a daleko od E K .
Čím více iontů je propustných, tím složitější je předpovídat membránový potenciál. To však lze provést pomocí rovnice Goldman-Hodgkin-Katz nebo rovnice vážených průměrů. Zapojením koncentračních gradientů a propustností iontů v každém okamžiku lze určit membránový potenciál v daném okamžiku. Rovnice GHK znamenají, že kdykoli bude hodnota membránového potenciálu váženým průměrem rovnovážných potenciálů všech prostupujících iontů. "Váha" je relativní propustnost iontů přes membránu.
Účinky a důsledky
Buňky vynakládají energii na transport iontů a vytvářejí transmembránový potenciál, ale využívají tento potenciál k přepravě dalších iontů a metabolitů, jako je cukr. Transmembránový potenciál mitochondrií pohání produkci ATP , což je společná měna biologické energie.
Buňky mohou čerpat energii uloženou v klidovém potenciálu, aby poháněly akční potenciály nebo jiné formy vzrušení. Tyto změny membránového potenciálu umožňují komunikaci s jinými buňkami (jako u akčních potenciálů), nebo iniciovat změny uvnitř buňky, který se stane ve vejci , když je oplodněné pomocí spermií .
V neuronálních buňkách akční potenciál začíná spěchem sodíkových iontů do buňky přes sodíkové kanály, což má za následek depolarizaci, zatímco obnova zahrnuje vnější spěch draslíku draselnými kanály. Oba tyto toky vznikají pasivní difúzí .
Viz také
- Bioelektrochemie
- Elektrochemický potenciál
- Goldmanova rovnice
- Membránová biofyzika
- Pole mikroelektrod
- Slané vedení
- Povrchový potenciál
- Gibbsův -Donnanův efekt
- Synaptický potenciál
Poznámky
- ^ Všimněte si, že znaky E Na a E K jsou opačné. Důvodem je, že koncentrační gradient pro draslík je směrován ven z buňky, zatímco koncentrační gradient pro sodík je směrován do buňky. Membránové potenciály jsou definovány vzhledem k exteriéru buňky; potenciál -70 mV tedy znamená, že vnitřek buňky je záporný vzhledem k exteriéru.
Reference
Další čtení
- Alberts a kol. Molekulární biologie buňky . Garland Publishing; 4. vydání Bk & Cdr (březen 2002). ISBN 0-8153-3218-1 . Pregraduální úroveň.
- Guyton, Arthur C., John E. Hall. Učebnice lékařské fyziologie . WB Saunders Company; 10. vydání (15. srpna 2000). ISBN 0-7216-8677-X . Pregraduální úroveň.
- Hille, B. Ionic Channel of Excitable Membranes Sinauer Associates, Sunderland, MA, USA; 1. vydání, 1984. ISBN 0-87893-322-0
- Nicholls, JG, Martin, AR a Wallace, BG Od Neuronu k Brain Sinauer Associates, Inc. Sunderland, MA, USA, 3. vydání, 1992. ISBN 0-87893-580-0
- Ove-Sten Knudsen. Biologické membrány: teorie dopravy, potenciály a elektrické impulsy . Cambridge University Press (26. září 2002). ISBN 0-521-81018-3 . Úroveň absolventa.
- Národní lékařská řada pro nezávislou studii. Fyziologie . Lippincott Williams & Wilkins. Philadelphia, PA, USA 4. vydání, 2001. ISBN 0-683-30603-0







![E_ {eq, K^+} = \ frac {RT} {zF} \ ln \ frac {[K^+] _ {o}} {[K^+] _ {i}},](https://wikimedia.org/api/rest_v1/media/math/render/svg/b7eb1afcc5d7a5032ff24be5c403b43b1307b01e)

![E_ {m} = \ frac {RT} {F} \ ln {\ left (\ frac {P _ {\ mathrm {K}} [\ mathrm {K}^{ +}] _ \ mathrm {out} + P_ { \ mathrm {Na}} [\ mathrm {Na}^{ +}] _ \ mathrm {out} + P _ {\ mathrm {Cl}} [\ mathrm {Cl}^{-}] _ \ mathrm {in}} {P _ {\ mathrm {K}} [\ mathrm {K}^{+}] _ \ mathrm {in}+P _ {\ mathrm {Na}} [\ mathrm {Na}^{+}] _ \ mathrm { in} + P _ {\ mathrm {Cl}} [\ mathrm {Cl}^{-}] _ \ mathrm {out}} \ right)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/4b29151571b6fb807674bf342d01f178908a1a98)