Morfin - Morphine
 | |
 | |
| Klinické údaje | |
|---|---|
| Výslovnost | / M oʊ r f jsem n / |
| Obchodní názvy | Statex, MSContin, Oramorph, Sevredol a další |
| AHFS / Drugs.com | Monografie |
Kategorie těhotenství |
|
Odpovědnost za závislost |
Vysoký |
Odpovědnost za závislost |
Vysoký |
| Cesty podání |
Inhalace ( kouření ), insuflace (smrkání), ústy (PO), rektální , subkutánní (SC), intramuskulární (IM), intravenózní (IV), epidurální a intratekální (IT) |
| Třída drog | opioidní |
| ATC kód | |
| Právní status | |
| Právní status | |
| Farmakokinetické údaje | |
| Biologická dostupnost | 20–40% (ústy), 36–71% (rektálně), 100% (IV/IM) |
| Vazba na bílkoviny | 30–40% |
| Metabolismus | Jaterní 90% |
| Nástup akce | 5 minut (IV), 15 minut (IM), 20 minut (PO) |
| Poločas eliminace | 2–3 hodiny |
| Doba působení | 3–7 hodin |
| Vylučování | Renální 90%, biliární 10% |
| Identifikátory | |
| |
| Číslo CAS | |
| PubChem CID | |
| IUPHAR/BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| KEGG | |
| ČEBI | |
| CHEMBL | |
| PDB ligand | |
| CompTox Dashboard ( EPA ) | |
| Informační karta ECHA |
100 000,291 |
| Chemická a fyzikální data | |
| Vzorec | C 17 H 19 N O 3 |
| Molární hmotnost | 285,343 g · mol −1 |
| 3D model ( JSmol ) | |
| Rozpustnost ve vodě | HCl & sulf .: 60 mg/ml (20 ° C) |
| |
| |
| (ověřit) | |
Morfin je lék na bolest z rodiny opiátů, který se přirozeně nachází v tmavě hnědé pryskyřičné formě z rostliny máku ( Papaver somniferum ). Může být užíván orálně nebo injekčně; také se často kouří. Působí přímo na centrální nervový systém (CNS), zvyšuje pocity rozkoše a teplé relaxace a snižuje bolest, a často je k tomuto účelu zneužíván. Může být užíván jak pro akutní bolest, tak pro chronickou bolest a často se používá pro bolesti z infarktu myokardu , ledvinových kamenů a během porodu . Morfin lze podávat ústy, injekcí do svalu , injekcí pod kůži , intravenózně , injekcí do prostoru kolem míchy nebo rektálně . Jeho maximálního účinku je dosaženo po asi 20 minutách při intravenózním podání a 60 minutách při podání ústy, přičemž doba účinku je 3–7 hodin. Dlouhodobě působící formulace morfinu jsou k dispozici jako MS-Contin, Kadian a další značky, stejně jako genericky.
Mezi potenciálně závažné vedlejší účinky morfinu patří snížené dýchací úsilí, zvracení , nevolnost a nízký krevní tlak . Morfin je návykový a náchylný ke zneužívání . Pokud se po dlouhodobém užívání sníží dávka, mohou se objevit abstinenční příznaky opioidů . Mezi časté nežádoucí účinky morfinu patří ospalost, zvracení a zácpa. Při užívání morfinu během těhotenství nebo kojení se doporučuje opatrnost , protože může ovlivnit zdraví dítěte.
Morfin byl poprvé izolován v letech 1803 až 1805 německým lékárníkem Friedrichem Sertürnerem . Toto je obecně považováno za první izolaci aktivní složky z rostliny. Společnost Merck ji začala komerčně prodávat v roce 1827. Morfin byl široce používán po vynálezu injekční stříkačky v letech 1853–1855. Sertürner původně pojmenoval látku morfium podle řeckého boha snů Morpheus , protože má tendenci způsobovat spánek.
Primárním zdrojem morfinu je izolace z máku z máku setého . V roce 2013 bylo vyrobeno přibližně 523 tun morfinu. Přibližně 45 tun bylo použito přímo na bolest, což je nárůst o více než 400% za posledních dvacet let. Většina použití pro tento účel byla v rozvinutém světě . Asi 70 procent morfinu se používá k výrobě dalších opioidů, jako je hydromorfon , oxymorfon a heroin . Je to droga Schedule II ve Spojených státech , třída A ve Spojeném království a Schedule I v Kanadě . Je na seznamu základních léků Světové zdravotnické organizace . Morfin se prodává pod mnoha obchodními názvy . V roce 2018 to byl 132. nejčastěji předepisovaný lék ve Spojených státech s více než 5 miliony předpisů.
Lékařské využití
Bolest
Morfin se používá především k léčbě akutní i chronické silné bolesti . Trvání analgezie je asi tři až sedm hodin. Vedlejší účinky nevolnosti a zácpy jsou zřídka natolik závažné, že by to vyžadovalo ukončení léčby.
Používá se při bolestech způsobených infarktem myokardu a při porodních bolestech. Existují však obavy, že morfin může zvýšit úmrtnost v případě infarktu myokardu bez elevace ST . Morfin se také tradičně používá při léčbě akutního plicního edému . Přezkum z roku 2006 však našel jen málo důkazů na podporu této praxe. Přezkum Cochrane z roku 2016 dospěl k závěru, že morfin je účinný při zmírnění bolesti způsobené rakovinou.
Dušnost
Morfin je prospěšný při snižování příznaků dušnosti způsobených rakovinovými i nerakovinnými příčinami. V prostředí dušnosti v klidu nebo při minimální námaze z podmínek, jako je pokročilá rakovina nebo terminální kardiorespirační onemocnění, pravidelný nízkodávkovaný morfin s prodlouženým uvolňováním významně bezpečně snižuje dušnost, přičemž jeho výhody jsou zachovány v průběhu času.
Porucha užívání opioidů
Morfin je také k dispozici jako formulace s pomalým uvolňováním pro substituční terapii opiáty (OST) v Rakousku, Německu, Bulharsku, Slovinsku a Kanadě pro osoby se závislostí na opioidech, které nemohou tolerovat metadon ani buprenorfin .
Kontraindikace
Relativní kontraindikace morfinu zahrnují:
- respirační deprese, pokud není k dispozici vhodné vybavení
- Ačkoli se dříve předpokládalo, že morfin je kontraindikován u akutní pankreatitidy , přehled literatury pro to neprokazuje žádné důkazy.
Nepříznivé účinky
- Běžné i krátkodobé
- jiný
- Závislost na opioidech
- Závrať
- Snížená chuť na sex
- Ztráta chuti k jídlu
- Zhoršená sexuální funkce
- Snížené hladiny testosteronu
- Deprese
- Imunodeficience
- Abnormální citlivost bolesti vyvolaná opioidy
- Nepravidelná menstruace
- Zvýšené riziko pádů
- Zpomalené dýchání
- Halucinace
Zácpa
Stejně jako loperamid a jiné opioidy působí morfin na myenterický plexus ve střevním traktu, snižuje motilitu střeva a způsobuje zácpu. Gastrointestinální účinky morfinu jsou zprostředkovány především μ-opioidními receptory ve střevě. Inhibicí vyprazdňování žaludku a snížením propulzivní peristaltiky střeva snižuje morfin rychlost střevního tranzitu. Snížení sekrece střeva a zvýšená absorpce střevních tekutin také přispívají k zácpě. Opioidy mohou také působit na střevo nepřímo prostřednictvím tonických střevních křečí po inhibici tvorby oxidu dusnatého . Tento účinek byl prokázán u zvířat, když prekurzor oxidu dusnatého, L-arginin , zvrátil změny střevní motility vyvolané morfinem.
Hormonální nerovnováha
Klinické studie důsledně dospěly k závěru, že morfin, stejně jako jiné opioidy, často způsobuje hypogonadismus a hormonální nerovnováhu u chronických uživatelů obou pohlaví. Tento vedlejší účinek je závislý na dávce a vyskytuje se jak u terapeutických, tak u rekreačních uživatelů. Morfin může interferovat s menstruací u žen potlačením hladin luteinizačního hormonu . Mnoho studií naznačuje, že většina (možná až 90%) uživatelů chronických opioidů má hypogonadismus způsobený opioidy. Tento účinek může způsobit zvýšenou pravděpodobnost osteoporózy a zlomenin kostí pozorovaných u chronických uživatelů morfinu. Studie naznačují, že účinek je dočasný. Od roku 2013 je účinek nízkých dávek nebo akutního používání morfinu na endokrinní systém nejasný.
Účinky na lidskou výkonnost
Většina recenzí dospěla k závěru, že opioidy způsobují minimální zhoršení lidské výkonnosti při testech senzorických, motorických nebo pozorovacích schopností. Nedávné studie však dokázaly ukázat některá poškození způsobená morfinem, což není překvapující, vzhledem k tomu, že morfin je depresivní pro centrální nervový systém . Morfin má za následek zhoršené fungování na kritické frekvenci blikání (měřítko celkového vzrušení CNS) a zhoršený výkon při testu křídla Maddox (míra odchylky zrakových os očí). Několik studií zkoumalo účinky morfinu na motorické schopnosti; vysoká dávka morfinu může narušit poklepávání prstem a schopnost udržovat nízkou konstantní úroveň izometrické síly (tj. je narušena kontrola jemné motoriky), ačkoli žádné studie neprokázaly korelaci mezi morfinem a hrubou motorikou.
Pokud jde o kognitivní schopnosti, jedna studie ukázala, že morfin může mít negativní dopad na anterográdní a retrográdní paměť , ale tyto efekty jsou minimální a přechodné. Celkově se zdá, že akutní dávky opioidů u netolerantních subjektů mají menší účinky na některé smyslové a motorické schopnosti a možná také na pozornost a poznávání. Je pravděpodobné, že účinky morfinu budou výraznější u subjektů dosud neužívajících opioidy než u chronických uživatelů opioidů.
U chronických uživatelů opioidů, jako jsou uživatelé chronické opioidní analgetické terapie (COAT) pro zvládání silné, chronické bolesti , prokázalo behaviorální testování ve většině případů normální fungování vnímání, poznávání, koordinace a chování. Jedna studie z roku 2000 analyzovala pacienty s COAT, aby zjistila, zda jsou schopni bezpečně řídit motorové vozidlo. Zjištění z této studie naznačují, že stabilní užívání opioidů významně nenarušuje schopnosti vlastní řízení (to zahrnuje fyzické, kognitivní a percepční schopnosti). Pacienti COAT vykazovali rychlé dokončení úkolů, které vyžadují rychlost reakce pro úspěšný výkon (např. Rey Complex Figure Test), ale dělali více chyb než kontroly. Pacienti s COAT nevykazovali žádné nedostatky ve vizuálně-prostorovém vnímání a organizaci (jak ukazuje test WAIS-R Block Design Test), ale vykazovali zhoršenou okamžitou a krátkodobou vizuální paměť (jak ukazuje Rey Complex Figure Test-Recall). Tito pacienti nevykazovali žádné poruchy kognitivních schopností vyššího řádu (tj. Plánování). Zdálo se, že pacienti s COAT mají potíže s dodržováním pokynů a projevují sklon k impulzivnímu chování, přesto to nedosáhlo statistické významnosti. Je důležité poznamenat, že tato studie odhaluje, že pacienti s COAT nemají žádné doménové specifické deficity, což podporuje představu, že chronické užívání opioidů má menší vliv na psychomotorické , kognitivní nebo neuropsychologické fungování.
Poruchy výztuže
Závislost
Morfin je vysoce návyková látka. V kontrolovaných studiích porovnávajících fyziologické a subjektivní účinky heroinu a morfinu u jedinců dříve závislých na opiátech subjekty nevykazovaly žádnou preferenci jedné drogy před druhou. Ekvipotentní injekční dávky měly srovnatelné akční kurzy, bez rozdílu v sebehodnocených pocitech euforie, ambicí, nervozity, relaxace, ospalosti nebo ospalosti. Krátkodobé studie závislosti stejných vědců prokázaly, že tolerance se vyvíjela podobným tempem jako u heroinu a morfinu. Ve srovnání s opioidy hydromorfonem , fentanylem , oxykodonem a pethidinem / meperidinem vykazovali bývalí závislí silnou preferenci pro heroin a morfin, což naznačuje, že heroin a morfin jsou obzvláště náchylné k zneužívání a závislosti. Ve srovnání s těmito jinými opioidy také morfin a heroin mnohem pravděpodobněji vyvolávaly euforii a další pozitivní subjektivní efekty. Volba heroinu a morfinu před jinými opioidy bývalými drogově závislými může být také proto, že heroin (také známý jako morfin diacetát, diamorfin nebo diacetyl morfin) je ester morfinu a morfinového prekurzoru , což v podstatě znamená, že jsou identickými drogami in vivo . Heroin se přeměňuje na morfin před vazbou na opioidní receptory v mozku a míše, kde morfin způsobuje subjektivní efekty, což je to, co závislí jedinci hledají.
Tolerance
Existuje několik hypotéz o tom, jak se vyvíjí tolerance, včetně fosforylace opioidních receptorů (která by změnila konformaci receptoru), funkční oddělení receptorů od G-proteinů (vedoucí k desenzibilizaci receptoru), internalizace μ-opioidního receptoru nebo down-regulace receptoru (snížení počet dostupných receptorů, na které může morfin působit) a upregulace dráhy cAMP (protiregulační mechanismus účinků opioidů) (Přehled těchto procesů viz Koch a Hollt.) CCK může zprostředkovat některé protiregulační cesty zodpovědné za opioidy tolerance. Bylo ukázáno, že CCK-antagonistické léky, konkrétně proglumid , zpomalují vývoj tolerance k morfinu.
Závislost a výběr
Ukončení dávkování morfinu vytváří prototypický abstinenční syndrom opioidů, který na rozdíl od barbiturátů , benzodiazepinů , alkoholu nebo sedativních hypnotik není u jinak zdravých lidí sám o sobě smrtelný.
Akutní stažení morfinu spolu s jakýmkoli jiným opioidem probíhá v několika fázích. Jiné opioidy se liší v intenzitě a délce každého a slabé opioidy a smíšené agonisty-antagonisty mohou mít akutní abstinenční syndromy, které nedosahují nejvyšší úrovně. Jak se běžně uvádí, jsou to:
- Fáze I , 6 h až 14 h po poslední dávce: touha po drogách, úzkost, podrážděnost, pocení a mírná až střední dysforie
- Stupeň II , 14 h až 18 h po poslední dávce: zívání, silné pocení, mírná deprese, slzení, pláč, bolesti hlavy, rýma, dysforie , také zesílení výše uvedených příznaků, „jenský spánek“ (stav podobný transu)
- Stupeň III , 16 h až 24 h po poslední dávce: Rhinorea (rýma) a zvýšení ostatních výše uvedených, rozšířené zornice, piloerekce (husí kůže - údajný původ výrazu „studený krocan“, ale ve skutečnosti fráze vznikly mimo léčbu drogami), svalové záškuby, návaly horka, studené záblesky, bolest kostí a svalů, ztráta chuti k jídlu a začátek střevních křečí
- Fáze IV , 24 h až 36 h po poslední dávce: Nárůst všech výše uvedených stavů včetně závažných křečí a nedobrovolných pohybů nohou („vykopnutí návyku“, kterému se také říká syndrom neklidných nohou ), řídká stolice, nespavost, zvýšení krevního tlaku, mírné zvýšení při tělesné teplotě, zvýšení frekvence dýchání a dechového objemu, tachykardie (zvýšený puls), neklid, nevolnost
- Fáze V , 36 h až 72 h po poslední dávce: Zvýšení výše uvedené polohy plodu, zvracení, volný a častý tekutý průjem, který někdy může urychlit čas přechodu jídla z úst do systému ven, ztráta hmotnosti 2 kg na 5 kg za 24 hodin, zvýšený počet bílých krvinek a další krevní změny
- Fáze VI , po dokončení výše uvedeného: Obnova chuti k jídlu a normální funkce střev, začátek přechodu na postakutní a chronické příznaky, které jsou převážně psychologické, ale mohou také zahrnovat zvýšenou citlivost na bolest, hypertenzi, kolitidu nebo jiné gastrointestinální potíže související s pohyblivostí a problémy s kontrolou hmotnosti v obou směrech
V pokročilých stadiích abstinence byl u některých pacientů prokázán ultrasonografický důkaz pankreatitidy, který je pravděpodobně přičítán křeči pankreatického Oddiho svěrače .
Abstinenční příznaky spojené se závislostí na morfinu se obvykle vyskytují krátce před časem další plánované dávky, někdy během několika hodin (obvykle 6 h až 12 h) po posledním podání. Počáteční příznaky zahrnují slzení očí, nespavost, průjem, rýmu, zívání, dysforii , pocení a v některých případech silnou touhu po drogách. S postupujícím syndromem se objevuje silná bolest hlavy, neklid, podrážděnost, ztráta chuti k jídlu, bolesti těla, silné bolesti břicha, nevolnost a zvracení, třes a ještě silnější a intenzivnější touha po drogách. Těžká deprese a zvracení jsou velmi časté. Během období akutní abstinence se zvyšuje systolický a diastolický krevní tlak, obvykle nad úroveň premorfinu, a zvyšuje se srdeční frekvence, což může způsobit srdeční infarkt, krevní sraženinu nebo cévní mozkovou příhodu.
Charakteristickými příznaky jsou také zimnice nebo návaly zimy s husími hrbolky („ studený krocan “) střídající se se zrudnutím (návaly horka), kopacími pohyby nohou („vykopnutím návyku“) a nadměrným pocením. Objevují se silné bolesti kostí a svalů zad a končetin, stejně jako svalové křeče. V kterémkoli bodě tohoto procesu lze podat vhodné narkotikum, které dramaticky zvrátí abstinenční příznaky. Hlavní abstinenční příznaky vrcholí mezi 48 a 96 hodinami po poslední dávce a odezní po přibližně 8 až 12 dnech. Náhlé stažení silně závislých uživatelů se špatným zdravotním stavem je jen zřídka fatální. Odnětí morfinu je považováno za méně nebezpečné než stažení alkoholu, barbiturátu nebo benzodiazepinů.
Psychologická závislost spojená se závislostí na morfinu je složitá a vleklá. Dlouho poté, co fyzická potřeba morfinu pominula, bude závislý obvykle nadále přemýšlet a mluvit o užívání morfinu (nebo jiných drog) a bude se cítit divně nebo zdrcen při zvládání každodenních aktivit, aniž by byl pod vlivem morfinu. Psychologické stažení z morfinu je obvykle velmi dlouhý a bolestivý proces. Závislí často trpí těžkou depresí, úzkostí, nespavostí, změnami nálad, amnézií (zapomnětlivostí), nízkým sebevědomím, zmateností, paranoiou a dalšími psychickými poruchami. Bez intervence syndrom poběží a většina zjevných fyzických symptomů zmizí do 7 až 10 dnů včetně psychické závislosti. Vysoká pravděpodobnost relapsu existuje po vysazení morfinu, pokud nebylo změněno fyzické prostředí ani behaviorální motivátory, které k zneužívání přispěly. Svědectvím návykové a posilující povahy morfinu je míra relapsu. Uživatelé zneužívající morfin (a heroin) mají jednu z nejvyšších relapsů mezi všemi uživateli drog, podle odhadů některých lékařských odborníků až 98%.
Toxicita
| Vlastnosti morfinu | |||||
|---|---|---|---|---|---|
| Molární hmotnost | 285,338 g/mol | ||||
| Kyselost (p K a ) |
|
||||
| Rozpustnost | 0,15 g/l při 20 ° C | ||||
| Bod tání | 255 ° C | ||||
| Bod varu | 190 ° C sublimuje | ||||
Velké předávkování může způsobit udušení a smrt respirační depresí, pokud se člověku okamžitě nedostane lékařské pomoci. Léčba předávkování zahrnuje podávání naloxonu . Ten úplně zvrátí účinky morfinu, ale u subjektů závislých na opiátech může vést k okamžitému nástupu stažení. Může být zapotřebí více dávek, protože účinek morfinu je delší než naloxonu.
LD 50 pro člověka morfinsulfátu a dalších přípravků není s jistotou znám. Jedna studie špatné kvality předávkování morfinem mezi vojáky uvádí, že smrtelná dávka byla 0,78 mcg/ml u mužů (~ 71 mg pro průměrně 90 kg dospělého muže) a 0,98 mcg/ml u žen (~ 74 mg u průměrných 75 kg žen ). Nebylo specifikováno, zda byla dávka orální, parenterální nebo IV. Laboratorní studie na zvířatech jsou obvykle citovány v literatuře. Při závažné drogové závislosti (vysoká tolerance) lze tolerovat 2 000–3 000 mg denně.
Farmakologie
Morfin je klasicky rozdělen do dvou tříd, kde třída I (také známá jako „morfinová báze“) je hnědý prášek nerozpustný ve vodě vyrobený z koncentrovaného opia a třída II se po chemickém procesu stává bílým ve vodě rozpustným práškem . (Některé vlastní služby na celém světě také definovaly hnědý heroin jako morfin třídy III a bílý ve vodě rozpustný heroin jako morfin třídy IV. Jako legálně povolený lék se používá pouze starý morfin třídy II.
Farmakodynamika
| Sloučenina | Spříznění ( K i ) | Poměr | Ref | ||
|---|---|---|---|---|---|
| MOR | DOR | KOR | MOR: DOR: KOR | ||
| Morfium | 1,8 nM | 90 nM | 317 nM | 1: 50: 176 | |
| (-)-Morfin | 1,24 nM | 145 nM | 23,4 nM | 1: 117: 19 | |
| (+)-Morfin | > 10 μM | > 100 μM | > 300 μM | ND | |
| Sloučenina | Trasa | Dávka |
|---|---|---|
| Kodein | PO | 200 mg |
| Hydrokodon | PO | 20-30 mg |
| Hydromorfon | PO | 7,5 mg |
| Hydromorfon | IV | 1,5 mg |
| Morfium | PO | 30 mg |
| Morfium | IV | 10 mg |
| Oxykodon | PO | 20 mg |
| Oxykodon | IV | 10 mg |
| Oxymorfon | PO | 10 mg |
| Oxymorfon | IV | 1 mg |
Morfin je prototyp opioidu a je standardem, proti kterému se testují jiné opioidy. Interaguje převážně s heteromerem receptoru μ – δ-opioidních (Mu-Delta) . Vazebná místa μ jsou diskrétně distribuována v lidském mozku s vysokou hustotou v zadní amygdale , hypotalamu , thalamu , nucleus caudatus , putamenu a určitých kortikálních oblastech. Nacházejí se také na koncových axonech primárních aferentů v laminach I a II ( substantia gelatinosa ) míchy a v míšním jádru trojklanného nervu .
Morfin je agonista opioidního receptoru fenanthrenu -jeho hlavním účinkem je vazba a aktivace μ-opioidního receptoru (MOR) v centrálním nervovém systému . Jeho vnitřní aktivita na MOR je silně závislá na testu a tkáni, která je testována; v některých situacích je to úplný agonista, zatímco v jiných to může být částečný agonista nebo dokonce antagonista . V klinickém prostředí má morfin svůj hlavní farmakologický účinek na centrální nervový systém a gastrointestinální trakt . Jeho primárními terapeutickými účinky jsou analgezie a sedace. Aktivace MOR je spojena s analgezií, sedací, euforií , fyzickou závislostí a respirační depresí . Morfin je také agonista κ-opioidního receptoru (KOR) a δ-opioidního receptoru (DOR). Aktivace KOR je spojena se spinální analgézií, miózou (přesné zornice) a psychotomimetickými efekty. Předpokládá se, že DOR hraje roli v analgezii. Přestože se morfin neváže na receptor σ , bylo prokázáno, že agonisté σ receptoru, jako je (+)-pentazocin , inhibují morfinovou analgezii a antagonisté σ receptoru zesilují morfinovou analgezii, což naznačuje následné zapojení σ receptoru do účinků morfium.
Účinkům morfinu lze čelit pomocí antagonistů opioidních receptorů, jako je naloxon a naltrexon ; rozvoj tolerance k morfinu může být inhibován antagonisty receptoru NMDA, jako je ketamin nebo dextrometorfan . Rotace morfinu s chemicky odlišnými opioidy v dlouhodobé léčbě bolesti zpomalí růst tolerance v dlouhodobém horizontu, zejména u látek, o nichž je známo, že mají významně neúplnou zkříženou toleranci s morfinem, jako je levorfanol , ketobemidon , piritramid a methadon a jeho deriváty; všechna tato léčiva mají také antagonistické vlastnosti NMDA. Předpokládá se, že silným opioidem s nejvíce neúplnou křížovou tolerancí s morfinem je metadon nebo dextromoramid .
Genový výraz
Studie ukázaly, že morfin může změnit expresi řady genů . Ukázalo se, že jediná injekce morfinu mění expresi dvou hlavních skupin genů, u proteinů zapojených do mitochondriálního dýchání a u proteinů souvisejících s cytoskeletem .
Účinky na imunitní systém
O morfinu je již dlouho známo, že působí na receptory exprimované na buňkách centrálního nervového systému, což má za následek úlevu od bolesti a analgezii . V 70. a 80. letech vedly vědci k názoru, že morfin může také ovlivnit imunitní systém , důkazy naznačující, že drogově závislí na opioidech vykazují zvýšené riziko infekce (jako je zvýšená pneumonie , tuberkulóza a HIV/AIDS ) . Tato možnost zvýšila zájem o vliv chronického užívání morfinu na imunitní systém.
Prvním krokem určení, že morfin může ovlivnit imunitní systém, bylo stanovit, že opiátové receptory, o nichž je známo, že jsou exprimovány na buňkách centrálního nervového systému, jsou také exprimovány na buňkách imunitního systému. Jedna studie úspěšně ukázala, že dendritické buňky , součást vrozeného imunitního systému, vykazují opiátové receptory. Dendritické buňky jsou zodpovědné za produkci cytokinů , což jsou nástroje pro komunikaci v imunitním systému. Tato stejná studie ukázala, že dendritické buňky chronicky ošetřené morfinem během jejich diferenciace produkují více interleukinu-12 (IL-12), cytokinu zodpovědného za podporu proliferace, růstu a diferenciace T-buněk (další buňka adaptivního imunitního systému) a méně interleukin-10 (IL-10), cytokin zodpovědný za podporu imunitní odpovědi B-buněk (B buňky produkují protilátky k potlačení infekce).
Zdá se, že k této regulaci cytokinů dochází prostřednictvím dráhy závislé na p38 MAPK (mitogenem aktivovaná protein kináza) . Obvykle p38 v dendritické buňce exprimuje TLR 4 (toll-like receptor 4), který je aktivován ligandem LPS ( lipopolysacharid ). To způsobí, že p38 MAPK bude fosforylován . Tato fosforylace aktivuje p38 MAPK, aby začala produkovat IL-10 a IL-12. Když jsou dendritické buňky během svého procesu diferenciace chronicky vystaveny morfinu a poté ošetřeny LPS, produkce cytokinů je odlišná. Jakmile je p38 MAPK ošetřen morfinem, neprodukuje IL-10, místo toho zvýhodňuje produkci IL-12. Přesný mechanismus, kterým je produkce jednoho cytokinu zvýšena ve prospěch oproti jinému, není znám. Morfin s největší pravděpodobností způsobuje zvýšenou fosforylaci p38 MAPK. Interakce na transkripční úrovni mezi IL-10 a IL-12 mohou dále zvýšit produkci IL-12, jakmile IL-10 není produkován. Tato zvýšená produkce IL-12 způsobuje zvýšenou imunitní odpověď T-buněk.
Další studie účinků morfinu na imunitní systém ukázaly, že morfin ovlivňuje produkci neutrofilů a dalších cytokinů . Vzhledem k tomu, že cytokiny jsou produkovány jako součást okamžité imunologické odpovědi ( zánět ), bylo navrženo, že mohou také ovlivnit bolest. Tímto způsobem mohou být cytokiny logickým cílem pro vývoj analgetik. Jedna studie nedávno použila zvířecí model (řez zadní tlapky) k pozorování účinků podávání morfinu na akutní imunologickou odpověď. Po řezu zadní tlapky byly měřeny prahy bolesti a produkce cytokinů. Normálně se produkce cytokinů v poraněné oblasti a kolem ní zvyšuje, aby se bojovalo proti infekci a kontrolovalo hojení (a případně i ke kontrole bolesti), ale precizní podávání morfinu (0,1 mg/kg až 10,0 mg/kg) snížilo počet cytokiny nalezené kolem rány způsobem závislým na dávce. Autoři naznačují, že podávání morfinu v období akutního poranění může snížit odolnost vůči infekci a může zhoršit hojení rány.
Farmakokinetika
Absorpce a metabolismus
Morfin lze podávat orálně , sublingválně , bukálně , rektálně , subkutánně , intranasálně , intravenózně , intratekálně nebo epidurálně a inhalovat pomocí nebulizátoru. Jako rekreační droga je stále běžnější vdechovat („ Chasing the Dragon “), ale pro lékařské účely je intravenózní (IV) injekce nejběžnějším způsobem podávání. Morfin podléhá rozsáhlému metabolismu prvního průchodu (velká část se rozpadá v játrech), takže pokud je podáván orálně, do centrálního nervového systému se dostane pouze 40% až 50% dávky. Výsledné plazmatické hladiny po subkutánní (SC), intramuskulární (IM) a IV injekci jsou srovnatelné. Po IM nebo SC injekcích vrcholí plazmatické hladiny morfinu přibližně za 20 minut a po orálním podání vrcholí přibližně za 30 minut. Morfin je metabolizován primárně v játrech a přibližně 87% dávky morfinu je vyloučeno močí do 72 hodin po podání. Morfin je primárně metabolizován na morfin-3-glukuronid (M3G) a morfin-6-glukuronid (M6G) prostřednictvím glukuronidace metabolickým enzymem fáze II UDP-glukuronosyltransferázou-2B7 (UGT2B7). Asi 60% morfinu je převedeno na M3G a 6% až 10% je převedeno na M6G. K metabolismu dochází nejen v játrech, ale může probíhat také v mozku a ledvinách. M3G nepodléhá vazbě na opioidní receptor a nemá žádný analgetický účinek. M6G se váže na μ-receptory a je u člověka polovičně silnější analgetikum než morfin. Morfin lze také metabolizovat na malé množství normorfinu , kodeinu a hydromorfonu . Rychlost metabolismu je určena podle pohlaví, věku, stravy, genetické výbavy, chorobného stavu (pokud existuje) a užívání jiných léků. Eliminační poločas morfinu je přibližně 120 minut, i když mezi muži a ženami mohou být malé rozdíly. Morfin může být uložen v tuku, a proto může být detekovatelný i po smrti. Morfin může procházet hematoencefalickou bariérou , ale kvůli špatné rozpustnosti lipidů, vazbě na bílkoviny, rychlé konjugaci s kyselinou glukuronovou a ionizaci neprochází snadno. Heroin , který je odvozen z morfinu, snadněji prochází hematoencefalickou bariérou, čímž je účinnější.
Prodloužené vydání
Existují formulace orálně podávaného morfinu s prodlouženým uvolňováním, jejichž účinek trvá déle, které lze podávat jednou denně. Obchodní názvy této formulace morfinu zahrnují Avinza, Kadian, MS Contin a Dolcontin. U konstantní bolesti je úlevový účinek morfinu s prodlouženým uvolňováním podávaného jednou (u Kadian) nebo dvakrát (u MS Contin) každých 24 hodin zhruba stejný jako u více podání morfinu s okamžitým uvolňováním (nebo „pravidelného“). Morfin s prodlouženým uvolňováním lze podávat společně s "záchrannými dávkami" morfinu s okamžitým uvolňováním podle potřeby v případě průlomové bolesti, z nichž každý obvykle sestává z 5% až 15% 24hodinové dávky s prodlouženým uvolňováním.
Detekce v tělních tekutinách
Morfin a jeho hlavní metabolity, morfin-3-glukuronid a morfin-6-glukuronid, lze detekovat v krvi, plazmě, vlasech a moči pomocí imunotestu . Chromatografii lze použít k testování každé z těchto látek samostatně. Některé testovací postupy hydrolyzují metabolické produkty na morfin před imunotestem, což je třeba vzít v úvahu při porovnávání hladin morfinu v samostatně publikovaných výsledcích. Morfin lze také izolovat ze vzorků plné krve extrakcí na pevné fázi (SPE) a detekovat pomocí kapalinové chromatografie-hmotnostní spektrometrie (LC-MS).
Požití kodeinu nebo potravin obsahujících mák může způsobit falešně pozitivní výsledky.
Recenze z roku 1999 odhaduje, že relativně nízké dávky heroinu (který se okamžitě metabolizuje na morfin) jsou detekovatelné standardními testy moči po dobu 1–1,5 dne po použití. Přezkum z roku 2009 zjistil, že pokud je analytem morfin a mez detekce je 1 ng/ml, lze detekovat 20 mg intravenózní (IV) dávku morfinu po dobu 12–24 hodin. Mez detekce 0,6 ng/ml měla podobné výsledky.
Přirozený výskyt
Morfin je nejhojnějším opiátem nacházejícím se v opiu , sušený latex extrahovaný mělkým rýhováním nezralých podnoží máku Papaver somniferum . Morfin je obecně 8–14% suché hmotnosti opia, ačkoli speciálně vyšlechtěné kultivary dosahují 26% nebo produkují vůbec málo morfinu (pod 1%, možná až 0,04%). Posledně jmenované odrůdy, včetně kultivarů opia makového „Przemko“ a „Norman“, se používají k produkci dalších dvou alkaloidů, thebainu a oripavinu , které se používají při výrobě polosyntetických a syntetických opioidů, jako je oxykodon a etorfin a některé jiné druhy drog. P. bracteatum neobsahuje morfin nebo kodein ani jiné narkotické fenanthrenové alkaloidy. Tento druh je spíše zdrojem thebainu . Výskyt morfinu u jiných Papaverales a Papaveraceae , stejně jako u některých druhů chmele a moruše nebyl potvrzen. Morfin se vyrábí převážně na počátku životního cyklu rostliny. Po dosažení optimálního bodu pro extrakci produkují různé procesy v rostlině kodein, thebain a v některých případech zanedbatelné množství hydromorfonu , dihydromorfinu , dihydrokodeinu , tetrahydro-tebainu a hydrokodonu (tyto sloučeniny jsou syntetizovány spíše z thebainu a oripavinu).
V mozku savců je morfin detekovatelný ve stopových koncentracích v ustáleném stavu. Lidské tělo také produkuje endorfiny , což jsou chemicky příbuzné endogenní opioidní peptidy, které fungují jako neuropeptidy a mají podobné účinky jako morfin.
Biosyntéza člověka
Morfin je endogenní opioid u lidí, který lze syntetizovat a uvolňovat z různých lidských buněk, včetně bílých krvinek . CYP2D6 , izoenzym cytochromu P450 , katalyzuje biosyntézu morfinu z kodeinu a dopaminu z tyraminu podél biosyntetické dráhy morfinu u lidí. Morfium biosyntetickou cestu u lidí dochází takto:
L-tyrosin → para -tyramine nebo L-DOPA → dopaminu → ( S ) -norlaudanosoline → ( S ) - reticuline → 1,2-dehydroretinulinium → ( R ) -reticuline → salutaridine → salutaridinol → thebain → neopinon → kodeinon → kodein → morfin
( S ) -Norlaudanosolin (také známý jako tetrahydropapaverolin) lze také syntetizovat z 3,4-dihydroxyfenylacetaldehydu (DOPAL), metabolitu L-DOPA a dopaminu. Bylo zjištěno, že koncentrace endogenního kodeinu a morfinu v moči významně stoupají u jedinců užívajících L-DOPA k léčbě Parkinsonovy choroby .
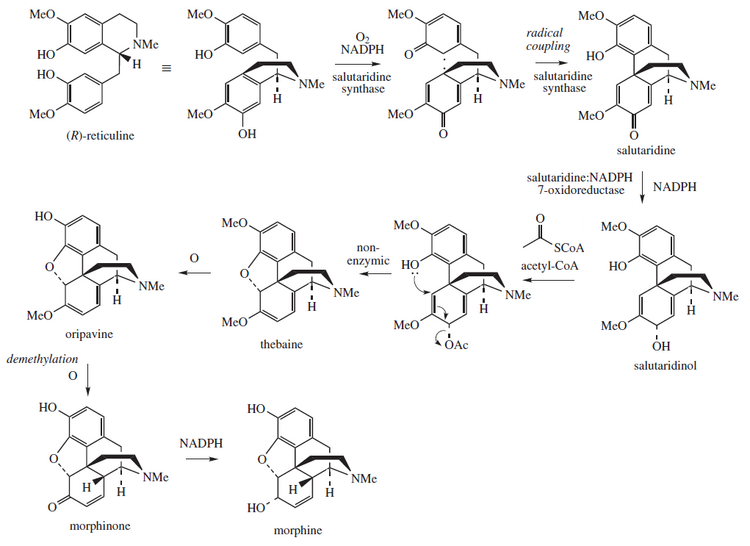
Biosyntéza v opiovém máku
Morfin je biosyntetizován v opiovém máku z tetrahydroisochinolinového retikulinu . Je přeměněn na salutaridin , thebain a oripavin . Enzymy zapojené do tohoto procesu jsou salutaridin syntáza , salutaridin: NADPH 7-oxidoreduktáza a kodeinon reduktáza . Vědci se pokoušejí reprodukovat biosyntetickou cestu, která produkuje morfin v geneticky upravených kvasnicích . V červnu 2015 mohl být S -reticulin vyroben z cukru a R -reticuline mohl být přeměněn na morfin, ale mezilehlou reakci nebylo možné provést. V srpnu 2015 byla hlášena první úplná syntéza thebainu a hydrokodonu v kvasnicích, ale proces by musel být 100 000krát produktivnější, aby byl vhodný pro komerční použití.
Chemie
Prvky morfinové struktury byly použity k vytvoření zcela syntetických drog, jako je rodina morfinanů ( levorfanol , dextrometorfan a další) a další skupiny, které mají mnoho členů s vlastnostmi podobnými morfinu. Modifikace morfinu a výše uvedených syntetických látek také vedla k nenarkotickým léčivům s jiným použitím, jako jsou emetika, stimulancia, antitusika, anticholinergika, svalová relaxancia, lokální anestetika, celková anestetika a další. Byly také vyvinuty léky agonisty a antagonisty odvozené od morfinu .
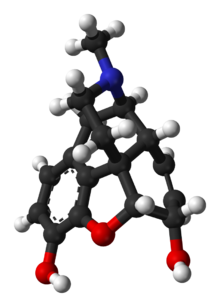
Popis struktury

Morfin je benzylisochinolinový alkaloid se dvěma dalšími kruhovými uzávěry. Jak uvedl Jack DeRuiter z Odboru objevování a vývoje léčiv (dříve Farmaceutické vědy), Harrison School of Pharmacy, Auburn University ve svých poznámkách ke kurzu z podzimu 2000 pro kurz dřívějšího oddělení „Principles of Drug Action 2“, „Zkoumání morfinu“ molekula odhaluje následující strukturní rysy důležité pro její farmakologický profil ...
- Tuhá pentacyklická struktura sestávající z benzenového kruhu (A), dvou částečně nenasycených cyklohexanových kruhů (B a C), piperidinového kruhu (D) a tetrahydrofuranového kruhu (E). Kroužky A, B a C jsou fenantrenový kruhový systém. Tento prstencový systém má malou konformační flexibilitu ...
- Dvě hydroxylové funkční skupiny: C3- fenolová [hydroxylová skupina] (p K a 9,9) a C6- alylová [hydroxylová skupina],
- Etherová vazba mezi C4 a C5,
- Nenasycení mezi C7 a C8,
- Základní, [terciární] -aminová funkce na pozici 17, [a]
- [Pět] center chirality (C5, C6, C9, C13 a C14) s morfinem vykazujícím vysoký stupeň stereoselektivity analgetického účinku. “
Morfin a většina jeho derivátů nevykazují optickou izomerii, ačkoli někteří vzdálenější příbuzní jako morfinanové řady (levorfanol, dextorfan a racemický mateřský chemický racemorfan) ano, a jak je uvedeno výše, stereoselektivita in vivo je důležitým problémem.
Použití a deriváty
Většina vyrobeného legálního morfinu se používá k výrobě kodeinu methylací. Je také prekurzorem mnoha léků včetně heroinu (3,6-diacetylmorfin), hydromorfonu (dihydromorfinonu) a oxymorfonu (14-hydroxydihydromorfinonu). Většina polosyntetických opioidů, jak podskupin morfinu, tak kodeinu , je vytvořena úpravou jedné nebo více z následujících položek:
- Halogenování nebo jiné úpravy v polohách 1 nebo 2 na morfinovém uhlíkovém skeletu.
- Metylová skupina, která přeměňuje morfin na kodein, může být odstraněna nebo přidána zpět nebo nahrazena jinou funkční skupinou, jako je ethyl a další, za vzniku analogů kodeinu léčiv odvozených od morfinu a naopak. Analogy kodeinu léčiv na bázi morfinu často slouží jako prekurzory silnějších léčiv, jako u kodeinu a morfinu, hydrokodonu a hydromorfonu, oxykodonu a oxymorfonu, nikokodeinu a nikomorfinu, dihydrokodeinu a dihydromorfinu atd.
- Nasycení, otevření nebo jiné změny vazby mezi pozicemi 7 a 8, stejně jako přidání, odebrání nebo úprava funkčních skupin do těchto pozic; saturace, redukce, eliminace nebo jiná modifikace vazby 7–8 a připojení funkční skupiny na 14 poskytuje hydromorfinol ; oxidace hydroxylové skupiny na karbonyl a změna vazby 7–8 na jednoduchou z dvojitých změn kodeinu na oxykodon.
- Připojení, odstranění nebo modifikace funkčních skupin do poloh 3 nebo 6 (dihydrokodein a příbuzný, hydrokodon, nicomorfin); v případě přesunu methylové funkční skupiny z polohy 3 do 6 se kodein stane heterokodeinem , který je 72krát silnější, a tedy šestkrát silnější než morfin
- Připojení funkčních skupin nebo jiná modifikace v poloze 14 (oxymorfon, oxykodon, naloxon)
- Úpravy v polohách 2, 4, 5 nebo 17, obvykle spolu s dalšími změnami molekuly jinde na morfinovém skeletu. Často se to děje pomocí léků vyrobených katalytickou redukcí, hydrogenací, oxidací nebo podobně, za vzniku silných derivátů morfinu a kodeinu.
Mnoho derivátů morfinu lze také vyrobit s použitím thebainu nebo kodeinu jako výchozího materiálu. Nahrazení N -methylové skupiny morfinu N -fenylethylovou skupinou vede k produktu, který je v účinnosti svého opiátového agonisty 18krát silnější než morfin. Spojením této modifikace s nahrazením 6- hydroxyskupiny 6- methylenovou skupinou vznikne některými opatřeními sloučenina přibližně 1 443krát účinnější než morfin, silnější než sloučeniny Bentley, jako je etorfin (M99, Immobilon tranquillizer dart). S morfinem úzce souvisí opioidy morfin -N -oxid (genomorfin), což je farmaceutický přípravek, který se již běžně nepoužívá; a pseudomorfin, alkaloid, který existuje v opiu, se tvoří jako produkty rozkladu morfinu.
V důsledku rozsáhlé studie a používání této molekuly bylo od poslední čtvrtiny 19. století vyvinuto více než 250 derivátů morfinu (včetně počítání kodeinu a příbuzných drog). Tyto léky se pohybují od 25% analgetické síly kodeinu (nebo o něco více než 2% síly morfinu) po několik tisícinásobek síly morfinu až po silné opioidní antagonisty, včetně naloxonu (Narcan), naltrexonu (Trexan), diprenorfinu (M5050, reverzní činidlo pro šipku Immobilon) a nalorfin (Nalline). Z morfinu jsou také odvozeni někteří opioidní agonisté-antagonisté, částeční agonisté a inverzní agonisté. Receptorový aktivační profil polosyntetických derivátů morfinu se velmi liší a některé, jako apomorfin, nemají narkotické účinky.
Soli
Morfin i jeho hydratovaná forma jsou ve vodě málo rozpustné. Z tohoto důvodu farmaceutické společnosti vyrábějí sulfátové a hydrochloridové soli léčiva, které jsou ve vodě více než 300krát rozpustnější než jejich mateřská molekula. Zatímco pH nasyceného roztoku hydrátu morfinu je 8,5, soli jsou kyselé. Protože pocházejí ze silné kyseliny, ale slabé báze, mají oba přibližně pH = 5; v důsledku toho jsou morfinové soli smíchány s malým množstvím NaOH , aby byly vhodné pro injekce.
Používá se řada solí morfinu, přičemž nejběžnější v současném klinickém použití je hydrochlorid, síran, tartrát a citrát; méně často methobromid, hydrobromid, hydrojodid, laktát, chlorid a bitartrát a další uvedené níže. Diacetát morfinu (heroin) není sůl, ale spíše další derivát, viz výše.
Morfin meconate je hlavní forma alkaloidu v máku, stejně jako morfin pektinát, dusičnan, síran a některé další. Podobně jako kodein, dihydrokodein a další (zejména starší) opiáty byl morfin některými dodavateli používán jako salicylátová sůl a lze jej snadno smíchat, což přináší terapeutickou výhodu jak opioidu, tak NSAID ; v minulosti se také používalo více barbiturátových solí morfinu, stejně jako/je morfinvalerát, přičemž sůl kyseliny je aktivní zásadou kozlíku lékařského . Morfenát vápenatý je meziproduktem v různých metodách výroby morfinu pomocí latexu a máku, vzácněji zaujímá místo morfenát sodný. V závislosti na způsobu přípravy může být v makovém čaji přítomen askorbát morfinu a další soli, jako je tanát, citrát a acetát, fosfát, valerát a další.
Soli uvedené americkou protidrogovou správou pro účely hlášení, kromě několika dalších, jsou následující:
| Vyberte soli morfinu s jejich rozvrhem zákona o kontrolovaných látkách (CSA), kódovým číslem pro administrativní regulované látky (ACSCN) a převodním poměrem volné báze. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
|
Výroba
V opiovém máku jsou alkaloidy vázány na kyselinu meconovou . Metoda je extrahovat z drcené rostliny zředěnou kyselinou sírovou, která je silnější kyselinou než kyselina meconová, ale není tak silná, aby reagovala s molekulami alkaloidů. Extrakce se provádí v mnoha krocích (jeden množství drceného rostlin se extrahuje nejméně šest až desetkrát, takže prakticky každý alkaloid přejde do roztoku). Z roztoku získaného v posledním extrakčním kroku se alkaloidy vysráží buď hydroxidem amonným nebo uhličitanem sodným. Posledním krokem je čištění a oddělení morfinu od ostatních opiových alkaloidů. Poněkud podobný Gregoryho proces byl vyvinut ve Velké Británii během druhé světové války, která začíná dušením celé rostliny, ve většině případů zachrání kořeny a listy, v čisté nebo mírně okyselené vodě, poté pokračuje kroky koncentrace, extrakce, a čištění alkaloidů. Jiné způsoby zpracování „slámy z máku“ (tj. Sušené lusky a stonky) používají páru, jeden nebo více druhů alkoholu nebo jiná organická rozpouštědla.
V kontinentální Evropě a Britském společenství převládají metody slámy s mákem, přičemž v Indii se latexová metoda používá nejčastěji. Latexová metoda může zahrnovat svislé nebo vodorovné krájení nezralých lusků nožem se dvěma až pěti čepelemi s chráničem vyvinutým speciálně pro tento účel do hloubky zlomku milimetru a rýhování lusků lze provádět až do pětkrát. Alternativní latexová metoda, která se někdy v minulosti v Číně používala, je odříznout hlavy máku, protáhnout je velkou jehlou a vysušený latex posbírat o 24 až 48 hodin později.
V Indii se opium sklizené licencovanými pěstiteli máku dehydratuje na stejnoměrné úrovně hydratace ve vládních zpracovatelských centrech a poté se prodává farmaceutickým společnostem, které z opia extrahují morfin. V Turecku a Tasmánii se však morfin získává sklizní a zpracováním plně vyzrálých suchých semenných lusků s přichycenými stonky, nazývaných maková sláma . V Turecku se používá proces extrakce vody, zatímco v Tasmánii se používá proces extrakce rozpouštědlem.
Mák setý obsahuje nejméně 50 různých alkaloidů, ale většina z nich má velmi nízkou koncentraci. Morfin je hlavní alkaloid v surovém opiu a tvoří zhruba 8–19% opia v sušině (v závislosti na podmínkách pěstování). Některé účelově vyvinuté kmeny máku nyní produkují opium, které obsahuje až 26% hmotnostních morfinu. Hrubou zásadou pro stanovení obsahu morfinu v práškové sušené slámě máku je vydělit očekávané procento pro kmen nebo plodinu latexovou metodou osmi nebo empiricky určeným faktorem, který je často v rozmezí 5 až 15. Normanský kmen P. Somniferum , také vyvinutý v Tasmánii , produkuje až 0,04% morfinu, ale s mnohem vyšším množstvím thebainu a oripavinu , které lze použít k syntéze polosyntetických opioidů a dalších léků, jako jsou stimulanty, emetika, opioidní antagonisté , anticholinergika a látky hladké svaloviny.
V padesátých a šedesátých letech Maďarsko dodalo téměř 60% celkové evropské produkce morfinu určeného k léčbě. V Maďarsku je dodnes pěstování máku legální, ale mákové farmy jsou zákonem omezeny na 2 akry (8 100 m 2 ). Je také legální prodávat sušený mák v květinářstvích pro použití v aranžmá.
V roce 1973 bylo oznámeno, že tým v National Institutes of Health ve Spojených státech vyvinul metodu pro celkovou syntézu morfinu, kodeinu a thebainu za použití uhelného dehtu jako výchozího materiálu. Prvotním důvodem výzkumu byl nedostatek látek potlačujících kašel třídy kodein-hydrokodon (všechny mohou být vyrobeny z morfinu v jednom nebo více krocích, stejně jako z kodeinu nebo thebainu).
Většina morfinu vyráběného pro farmaceutické použití na celém světě je ve skutečnosti přeměněna na kodein, protože jeho koncentrace v surové opiové i makové slámě je mnohem nižší než koncentrace morfinu; ve většině zemí je použití kodeinu (jako koncového produktu i prekurzoru) přinejmenším stejné nebo vyšší než u morfinu na základě hmotnosti.
Chemická syntéza
První celková syntéza morfinu , navržená Marshallem D. Gatesem, Jr. v roce 1952, zůstává široce používaným příkladem totální syntézy . Bylo hlášeno několik dalších syntéz, zejména výzkumnými skupinami Rice, Evans, Fuchs, Parker, Overman, Mulzer-Trauner, White, Taber, Trost, Fukuyama, Guillou a Stork. Vzhledem ke stereochemické složitosti a následné syntetické výzvě, kterou tato polycyklická struktura představuje, vyjádřil Michael Freemantle názor, že je „velmi nepravděpodobné“, že by chemická syntéza byla někdy nákladově efektivní tak, aby mohla konkurovat nákladům na výrobu morfinu z opiový mák.
Předchůdce jiných opioidů
Farmaceutický
Morfin je prekurzorem při výrobě řady opioidů, jako je dihydromorfin , hydromorfon , hydrokodon a oxykodon, jakož i kodeinu , který sám o sobě má velkou rodinu polosyntetických derivátů.
Nedovolený
Nelegální morfin se vyrábí, i když jen zřídka, z kodeinu, který se nachází v volně prodejných lécích proti kašli a bolesti. Dalším nezákonným zdrojem je morfin extrahovaný z morfinových produktů s prodlouženým uvolňováním. Chemické reakce pak mohou být použity k přeměně morfinu, dihydromorfinu a hydrokodonu na heroin nebo jiné opioidy [např. Diacetyldihydromorfin (Paralaudin) a thebacon ]. Další tajné přeměny - na morfin, na ketony třídy hydromorfonů nebo jiné deriváty jako dihydromorfin (Paramorfan), desomorfin (Permonid), metopon atd. A kodeinu na hydrokodon (Dicodid), dihydrokodein (Paracodin) atd. - vyžadují větší odborné znalosti a typy a množství chemikálií a zařízení, jejichž získávání je obtížnější, a proto se používají jen zřídka, nezákonně (ale byly zaznamenány případy).
Dějiny
Elixíru opium bázi byl připsal alchymistů z byzantských časů, ale konkrétní vzorec byl během osmanského dobývání ztratil Konstantinopole ( Istanbul ). Kolem roku 1522 Paracelsus zmínil elixír na bázi opia, který nazýval laudanum z latinského slova laudare , což znamená „chválit“. Popsal to jako silný lék proti bolesti, ale doporučil, aby byl používán střídmě. Uvedený recept se podstatně liší od receptu na moderní laudanum.
Morfin byl objeven jako první aktivní alkaloid extrahovaný z rostliny máku setého v prosinci 1804 v Paderbornu německým lékárníkem Friedrichem Sertürnerem . V roce 1817 Sertürner hlásil experimenty, při nichž podával morfin sobě, třem mladým chlapcům, třem psům a myši; všichni čtyři lidé téměř zemřeli. Sertürner původně pojmenoval látku morfium podle řeckého boha snů Morfea , protože má tendenci způsobovat spánek. Sertürnerovo morfium bylo šestkrát silnější než opium. Předpokládal, že protože by byly zapotřebí nižší dávky drogy, bylo by to méně návykové. Sertürner se však na drogě stal závislým a varoval: „Považuji za svou povinnost upozornit na hrozné účinky této nové látky, kterou jsem nazval morfium, aby bylo možné odvrátit pohromu“.
Droga byla poprvé uvedena na trh široké veřejnosti společností Sertürner and Company v roce 1817 jako lék proti bolesti a také jako léčba závislosti na opiu a alkoholu. Poprvé byl použit jako jed v roce 1822, kdy byl doktor Edme Castaing z Francie usvědčen z vraždy pacienta. Komerční výroba byla zahájena v německém Darmstadtu v roce 1827 lékárnou, která se stala farmaceutickou společností Merck, přičemž prodej morfinu byl velkou částí jejich raného růstu. V padesátých letech 19. století Alexander Wood oznámil, že své ženě Rebecce jako experiment injekčně podal morfin; Mýtus říká, že ji to zabilo kvůli respirační depresi, ale svého manžela přežila o deset let.
Později se zjistilo, že morfin je návykovější než alkohol nebo opium, a jeho rozsáhlé užívání během americké občanské války údajně mělo za následek více než 400 000 pacientů trpících „nemocí vojáka“ závislostí na morfinu. Tato myšlenka byla předmětem kontroverze, protože se objevily náznaky, že taková nemoc byla ve skutečnosti výmyslem; první doložené použití výrazu „nemoc vojáka“ bylo v roce 1915.
Diacetylmorfin (lépe známý jako heroin ) byl syntetizován z morfinu v roce 1874 a uveden na trh společností Bayer v roce 1898. Heroin je přibližně 1,5 až 2krát účinnější než hmotnostní hmotnost morfinu. Vzhledem k rozpustnosti diacetylmorfinu v lipidech může procházet hematoencefalickou bariérou rychleji než morfin, což následně zvyšuje posilující složku závislosti. Pomocí řady subjektivních a objektivních opatření jedna studie odhadovala relativní účinnost heroinu k morfinu podávanému intravenózně post-závislým na 1,80–2,66 mg morfinsulfátu na 1 mg diamorfin hydrochloridu (heroinu).

Morfin se stal v USA regulovanou látkou podle Harrisonova zákona o daních z omamných látek z roku 1914 a držení bez předpisu v USA je trestné. Morfin byl nejčastěji zneužívaným narkotickým analgetikem na světě, dokud nebyl syntetizován a uveden do užívání heroin. Obecně do syntézy dihydromorfinu (asi 1900), dihydromorfinonové třídy opioidů (dvacátá léta) a oxykodonu (1916) a podobných léků neexistovaly žádné jiné léky ve stejném rozsahu účinnosti jako opium, morfin a heroin, se syntetickými materiály, které byly ještě několik let pryč ( petidin byl vynalezen v Německu v roce 1937) a opioidními agonisty mezi semisyntetiky byly analogy a deriváty kodeinu, jako je dihydrokodein (Paracodin), ethylmorfin (Dionin) a benzylmorfin (Peronin). I dnes je morfin nejvyhledávanějším narkotikem na předpis závislými na heroinu, když je heroinu nedostatek, přičemž všechny ostatní věci jsou stejné; místní podmínky a preference uživatelů mohou způsobit, že hydromorfon , oxymorfon , vysoké dávky oxykodonu nebo methadonu , stejně jako dextromoramid, v konkrétních případech, jako je Austrálie 70. let, na začátek tohoto konkrétního seznamu. Léky s mezerou, které používá největší absolutní počet závislých na heroinu, je pravděpodobně kodein, s významným použitím také dihydrokodeinu , derivátů máku, jako je mák a čaj z máku, propoxyfen a tramadol .
Strukturní vzorec morfinu určil v roce 1925 Robert Robinson . Byly patentovány nejméně tři způsoby úplné syntézy morfinu z výchozích materiálů, jako je uhelný dehet a ropné destiláty, přičemž první z nich byl oznámen v roce 1952, Dr. Marshall D. Gates, Jr., z University of Rochester . Přesto je drtivá většina morfinu získávána z opiového máku buď tradičním způsobem získávání latexu z rýhovaných, nezralých lusků máku, nebo procesy využívajícími slámu z máku, sušené lusky a stonky rostliny, nejrozšířenější z který byl vynalezen v Maďarsku v roce 1925 a oznámen v roce 1930 maďarským farmakologem Jánosem Kabajem .
V roce 2003 byl objeven endogenní morfin přirozeně se vyskytující v lidském těle. Třicet let spekulace byly provedeny na toto téma, protože tam byl receptor, který, jak se zdálo, reagoval pouze na morfinu: na μ 3 opioidní receptor v lidské tkáni. Bylo zjištěno, že lidské buňky, které se tvoří v reakci na rakovinné buňky neuroblastomu, obsahují stopová množství endogenního morfinu.
Společnost a kultura
Právní status
- V Austrálii je morfin klasifikován jako droga podle plánu 8 pod různě nazvanými zákony o státních a územních jedech.
- V Kanadě je morfin klasifikován jako léčivo podle plánu I podle zákona o kontrolovaných léčivech a látkách .
- Ve Francii je morfin v nejpřísnějším plánu regulovaných látek, který vychází z francouzského zákona o kontrolovaných látkách z prosince 1970.
- V Německu je morfin verkehrsfähiges und verschreibungsfähiges Betäubungsmittel uveden v Anlage III (ekvivalent plánu CSA II) Betäubungsmittelgesetz .
- Ve Švýcarsku je morfin naplánován podobně jako německá právní klasifikace drogy.
- V Japonsku je morfin klasifikován jako narkotikum podle zákona o kontrole omamných a psychotropních látek (麻 薬 及 び 向 精神 薬 取締 法, mayaku oyobi kōseishinyaku torishimarihō ).
- V Nizozemsku je morfin klasifikován jako droga seznamu 1 podle zákona o opiu .
- Ve Spojeném království je morfin uveden jako droga třídy A podle zákona o zneužívání drog z roku 1971 a kontrolovaného léčiva podle plánu 2 podle předpisů o zneužívání drog z roku 2001 .
- Ve Spojených státech je morfin klasifikován jako regulovaná látka podle přílohy II podle zákona o kontrolovaných látkách pod hlavním kódovým číslem 9300 pro administrativní kontrolované látky. Na léčiva pro morfin se vztahují roční výrobní kvóty; v roce 2017 činily tyto kvóty 35,0 tun produkce na prodej a 27,3 tun produkce jako meziproduktu nebo chemického prekurzoru pro přeměnu na jiná léčiva. Morfin vyrobený pro použití v extrémně zředěných formulacích je z výrobní kvóty vyloučen.
- V mezinárodním měřítku (OSN) je morfin drogou zařazenou do seznamu I podle Jednotné úmluvy o omamných látkách .
Nelékařské použití
Euforie, komplexní zmírnění tísně a tedy všechny aspekty utrpení, podpora sociability a empatie, „body high“ a anxiolýza poskytovaná omamnými látkami včetně opioidů může způsobit použití vysokých dávek bez bolesti po delší dobu. , což může u uživatele vyvolat chorobnou touhu po droze. Být prototypem celé opioidní třídy drog znamená, že morfin má vlastnosti, které jej mohou vést ke zneužití. Závislost na morfinu je model, na kterém je založeno současné vnímání závislosti.
Studie na zvířatech a lidech a klinická zkušenost podporují tvrzení, že morfin je jedním z nejznámějších známých euforických léků, a podle studií nelze odlišit heroin a morfin kromě IV cesty, protože heroin je proléčivo pro dodávání systémového morfinu. Chemické změny v molekule morfinu poskytují další euphorigenika, jako je dihydromorfin , hydromorfon (Dilaudid, Hydal) a oxymorfon (Numorphan, Opana), stejně jako methylované ekvivalenty posledně jmenovaných dihydrokodein , hydrokodon a oxykodon; kromě heroinu existují dipropanoylmorfin , diacetyldihydromorfin a další členové kategorie diester 3,6 morfinu, jako je nikomorfin a další podobné polosyntetické opiáty jako desomorfin , hydromorfinol atd., které se klinicky používají v mnoha zemích světa, ale v mnoha případech ve výjimečných případech také nezákonně vyráběné.
Nemedicínské použití morfinu obecně znamená užívání více, než je předepsáno nebo mimo lékařský dohled, injekční podání perorálních přípravků, míchání s neschválenými potenciátory, jako je alkohol, kokain a podobně, nebo poražení mechanismu s prodlouženým uvolňováním žvýkáním tablet nebo se proměnit v prášek na šňupání nebo přípravu injekčních přípravků. Druhá metoda může být časově náročná a zapojená jako tradiční metody kouření opia. To a skutečnost, že játra ničí velké procento léčiva při prvním průchodu, má dopad na stranu poptávky rovnice pro tajné opětovné prodejce, protože mnoho zákazníků není uživateli jehly a mohlo být zklamáno, že drogu požili orálně. Jelikož je morfin v mnoha případech obecně tak tvrdý nebo těžší k odvrácení než oxykodon , je morfin v jakékoli formě na ulici neobvyklý, přestože ampulky a lahvičky s injekcí morfinu, čistý farmaceutický prášek s morfinem a rozpustné víceúčelové tablety jsou velmi populární kde je k dispozici.
Morfin je také k dispozici v pastě, která se používá při výrobě heroinu, který lze sám kouřit nebo přeměnit na rozpustnou sůl a injekčně podávat; totéž platí pro předposlední produkty procesů Kompot (polský heroin) a černého dehtu. Maková sláma i opium mohou poskytnout morfin o čistotě od makového čaje po morfin téměř farmaceutické kvality samotný nebo se všemi více než 50 dalšími alkaloidy. Je také aktivní narkotickou přísadou v opiu a ve všech jeho formách, derivátech a analogích a také se tvoří v důsledku rozpadu heroinu a jinak je přítomen v mnoha dávkách nedovoleného heroinu v důsledku neúplné acetylace.
Jména
Morfin je prodáván pod mnoha různými značkami v různých částech světa. Dříve se tomu v britské angličtině říkalo Morphia.
Neformální jména pro morfin zahrnují: Cube Juice, Dope, Dreamer, Emsel, First Line, God Drug, Hard Stuff, Hocus, Hows, Lydia, Lydic, M, Miss Emma, Mister Blue, Monkey, Morf, Morph, Morphide, Morphie, Morpho, matka, MS, paní Emma, bláto, nový Jack Swing (pokud je smíchán s heroinem ), sestra, Tab, Unkie, Unkie White a Stuff.
Tablety MS Contin jsou známé jako mlhy a 100 mg tablety s prodlouženým uvolňováním jako šedé a trháky. „ Speedball “ může používat jako opioidní složku morfin, který je kombinován s kokainem, amfetaminy , methylfenidátem nebo podobnými léky. „Blue Velvet“ je kombinace morfinu s antihistaminovým tripelennaminem (Pyrabenzamin, PBZ, Pelamine) užívaná injekčně nebo méně často směs při požití nebo použití jako retenční klystýr; název je také známý tím, že odkazuje na kombinaci tripelennaminu a dihydrokodeinu nebo kodeinových tablet nebo sirupů užívaných ústy. „Morphia“ je starší oficiální termín pro morfin používaný také jako slangový výraz. „Driving Miss Emma“ je intravenózní podání morfinu. Víceúčelové tablety (snadno rozpustné podkožní tablety, které lze také spolknout nebo rozpustit pod jazykem nebo mezi tváří a čelistí) jsou známy, stejně jako některé značky hydromorfonu, jako Shake & Bake nebo Shake & Shoot.
Lze kouřit morfin, zejména diacetylmorfin (heroin), nejběžnější metodou je metoda „Chasing The Dragon“. Provedení relativně surové acetylace k přeměně morfinu na heroin a podobné drogy bezprostředně před použitím se nazývá AAing (pro acetanhydrid) nebo domácí pečení a výstup postupu je také znám jako domácí pečení nebo Blue Heroin ( nezaměňovat s heroinem Blue Magic nebo linctusem známým jako Blue Morphine nebo Blue Morphone, nebo směsí Blue Velvet popsanou výše).
Přístup v rozvojových zemích
Přestože je morfin levný, lidé v chudších zemích k němu často nemají přístup. Podle odhadu Mezinárodní rady pro kontrolu omamných látek z roku 2005 spotřebuje šest zemí (Austrálie, Kanada, Francie, Německo, Spojené království a Spojené státy) 79% světového morfinu. Méně bohaté země, které tvoří 80% světové populace, spotřebovaly jen asi 6% celosvětové nabídky morfinu. Některé země dovážejí prakticky žádný morfin a v jiných je droga zřídka dostupná i pro úlevu od silné bolesti při umírání.
Odborníci na léčbu bolesti připisují nedostatečnou distribuci morfinu neodůvodněnému strachu z potenciálu drogy pro závislost a zneužívání. Zatímco morfin je jasně návykový, západní lékaři se domnívají, že stojí za to použít drogu a poté pacienta odstavit, když léčba skončí.
Reference
externí odkazy
- "Morfin" . Informační portál o drogách . Americká národní lékařská knihovna.
- Morfin a heroin v periodické tabulce videí (University of Nottingham)
- Video: Nitrožilní nakládání morfinu (Vimeo) (YouTube) - Krátké vzdělávací video, které učí zdravotníky o hlavních bodech intravenózního podávání analgetik, zejména morfinu.