Myelin - Myelin
| Myelin | |
|---|---|
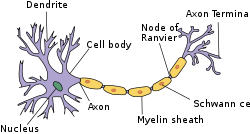 Struktura zjednodušeného neuronu v PNS
| |
 Neuron s oligodendrocytovým a myelinovým pláštěm v CNS
| |
| Podrobnosti | |
| Systém | Nervový systém |
| Identifikátory | |
| FMA | 62977 |
| Anatomická terminologie | |
Myelin je látka bohatá na lipidy (mastná), která obklopuje axony nervových buněk („dráty“ nervového systému), aby je izolovala a zvýšila rychlost, kterou jsou podél axonu vedeny elektrické impulsy (nazývané akční potenciály ). Myelinovaný axon lze přirovnat k elektrickému drátu (axon) s izolačním materiálem (myelin) kolem něj. Na rozdíl od plastového obalu na elektrickém vodiči však myelin netvoří po celé délce axonu jediné dlouhé pouzdro. Myelin spíše obaluje nerv v segmentech: obecně je každý axon obalen několika dlouhými myelinizovanými úseky s krátkými mezerami mezi nazývanými Ranvierovými uzly .
Myelin je tvořen v centrálním nervovém systému (CNS; mozek, mícha a zrakový nerv) gliovými buňkami nazývanými oligodendrocyty a v periferním nervovém systému (PNS) gliovými buňkami zvanými Schwannovy buňky . V CNS přenášejí axony elektrické signály z jednoho těla nervových buněk do druhého. V PNS přenášejí axony signály do svalů a žláz nebo ze smyslových orgánů, jako je kůže. Každý myelinový obal je vytvořen soustředným obalením procesu oligodendrocytů (CNS) nebo Schwannových buněk (PNS) (končetinové rozšíření z těla buňky) kolem axonu . Myelin snižuje kapacitu axonální membrány. Na molekulární úrovni v internodech zvyšuje vzdálenost mezi extracelulárními a intracelulárními ionty, čímž se snižuje hromadění nábojů. Nespojitá struktura myelinové pochvy má za následek slané vedení , přičemž akční potenciál „přeskočí“ z jednoho Ranvierova uzlu, přes dlouhý myelinizovaný úsek axonu nazývaného internoda, než se „dobije“ v dalším Ranvierově uzlu, a tak dále zapnuto, dokud nedosáhne axonového terminálu . Ranvierovy uzly jsou krátké (asi 1 mikron ) nemyelinizované oblasti axonu mezi sousedními dlouhými (asi 0,2 mm -> 1 mm) myelinizovanými internody. Jakmile dosáhne axonového terminálu, tento elektrický signál vyvolá uvolnění chemické zprávy nebo neurotransmiteru, který se váže na receptory na sousední postsynaptické buňce (např. Nervová buňka v CNS nebo svalová buňka v PNS) ve specializovaných oblastech zvaných synapse .
Tato „izolační“ role pro myelin je nezbytná pro normální motorické funkce (tj. Pohyb, jako je chůze), smyslové funkce (např. Sluch, vidění nebo pocit pocitu bolesti) a poznávání (např. Získávání a vyvolávání znalostí), což dokládají důsledky poruch, které ji ovlivňují, jako jsou geneticky podmíněné leukodystrofie ; získaná zánětlivá demyelinizační porucha , roztroušená skleróza ; a zánětlivé demyelinizační periferní neuropatie . Pro svou vysokou prevalenci je roztroušená skleróza, která specificky postihuje centrální nervový systém (mozek, mícha a zrakový nerv), nejznámější poruchou myelinu.
Rozvoj
Proces generování myelinu se nazývá myelinizace nebo myelinogeneze . V CNS se progenitorové buňky oligodendrocytů (OPC) diferencují na zralé oligodendrocyty, které tvoří myelin. U lidí začíná myelinizace brzy ve 3. trimestru, ačkoli v CNS nebo PNS je v době narození přítomno pouze malé množství myelinu. V kojeneckém věku myelinace postupuje rychle, přičemž rostoucí počet axonů získává myelinové pochvy. To koresponduje s rozvojem kognitivních a motorických schopností, včetně porozumění jazyku, osvojování řeči, procházení a chůze. Myelinizace pokračuje přes dospívání a ranou dospělost a přestože je v této době z velké části kompletní, myelinové pochvy mohou být přidávány do oblastí šedé hmoty , jako je mozková kůra , po celý život.
Distribuce druhů
Myelin je považován za určující charakteristiku čelistních obratlovců ( gnathostomes ), ačkoli u bezobratlých jsou axony obaleny typem buňky, nazývané gliové buňky. Tyto gliové zábaly se zcela liší od kompaktního myelinu obratlovců, který je vytvořen, jak je uvedeno výše, soustředným obalením procesu myelinizačních buněk několikrát kolem axonu. Myelin byl poprvé popsán v roce 1854 Rudolfem Virchowem , ačkoli o více než století později, po vývoji elektronové mikroskopie, se ukázal jeho původ v gliových buňkách a ultrastruktura.
U obratlovců nejsou všechny axony myelinizovány. Například v PNS je velká část axonů nemyelinizována. Místo toho jsou obaleny nemyelinizačními Schwannovými buňkami známými jako Remak SC a uspořádány ve svazcích Remak . V CNS, ne-myelinated axonů (nebo přerušovaně myelinated axonů, což znamená, axony s dlouhými regiony non-myelinated mezi myelinových segmenty) se mísí s těmi myelinových a jsou propletená, alespoň částečně, použité ve způsobu podle jiného typu buněk glie astrocytů .
Složení


- Axon
- Jádro Schwannovy buňky
- Schwannova buňka
- Myelinová vrstva
- Neurilemma
CNS myelin se mírně liší složením a konfigurací od PNS myelinu, ale oba plní stejnou "izolační" funkci (viz výše). Jelikož je myelin bohatý na lipidy, jeví se jako bílý, odtud název „ bílá hmota “ CNS. Trakty bílé hmoty CNS (např. Zrakový nerv , kortikospinální trakt a corpus callosum ) i nervy PNS (např. Sedací nerv a sluchový nerv , které také vypadají bílé) obsahují tisíce až miliony axonů, do značné míry paralelně zarovnaných. Krevní cévy poskytují cestu kyslíkovým a energetickým substrátům, jako je glukóza, k dosažení těchto vláknitých traktů, které také obsahují další typy buněk včetně astrocytů a mikroglií v CNS a makrofágů v PNS.
Pokud jde o celkovou hmotnost, myelin obsahuje přibližně 40% vody; suchá hmota obsahuje mezi 60% a 75% lipidu a mezi 15% a 25% proteinu . Obsah proteinů zahrnuje myelinový základní protein (MBP), který je hojný v CNS, kde hraje kritickou, neredundantní roli při tvorbě kompaktního myelinu; myelinový oligodendrocytový glykoprotein (MOG), který je specifický pro CNS; a proteolipidový protein (PLP), což je nejhojnější protein v CNS myelinu, ale pouze malá složka PNS myelinu. V PNS má myelinový protein nula (MPZ nebo P0) podobnou roli jako PLP v CNS v tom, že se podílí na držení pohromadě více koncentrických vrstev membrány gliových buněk, které tvoří myelinový obal. Primárním lipidem myelinu je glykolipid zvaný galactocerebroside . Propletené uhlovodíkové řetězce sfingomyelinu posilují myelinové pochvy. Cholesterol je esenciální lipidová složka myelinu, bez které se myelin nevytváří.
Funkce

Hlavním účelem myelinu je zvýšit rychlost šíření elektrických impulzů podél myelinizovaného vlákna. V nemyelinizovaných vláknech se elektrické impulsy ( akční potenciály ) pohybují jako spojité vlny, ale v myelinizovaných vláknech „hopsají“ nebo se šíří slaným vedením . Ten je výrazně rychlejší než ten první, alespoň u axonů přes určitý průměr. Myelin snižuje kapacitu a zvyšuje elektrický odpor přes axonální membránu ( axolemma ). Bylo navrženo, že myelin umožňuje větší velikost těla udržováním agilní komunikace mezi vzdálenými částmi těla.
Myelinizovaná vlákna postrádají napěťově řízené sodíkové kanály podél myelinizovaných internodů a vystavují je pouze v uzlech Ranvier . Zde jsou velmi hojné a hustě zabalené. Pozitivně nabité sodné ionty mohou vstoupit do axonu těmito napěťově řízenými kanály, což vede k depolarizaci membránového potenciálu v Ranvierově uzlu. Klidový membránový potenciál je pak rychle obnoví vzhledem k pozitivně nabité ionty draslíku opouštějících axon přes draslíkových kanálů . Sodné ionty uvnitř axonu pak rychle difundují axoplazmou (axonální cytoplazmou ), do sousední myelinizované internody a nakonec do dalšího ( distálního ) uzlu Ranvier, čímž se spustí otevření napěťově řízených sodíkových kanálů a vstup sodíkových iontů v tomto případě stránky. Ačkoli sodné ionty difundují axoplazmou rychle, difúze je od přírody dekrementální, takže Ranvierovy uzly musí být (relativně) blízko sebe, aby se zajistilo šíření akčního potenciálu. Akční potenciál se „dobíjí“ v po sobě jdoucích uzlech Ranvier, protože potenciál axolemické membrány se depolarizuje na přibližně +35 mV. Podél myelinizované internody čerpají energeticky závislá sodíková/draselná čerpadla čerpadla sodíkové ionty zpět z axonu a ionty draslíku zpět do axonu, aby obnovily rovnováhu iontů mezi intracelulárními (uvnitř buňky, tj. V tomto případě axonem) a extracelulárními (mimo buňku) tekutiny.
Zatímco role myelinu jako „axonálního izolátoru“ je dobře zavedená, jiné funkce myelinizačních buněk jsou méně známé nebo teprve nedávno zavedené. Tyto myelinating buňka „vyřezává“ podkladových axon podporou fosforylace v neurofilaments , čímž se zvyšuje průměr nebo tloušťka axonu v meziuzlových regionů; pomáhá shlukovat molekuly na axolemmu (jako jsou napěťově řízené sodíkové kanály) v uzlu Ranvier; a moduluje transport cytoskeletálních struktur a organel, jako jsou mitochondrie , podél axonu. V roce 2012 vyšly najevo důkazy na podporu role myelinizační buňky při „krmení“ axonu. Jinými slovy, zdá se, že myelinizační buňka funguje jako místní „čerpací stanice“ pro axon, který po generování akčních potenciálů využívá velké množství energie k obnovení normální rovnováhy iontů mezi ní a okolním prostředím .
Když je periferní vlákno přerušeno, myelinový plášť poskytuje stopu, po které může dojít k opětovnému růstu. Myelinová vrstva však nezajišťuje dokonalou regeneraci nervového vlákna. Některá regenerovaná nervová vlákna nenacházejí správná svalová vlákna a některé poškozené motorické neurony periferního nervového systému hynou bez opětovného růstu. Poškození myelinové pochvy a nervového vlákna je často spojeno se zvýšenou funkční nedostatečností.
Nemyelinizovaná vlákna a myelinizované axony savčího centrálního nervového systému se neregenerují.
Klinický význam
Demyelinizace
Demyelinizace je ztráta myelinové pochvy izolační nervy a je charakteristickým znakem některých neurodegenerativních autoimunitních onemocnění, včetně roztroušené sklerózy , akutní diseminované encefalomyelitidy , neuromyelitis optica , příčná myelitida , chronické zánětlivé demyelinizační polyneuropatie , Guillain-Barrého syndrom , centrál pontine myelinosis , dědičná demyelinizační onemocnění, jako je leukodystrofie a Charcot – Marie – Toothova nemoc . Trpící zhoubná anémie může také utrpět poškození nervů, pokud není stav diagnostikován rychle. Subakutní kombinovaná degenerace míchy sekundární k perniciózní anémii může vést k mírnému poškození periferních nervů až k vážnému poškození centrálního nervového systému, což ovlivňuje řeč, rovnováhu a kognitivní uvědomění. Když se myelin degraduje, vedení signálů podél nervu může být narušeno nebo ztraceno a nerv nakonec chřadne. Vážnější případ zhoršení myelinu se nazývá Canavanova choroba .
Imunitní systém může hrát roli v demyelinizace spojené s takovými chorobami, včetně zánětu způsobující demyelinizaci nadprodukcí cytokinů prostřednictvím upregulace nádorového nekrotického faktoru nebo interferonem . Důkazy z magnetické rezonance, že DHA ethylester kyseliny dokosahexaenové zlepšuje myelinizaci u generalizovaných peroxisomálních poruch.
Příznaky
Demyelinizace vede k různým symptomům určeným funkcemi postižených neuronů. Naruší signály mezi mozkem a jinými částmi těla; příznaky se liší od pacienta k pacientovi a mají různé projevy při klinickém pozorování a laboratorních studiích.
Mezi typické příznaky patří rozmazání v centrálním zorném poli, které postihuje pouze jedno oko, může být doprovázeno bolestí při pohybu očí, dvojitým viděním, ztrátou zraku/sluchu, zvláštními pocity v nohou, pažích, hrudníku nebo obličeji, jako je brnění nebo necitlivost ( neuropatie ), slabost rukou nebo nohou, kognitivní poruchy, včetně poruchy řeči a ztráty paměti, citlivost na teplo (příznaky se zhoršují nebo se znovu objevují po působení tepla, jako je horká sprcha), ztráta obratnosti, potíže s koordinací pohybu nebo poruchy rovnováhy, potíže s kontrolou pohybů střev nebo močení, únava a tinnitus.
Oprava myelinu
Pokračuje výzkum oprav poškozených myelinových pochev. Techniky zahrnují chirurgickou implantaci prekurzorových buněk oligodendrocytů do centrálního nervového systému a indukci opravy myelinu určitými protilátkami . Přestože výsledky u myší byly povzbudivé (prostřednictvím transplantace kmenových buněk ), stále není známo, zda tato technika může být účinná při nahrazování ztráty myelinu u lidí. Cholinergní léčba , jako jsou inhibitory acetylcholinesterázy (AChEI), může mít příznivé účinky na myelinizaci, opravu myelinu a integritu myelinu. Zvýšení cholinergní stimulace může také působit prostřednictvím jemných trofických účinků na procesy vývoje mozku a zejména na oligodendrocyty a celoživotní proces myelinizace, který podporují. Zvýšení cholinergní stimulace oligodendrocytů , AChEI a další cholinergní léčby, jako je nikotin , by pravděpodobně mohly podpořit myelinizaci během vývoje a opravu myelinu ve vyšším věku. Bylo zjištěno, že inhibitory glykogen syntázy kinázy 3β , jako je chlorid lithný, podporují myelinizaci u myší s poškozenými obličejovými nervy. Cholesterol je nezbytnou živinou pro myelinový plášť spolu s vitamínem B12 .
Dysmyelinace
Dysmyelinizace je charakterizována defektní strukturou a funkcí myelinových pochev; na rozdíl od demyelinizace nevytváří léze . Takové defektní pochvy často pocházejí z genetických mutací ovlivňujících biosyntézu a tvorbu myelinu. Shiverer myš představuje jednu zvířecí model dysmyelinizaci. Mezi lidské choroby, u nichž se předpokládá dysmyelinizace, patří leukodystrofie ( Pelizaeus – Merzbacherova choroba , Canavanova choroba , fenylketonurie ) a schizofrenie .
Bezobratlý myelin
Funkčně ekvivalentní myelin podobné obaly se nacházejí v několika taxonů bezobratlých, včetně máloštětinatých , penaeids , palaemonids a calanoids . Tyto pochvy podobné myelinům mají několik strukturálních rysů s pochvami nalezenými u obratlovců, včetně mnohočetnosti membrán, kondenzace membrány a uzlů. Uzly u obratlovců jsou však prstencové; tj. obklopují axon. Naproti tomu uzly nacházející se v pochvách bezobratlých jsou buď prstencové, nebo fenestrované; tj. jsou omezeni na „skvrny“. Je pozoruhodné, že nejrychlejší zaznamenaná rychlost vedení (na obratlovcích i bezobratlých) se nachází v opláštěných axonech krevety Kuruma , bezobratlých, v rozmezí 90 až 200 m/s ( srov. 100–120 m/s pro nejrychlejší myelinizovaný axon obratlovců).
Viz také
- Lesionální demyelinizace centrálního nervového systému
- Myelinový asociovaný glykoprotein
- Myelin volný čas
- Projekt Myelin , projekt regenerace myelinu
- Myelin Repair Foundation , nezisková nadace lékařského výzkumu pro objevování léků na roztroušenou sklerózu .
Reference
Další čtení
- Fields, R. Douglas, „Mozek se učí neočekávanými způsoby: Neurologové objevili soubor neznámých buněčných mechanismů pro vytváření nových vzpomínek“, Scientific American , sv. 322, č. 3 (březen 2020), s. 74–79. "Myelin, dlouho považovaný za inertní izolaci na axonech , je nyní považován za příspěvek k učení tím, že řídí rychlost, kterou signály procházejí nervovým zapojením." (str. 79.)
- Swire M, Ffrench-Constant C (květen 2018). „Vidět znamená věřit: Myelin Dynamics v CNS dospělých“ . Neuron . 98 (4): 684–686. doi : 10,1016/j.neuron.2018.05.005 . PMID 29772200 .
- Waxman SG (říjen 1977). „Vedení v myelinizovaných, nemyelinizovaných a demyelinizovaných vláknech“. Archivy neurologie . 34 (10): 585–9. doi : 10,1001/archneur.1977,00500220019003 . PMID 907529 .
