Nociceptor - Nociceptor
| Nociceptor | |
|---|---|
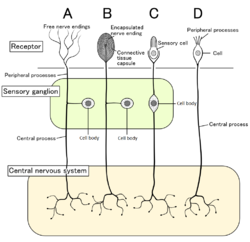 Čtyři typy senzorických neuronů a jejich receptorové buňky. Nociceptory zobrazené jako volná nervová zakončení typu A
| |
| Identifikátory | |
| Pletivo | D009619 |
| Anatomická terminologie | |
Nociceptor ( „receptor bolest“) je smyslový neuron , který reaguje na poškození nebo potenciálně poškozující podněty vysláním „možné ohrožení“ signály do míchy a mozku. Pokud mozek vnímá hrozbu jako důvěryhodnou, vytváří pocit bolesti, který směřuje pozornost k části těla, takže je možné tuto hrozbu snad zmírnit; tento proces se nazývá nocicepce .
Dějiny
Nociceptory objevil Charles Scott Sherrington v roce 1906. V dřívějších stoletích vědci věřili, že zvířata jsou jako mechanická zařízení, která transformují energii smyslových podnětů na motorické reakce. Sherrington používá mnoho různých experimentů prokázat, že různé typy stimulace na aferentní nervová vlákna je vnímavý pole vedlo k různým odpovědí. Některé intenzivní podněty vyvolávají stažení reflexu , určité autonomní reakce a bolest . Specifické receptory pro tyto intenzivní podněty se nazývaly nociceptory.
Umístění
U savců se nociceptory nacházejí v jakékoli oblasti těla, která cítí škodlivé podněty. Externí nociceptory se nacházejí v tkáni , jako je kůže ( kožní nociceptory ), rohovka a sliznice . Vnitřní nociceptory se nacházejí v různých orgánech, jako jsou svaly , klouby , močový měchýř , viscerální orgány a trávicí trakt. Buněčná těla těchto neuronů se nacházejí buď v gangliích hřbetních kořenů, nebo v trigeminálních gangliích. Trigeminální ganglia jsou specializované nervy pro obličej, zatímco ganglia dorzálních kořenů jsou spojena se zbytkem těla. Axony zasahují do periferního nervového systému a končí ve větvích, aby vytvořily receptivní pole.
Rozvoj
Nociceptory se vyvíjejí z kmenových buněk neurální lišty . Neurální hřeben je zodpovědný za velkou část raného vývoje u obratlovců. Je specificky zodpovědný za vývoj periferního nervového systému (PNS). Kmenové buňky neurální lišty se při jejím uzavření štěpí z neurální trubice a nociceptory rostou z dorzální části této tkáně neurální lišty. Během neurogeneze se tvoří pozdě. Dříve se tvořící buňky z této oblasti se mohou stát receptory necitlivými na bolest, buď proprioceptory, nebo nízkoprahové mechanoreceptory . Všechny neurony odvozené z neurální lišty, včetně embryonálních nociceptorů, exprimují TrkA, což je receptor pro nervový růstový faktor (NGF). Transkripční faktory, které určují typ nociceptoru, však zůstávají nejasné.
Po senzorické neurogenezi dochází k diferenciaci a vytvářejí se dva typy nociceptorů. Jsou klasifikovány buď jako peptidergní nebo nepeptidergní nociceptory, z nichž každý exprimuje odlišný repertoár iontových kanálů a receptorů. Jejich specializace umožňuje receptorům inervovat různé centrální a periferní cíle. K této diferenciaci dochází v perinatálním i postnatálním období. Nepeptidergické nociceptory vypnou TrkA a začnou exprimovat Ret, což je transmembránová signalizační složka, která umožňuje expresi růstového faktoru odvozeného z gliových buněk (GDNF). Tomuto přechodu napomáhá Runx1, který je životně důležitý při vývoji nepeptidergních nociceptorů. Peptidergní nociceptory naopak nadále používají TrkA a exprimují zcela odlišný typ růstového faktoru. V současné době existuje mnoho výzkumů o rozdílech mezi nociceptory.
Typy a funkce
Periferní terminál zralého nociceptoru je místem, kde jsou detekovány škodlivé podněty a přeneseny do elektrické energie. Když elektrická energie dosáhne prahové hodnoty, je indukován akční potenciál a je veden směrem k centrálnímu nervovému systému (CNS). To vede k vlaku událostí, který umožňuje vědomé uvědomění si bolesti. Senzorická specificita nociceptorů je stanovena vysokým prahem pouze pro konkrétní rysy podnětů. Noc receptory se spustí pouze tehdy, když bylo dosaženo vysokého prahu chemickým, tepelným nebo mechanickým prostředím. Většina nociceptorů je klasifikována podle toho, na které z environmentálních modalit reagují. Některé nociceptory reagují na více než jednu z těchto modalit a jsou proto označeny jako polymodální. Jiné nociceptory nereagují na žádnou z těchto modalit (i když mohou reagovat na stimulaci za podmínek zánětu) a jsou označovány jako spící nebo tiché.
Nociceptory mají dva různé typy axonů. Prvním jsou vláknové axony Aδ . Jsou myelinizovány a mohou umožnit akčnímu potenciálu cestovat rychlostí asi 20 metrů za sekundu směrem k CNS. Druhým typem jsou pomaleji vodivé axony C vláken . Ty vedou pouze rychlostí kolem 2 metrů za sekundu. To je způsobeno světlem nebo nemyelinizací axonu. Výsledkem je, že bolest přichází ve dvou fázích. První fáze je zprostředkována rychle vodivými vlákny Aδ a druhá část díky (polymodálním) C vláknům. Bolest spojená s vlákny Aδ může být spojena s počáteční extrémně ostrou bolestí. Druhou fází je prodloužený a o něco méně intenzivní pocit bolesti v důsledku akutního poškození. Pokud dochází k masivnímu nebo dlouhodobému vstupu do vlákna C, dochází k postupnému hromadění v míšním hřbetním rohu; tento jev je podobný tetanu ve svalech, ale nazývá se navíjení . Pokud dojde k navíjení, existuje pravděpodobnost zvýšené citlivosti na bolest.
Tepelný
Tepelné nociceptory se aktivují škodlivým teplem nebo chladem při různých teplotách. Existují specifické snímače nociceptorů, které jsou zodpovědné za to, jak a zda konkrétní nervové zakončení reaguje na tepelný podnět. První, kdo byl objeven, byl TRPV1 a má prahovou hodnotu, která se shoduje s teplotou bolesti tepla 43 ° C. Jiná teplota v teplém a horkém rozsahu je zprostředkována více než jedním kanálem TRP . Každý z těchto kanálů vyjadřuje konkrétní C-koncovou doménu, která odpovídá citlivosti teplého a horkého. Interakce mezi všemi těmito kanály a způsob, jakým je teplota stanovena nad prahem bolesti, nejsou v tuto chvíli známy. Chladné podněty jsou snímány kanály TRPM8 . Jeho C-koncová doména se liší od tepelně citlivých TRP. Ačkoli tento kanál odpovídá chladným podnětům, stále není známo, zda také přispívá k detekci intenzivního chladu. Zajímavým zjištěním souvisejícím s chladovými podněty je, že hmatová citlivost a motorické funkce se zhoršují, zatímco vnímání bolesti přetrvává.
Mechanické
Mechanické nociceptory reagují na přetlak nebo mechanickou deformaci. Reagují také na řezy, které lámou povrch kůže. Reakce na podnět je kůrou zpracována jako bolest, stejně jako chemické a tepelné reakce. Tyto mechanické nociceptory mají často polymodální charakteristiky. Je tedy možné, že některé snímače pro tepelné podněty jsou stejné pro mechanické podněty. Totéž platí pro chemické podněty, protože se zdá, že TRPA1 detekuje jak mechanické, tak chemické změny. Některé mechanické podněty mohou způsobit uvolnění meziproduktů, jako je ATP , který může být detekován purinergními receptory P2 nebo nervový růstový faktor , který lze detekovat pomocí kinázy A tropomyosin receptoru (TrkA) .
Chemikálie
Chemické nociceptory mají TRP kanály, které reagují na širokou škálu koření. Ten, který vidí největší odezvu a je velmi široce testován, je kapsaicin . Dalšími chemickými stimulanty jsou dráždivé látky pro životní prostředí, jako je akrolein , chemická zbraň z první světové války a součást cigaretového kouře. Kromě těchto vnějších stimulantů mají chemické nociceptory schopnost detekovat endogenní ligandy a určité aminy mastných kyselin, které vznikají změnami ve vnitřních tkáních. Stejně jako v tepelných nociceptorech může TRPV1 detekovat chemikálie jako kapsaicin a pavoučí toxiny a kyseliny. Kyselé iontové kanály (ASIC) také detekují kyselost.
Spící/tichý
Ačkoli každý nociceptor může mít řadu možných prahových úrovní, některé nereagují vůbec na chemické, tepelné nebo mechanické podněty, pokud skutečně nedošlo ke zranění. Ty jsou obvykle označovány jako tiché nebo spící nociceptory, protože jejich reakce přichází pouze při nástupu zánětu do okolní tkáně.
Polymodální
Mnoho neuronů plní pouze jednu funkci; proto mají neurony, které tyto funkce provádějí v kombinaci, klasifikaci „polymodální“.
Cesta
Vzestupně
Aferentní nociceptivní vlákna (ty, které informace poslat na , spíše než z mozku) cestovat zpátky do míchy , kde vytvářejí synapse ve svém zadním rohu . Toto nociceptivní vlákno (umístěné na periferii) je neuronem prvního řádu. Tyto buňky v dorzálním rohu jsou rozděleny do fyziologicky odlišných vrstev zvaných laminy. Různé typy vláken tvoří synapse v různých vrstvách a jako neurotransmiter používají buď glutamát nebo látku P. Vlákna Aδ tvoří synapse v laminach I a V, vlákna C se spojují s neurony v lamině II, vlákna Ap se spojují s laminou I, III, & V. Po dosažení specifické laminy v míše nociceptivní projekt prvního řádu na neurony druhého řádu které protínají středovou čáru v přední bílé komisuře. Neurony druhého řádu poté posílají své informace dvěma cestami do thalamu : mediálně-lemniskální systém hřbetního sloupce a anterolaterální systém . První z nich je vyhrazena spíše pro pravidelný bolestivý pocit, zatímco druhá je vyhrazena pro pocit bolesti. Po dosažení thalamu jsou informace zpracovány ve ventrálním zadním jádru a odeslány do mozkové kůry v mozku prostřednictvím vláken v zadní končetině vnitřní kapsle.
Klesající
Protože existuje vzestupná cesta do mozku, která iniciuje vědomou realizaci bolesti, existuje také sestupná cesta, která moduluje pocit bolesti. Mozek může požadovat uvolnění specifických hormonů nebo chemikálií, které mohou mít analgetické účinky, které mohou snížit nebo potlačit pocit bolesti. Oblast mozku, která stimuluje uvolňování těchto hormonů, je hypotalamus . Tento účinek sestupné inhibice lze ukázat elektrickou stimulací periaqueduktální šedé oblasti středního mozku nebo periventrikulárního jádra . Oba zase promítají do dalších oblastí zapojených do regulace bolesti, jako je například nucleus raphe magnus, který také přijímá podobné aferenty z jádra reticularis paragigantocellularis (NPG). Na druhé straně jádro raphe magnus promítá do oblasti substantia gelatinosa hřbetního rohu a zprostředkovává pocit spinothalamických vstupů. To se provádí nejprve tím, že nucleus raphe magnus posílá serotoninergní neurony do neuronů v dorzální šňůře, které zase vylučují enkefalin do interneuronů, které nesou vnímání bolesti. Enkefalin funguje tak, že váže opioidní receptory a způsobuje inhibici postsynaptického neuronu, čímž tlumí bolest. Periaqueduktální šedá obsahuje také opioidní receptory, což vysvětluje jeden z mechanismů, kterými opioidy, jako je morfin a diacetylmorfin, vykazují analgetický účinek.
Citlivost
Citlivost neuronů nociceptoru je modulována velkým množstvím mediátorů v extracelulárním prostoru. Periferní senzibilizace představuje formu funkční plasticity nociceptoru. Nocceptor se může změnit z prostého detektoru škodlivých podnětů na detektor nejedovatých podnětů. Výsledkem je, že podněty nízké intenzity z pravidelné činnosti vyvolávají bolestivý pocit. Toto je běžně známé jako hyperalgezie . Zánět je jednou z běžných příčin, které vedou k senzibilizaci nociceptorů. Hyperalgezie obvykle ustává, když zánět klesá, někdy však mohou genetické vady a/nebo opakované poranění vyústit v alodýnii : zcela neškodný podnět, jako je lehký dotyk, způsobuje extrémní bolest. Alodynie může být také způsobena poškozením nociceptoru v periferních nervech. To může mít za následek deaferentaci, což znamená vývoj různých centrálních procesů z přežívajícího aferentního nervu. V této situaci mohou přežívající dorzální kořenové axony nociceptorů navázat kontakt s míchou, čímž se změní normální vstup.
Ostatní zvířata
Nocicepce byla zdokumentována u savců, včetně ryb a širokého spektra bezobratlých , včetně pijavic , červů hlístic , mořských slimáků a larev ovocných mušek . Ačkoli tyto neurony mohou mít různé cesty a vztahy k centrálnímu nervovému systému než nociceptory savců, nociceptivní neurony u savců často vystřelují v reakci na podobné podněty jako savci, jako je vysoká teplota (40 stupňů C nebo více), nízké pH , kapsaicin a poškození tkáně.
Terminologie
Kvůli historickému chápání bolesti se nociceptory také nazývají receptory bolesti . Ačkoli je bolest skutečná, psychologické faktory mohou silně ovlivnit subjektivní intenzitu.
Viz také
- Kapsaicin a jeho mechanismus účinku v nociceptorech.
- Piperin z černého pepře
- TRPC iontový kanál
