Opiát - Opiate
Opiát , v klasické farmakologie, je látka odvozená od opia . V modernějším použití je termín opioid používán k označení všech látek, přírodních i syntetických, které se vážou na opioidní receptory v mozku (včetně antagonistů). Opiáty jsou alkaloid sloučeniny přirozeně nacházejí v mák setý rostliny Papaver somniferum . Psychoaktivní sloučeniny nalezené v rostlině opia zahrnují morfin , kodein a thebain . Opiáty se již dlouho používají v různých zdravotních stavech s důkazy o obchodu s opiáty a jejich použití k úlevě od bolesti již v osmém století našeho letopočtu. Opiáty jsou považovány za drogy se středním až vysokým potenciálem zneužívání a jsou uvedeny v různých „Plánech kontroly látky“ podle zákona o jednotných kontrolovaných látkách Spojených států amerických.
V roce 2014 užívalo opiáty rekreačně 13 až 20 milionů lidí (0,3% až 0,4% celosvětové populace ve věku 15 až 65 let). Podle CDC z této populace zaznamenalo v letech 2000–2014 zaznamenaných 47 000 úmrtí s celkovým počtem půl milionu úmrtí. V roce 2016 Světová zdravotnická organizace uvedla, že 27 milionů lidí trpí poruchou zneužívání opioidů. Rovněž uvedli, že v roce 2015 zemřelo na následky užívání drog 450 000 lidí, přičemž třetina a polovina tohoto počtu byla přičítána opioidům.
Přehled
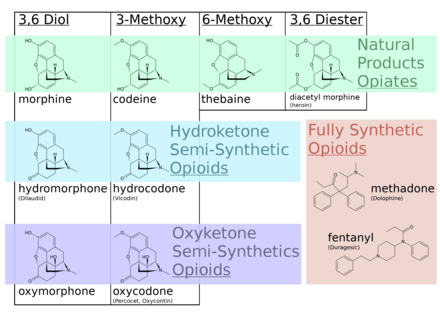
Opiáty patří do velké biosyntetické skupiny benzylisochinolinových alkaloidů a jsou pojmenovány tak, že jsou to přirozeně se vyskytující alkaloidy nacházející se v máku setém. Hlavními psychoaktivními opiáty jsou morfin , kodein a thebain . Papaverin , noskapin , a přibližně 24 další alkaloidy jsou také přítomné v opiu, ale mají malý nebo žádný účinek na lidské centrální nervový systém . Alkaloidy, které nemají žádný účinek na centrální nervový systém, nejsou považovány za opiáty. Ve výjimečných případech jsou v testech opia detekována velmi malá množství hydrokodonu a hydromorfonu ; zdá se, že je produkován rostlinou za okolností a procesů, které v tuto chvíli nejsou známy a mohou zahrnovat působení bakterií. Dihydrokodein , oxymorfol , oxykodon , oxymorfon , metopon a případně další deriváty morfinu a/nebo hydromorfonu se také nacházejí ve stopovém množství v opiu.
Navzdory tomu, že morfin je lékařsky nejvýznamnějším opiátem, větší množství kodeinu se spotřebovává z lékařského hlediska, většina je syntetizována z morfinu. Kodein má větší a předvídatelnější orální biologickou dostupnost, což usnadňuje titraci dávky. Kodein má také menší potenciál zneužívání než morfin, a protože je mírnější, jsou zapotřebí větší dávky kodeinu.
Účinky opiátového abstinenčního syndromu jsou spojeny s náhlým zastavením nebo omezením dlouhodobého užívání opiátů.
Projev závislosti na opiátech a zneužívání závisí na řadě faktorů, včetně farmakokinetických vlastností opiátu a predispozice uživatele na závislost.
Syntéza
I když je možná úplná syntéza opioidů z naftochinonu (Gatesova syntéza) nebo jiných jednoduchých organických výchozích materiálů, jsou to únavné a neekonomické procesy. Většina dnes používaných analgetik opiátového typu je tedy buď extrahována z Papaver somniferum, nebo syntetizována z těchto opiátů, zejména thebainu .
V roce 2015 výzkumy hlášeny úspěšné biosyntézu z thebainu a hydrokodonu použití geneticky pozměněných kvasinek . Jakmile bude tento proces zmenšen pro komerční použití, zkrátí výrobní čas z roku na několik dní a může snížit náklady o 90%.
Farmakokinetika
Kodein
Kodein je proléčivo, které se přeměňuje na morfin a působí na μ -opiátové receptory. Metabolizací enzymů CYP2D6 se přeměňuje na morfin. Jedinci, kteří mají nižší aktivitu CYP2D6, nemusí metabolizovat kodein dostatečně účinně, aby zažili jeho analgetické účinky. Naopak jedinci s vyšší aktivitou CYP2D6 mohou metabolizovat lék příliš rychle a mohou se u nich objevit vedlejší účinky závislé na dávce, jako je sedace a respirační deprese.
Fentanyl
Fentanyl je syntetický opioid strukturně podobný arylpiperidinům. Je to silný agonista μ-r receptoru, který je 80–100krát účinnější než morfin a má rychlý nástup s kratším trváním účinku než morfin. V játrech je metabolizován enzymy CYP3A4 na sloučeninu norfentanyl.
Heroin
| Látka | Nejlepší odhad |
Nízký odhad |
Vysoký odhad |
|---|---|---|---|
| Stimulanty amfetaminového typu |
34,16 | 13,42 | 55,24 |
| Konopí | 192,15 | 165,76 | 234,06 |
| Kokain | 18.20 | 13,87 | 22,85 |
| Extáze | 20.57 | 8,99 | 32,34 |
| Opiáty | 19,38 | 13,80 | 26.15 |
| Opioidy | 34,26 | 27.01 | 44,54 |
Heroin, značka diacetylmorphinu, je prvním z několika polosyntetických opioidů, které se získávají z morfinu, což je součást přírodního opia. Ačkoli je odvozen spíše z přírodního opia, než aby se v něm přímo nacházel, je běžně označován jako opiát. Heroin (diacetylmorfin) je proléčivo morfinu ; po podání je metabolizován játry na morfin. Jeden z hlavních metabolitů heroinu, 6-monoacetylmorfin (6-MAM), je také morfinovým proléčivem.
Hydromorfon
Hydromorfon se používá jako alternativa k morfinu. Má vysoký first-pass metabolismus a je primárně glukuronidován v játrech na hydromorphone-3-glucoronide (H3G). 75% hydromorfonu se vylučuje ledvinami, přičemž 7% se vylučuje jako mateřský opiát.
Meperidin
Meperidin je syntetická opiátová část arylpiperidinové třídy. Je to silný agonista μ-r receptoru s 1/10 účinnosti morfinu. Používá se k léčbě ztuhlosti a má poločas tři až čtyři hodiny. Hepatálně se metabolizuje na aktivní metabolity normeperidinu, kyseliny normepiridinové a medperidinové. Normeperidin v toxických hladinách může způsobit excitaci CNS a záchvaty.
Metadon
Metadon má ve srovnání s morfinem vyšší biologickou dostupnost a poločas. Je metabolizován na neaktivní produkt N-demetylací enzymy CYP3A4 v játrech. Má vysokou variabilitu mezi osobami kvůli různým hladinám CYP3A4 u jednotlivců. Je schválen pro léčbu středně silné až silné bolesti a závislosti na opioidech. Vzhledem k vysokému riziku lékových interakcí, jaterní toxicitě a variabilitě pacientů musí být pacienti pečlivě sledováni na klinikách metadonu .
Morfium
Z morfinu pochází také nikomorfin (morfin dinikotinát), dipropanoylmorfin (morfin dipropionát), desomorfin (dihydro-desoxy-morfin), methyldesorfin , acetylpropionylmorfin , dibenzoylmorfin , diacetyldihydromorfin a několik dalších.
Morfin je metabolizován v játrech na morfin-3-glukuronid (M3G) a morfin-6-glukuronid (M6G) a je vylučován ledvinami. Jsou také schopni přejít do hematoencefalické bariéry do mozkomíšního moku. M6G má silnou analgetickou aktivitu, váže se na opioidní receptory a je hlavním přispěvatelem k terapeutickému prospěchu morfinu. M3G nepůsobí jako analgetikum, má nízkou afinitu k opioidním receptorům a může případně antagonizovat terapeutické účinky morfinu a M6G. Kromě toho jsou vysoké dávky morfinu, a tedy M3G, spojeny s neurotoxickými vedlejšími účinky, jako je hyperalgezie , alodýnie a myoklonus .
Oxymorfon
Oxymorphone je kongenerem morfinu. Je metabolizován na 6-hydroxy-oxymorfon a oxymorfon-3-glukuronid a 40% je vylučováno jako metabolity. 6-hydroxy-oxymorfin je aktivní a existuje v poměru 1: 1 s původním léčivem. Aktivita oxymorfon-3-glukuronidu není známa.
Indikace
Opiáty se používají hlavně k léčbě bolesti s předpokladem, že pro bolest i funkci bude přínos, který převáží rizika pro pacienta. Další indikací je symptomatická úleva při nedostatku dechu , a to jak v akutním prostředí (například plicní edém ), tak u nevyléčitelně nemocných pacientů.
Při změně léků může být nutná konverze opiátové dávky vzhledem k rozdílné farmakodynamice mezi opiáty. Obecně se morfin používá jako standard pro konverzi mezi opiáty za účelem dosažení ekvivalentních analgetických účinků. Tyto rozdíly v ekvivalentech morfinu se mohou mezi formulacemi stejného léku lišit. K identifikaci pacientů s rizikem předávkování se používá výpočet celkové denní dávky pomocí ekvivalentů miligramu morfinu.
Komplikace a vedlejší účinky
Mezi běžné nežádoucí účinky spojené s užíváním opioidů patří: sedace , nevolnost , závratě, zvracení, zácpa , fyzická závislost, tolerance a respirační deprese . Z nich jsou nejčastější zácpa a nevolnost a k těmto vedlejším účinkům se nevyvinula tolerance. To je důvod, proč jsou opioidy často předepisovány změkčovače stolice nebo projímadla (polyethylenglykol, dokusát a senna).
Mezi méně časté nežádoucí účinky patří: opožděné vyprazdňování žaludku, hyperalgezie , imunologická a hormonální dysfunkce, svalová ztuhlost a myoklonus .
Užívání opiátů proti bolesti je ve zdravotnickém systému široce přijímáno. Dlouhodobá léčba chronické bolesti je však velmi kontroverzní, protože s jejím užíváním je spojeno vysoké riziko závislosti, což vede ke zneužívání a zneužívání ostatních, i když je užíváno správně. Osoby závislé na opiátech budou upřednostňovat získávání těchto drog před jinými aktivitami ve svém životě, což bude mít negativní dopad na jejich profesionální a osobní vztahy.
Chronické užívání opioidů může vést k toleranci . To často způsobuje, že pacient potřebuje vyšší a/nebo častější dávky léku, aby dosáhl požadovaných účinků.
Nežádoucí účinky závislé na koncentraci se mohou lišit v závislosti na genetickém polymorfismu uživatele, který může změnit metabolismus léčiva. Cytochrom P450 (zejména CYP2D6 ) je zodpovědný za metabolismus různých opiátů na aktivní metabolity a změny aktivity CYP450 vedou k měnícím se hladinám léčiva v séru.
Farmakologie v bolesti
Bolest je nepříjemný smyslový a emocionální zážitek spojený se skutečným nebo potenciálním poškozením tkáně. Je to základní obranná funkce, kde bolest funguje jako poplach k zabránění nebo omezení poškození tkáně. Opiáty působí na opioidní receptory, které jsou spojeny s receptory spřaženými s proteinem G proteinu (GPCR). Tyto receptory spadají do 3 tříd: receptory μ (mu) , δ (delta) a κ (kappa) .
Více než 70% opioidních receptorů jsou μ receptory, převážně lokalizované na centrálních koncích nociceptorů v dorzálním rohu míchy. Zbývajících 30% opioidních receptorů je umístěno post-synapticky na dendrity spinothalamických neuronů a interneuronů druhého řádu .
Když se opiát váže jako agonista na GPCR, bude existovat signální kaskáda vedoucí k inhibici kanálů adenylátcyklázy a iontů vápníku se stimulací kanálů iontů draslíku. Čistým účinkem těchto změn je snížený intracelulární cAMP a hyperpolarizace neuronální buňky snižující uvolňování neurotransmiteru. Touto cestou, když se opiáty vážou a aktivují mu receptor, dochází ke snížení přenosu signalizace bolesti. Tato cesta je zaměřena na vlastnosti analgézie, které jsou známé a používané pro opiáty. Další klinicky důležité role mu jsou jeho zapojení do respiračních a kardiovaskulárních funkcí, gastrointestinální peristaltika , krmení a nálada. Tyto další cesty jsou důležité, protože vysvětlují vedlejší účinky užívání opiátů, jako je respirační deprese při vysokých dávkách, zácpa při chronickém užívání a návykové vlastnosti.
Absolutní kontraindikace
Ti s následujícími podmínkami by neměli užívat opioidy:
- těžká respirační nestabilita
- akutní psychiatrická nestabilita
- nekontrolované riziko sebevraždy
- diagnostikováno zneužívání nicotinových látek
- Intervaly QTc delší než 500 milisekund, pokud je předepsán metadon
- akutní odklon kontrolovaných látek
- intolerance z předchozího zkušebního použití se specifickými opioidy
- závažné nežádoucí účinky nebo nedostatečná účinnost.
Rizikové faktory zneužití předpisu
Níže jsou uvedeny rizikové faktory zneužívání předpisu opiátů:
- minulá nebo současná historie zneužívání návykových látek
- psychiatrické poruchy, které nebyly léčeny
- pacientů mladého věku
- rodinná anamnéza zneužívání návykových látek
- sociální prostředí, které podporuje užívání návykových látek
- dlouhodobé užívání nebo léčba opioidy.
Statisticky jsou u pacientů středního věku s anamnézou užívání návykových látek a psychiatrickými komorbiditami pozorována vyšší rizika úmrtnosti, jako je sebevražda.