Fenylová skupina - Phenyl group
V organické chemii , je fenylová skupina nebo fenylový kruh , je cyklická skupina atomů se vzorcem C 6 H 5 . Fenylové skupiny úzce souvisí s benzenem a lze je považovat za benzenový kruh bez vodíku, který může být nahrazen nějakým jiným prvkem nebo sloučeninou, která slouží jako funkční skupina . Fenylové skupiny mají šest atomů uhlíku spojených dohromady v hexagonálním rovinném kruhu, z nichž pět je vázáno na jednotlivé atomy vodíku, přičemž zbývající uhlík je vázán na substituent . Fenylové skupiny jsou v organické chemii běžné . Ačkoli jsou fenylové skupiny často zobrazovány se střídáním dvojných a jednoduchých vazeb, jsou chemicky aromatické a mají stejnou délku vazby mezi atomy uhlíku v kruhu.
Nomenklatura
Obvykle se „fenylová skupina“ je synonymem k C 6 H 5 - a je reprezentován symbolem Ph, nebo archaically, cp . Benzen je někdy označován jako PhH. Fenylové skupiny jsou obecně připojeny k jiným atomům nebo skupinám. Například, trifenylmethanu (Ph 3 CH) má tři fenylové skupiny navázané na stejném uhlíku centra. Mnoho nebo dokonce většina fenylových sloučenin není pojmem „fenyl“ popsána. Například chlorderivát C 6 H 5 Cl se obvykle nazývá chlorbenzen , ačkoliv by mohl být nazýván fenyl-chlorid. Ve zvláštních (a vzácných) případech, izolované fenylové skupiny jsou detekovány: aniontu fenyl (C 6 H 5 - ), fenylová kation (C 6 H 5 + ), a fenyl radikál (C 6 H 5 • ).
Ačkoliv Ph a fenyl jednoznačně označují C 6 H 5 , substituované deriváty jsou rovněž popsány pomocí terminologie fenyl. Například, O 2 NC 6 H 4 je nitrofenyl, a F 5 C 6 je pentafluorfenyl. Monosubstituované fenylové skupiny (tj. Disubstituované benzeny) jsou spojeny s elektrofilními aromatickými substitučními reakcemi a produkty se řídí vzorem substituce arenu . Daná substituovaná fenylová sloučenina má tedy tři izomery, ortho (1,2-disubstituci), meta (1,3-disubstituci) a para (1,4-disubstituci). Disubstituovaná fenylová sloučenina (trisubstituovaný benzen) může být například 1,3,5-trisubstituovaná nebo 1,2,3-trisubstituovaná. Vyšší stupně substituce, jejichž příkladem je pentafluorfenylová skupina, existují a jsou pojmenovány podle nomenklatury IUPAC.
Etymologie
Fenyl je odvozen z francouzského slova phényle , které je zase odvozeno z řeckého φαίνω ( phaino ), „zářící“, protože první pojmenované fenylové sloučeniny byly vedlejšími produkty při výrobě a rafinaci různých plynů používaných pro osvětlení . Podle McMurryho „slovo pochází z řecké feno („ nosím světlo “), připomínající objev benzenu Michaelem Faradayem v roce 1825 z olejového zbytku zanechaného osvětlujícím plynem používaným v londýnských pouličních lampách.“
Struktura, vazba a charakterizace
Fenylové sloučeniny jsou odvozeny od benzenu (C 6 H 6 ), alespoň koncepčně a často z hlediska jejich výroby. Pokud jde o jeho elektronické vlastnosti, fenylová skupina je příbuzná vinylové skupině . Obecně je považována za skupinu indukčně odebírající (- I ) kvůli vyšší elektronegativitě sp 2 atomů uhlíku a skupině darující rezonanci (+ M ), kvůli schopnosti jejího systému π darovat elektronovou hustotu, pokud je možná konjugace . Fenylová skupina je hydrofobní . Fenylové skupiny mají tendenci odolávat oxidaci a redukci. Fenylové skupiny (jako všechny aromatické sloučeniny) mají zvýšenou stabilitu ve srovnání s ekvivalentní vazbou v alifatických (nearomatických) skupinách. Tato zvýšená stabilita je způsobena jedinečnými vlastnostmi aromatických molekulárních orbitalů .
Délky vazeb mezi atomy uhlíku ve fenylové skupině jsou přibližně 1,4 Á .
V 1 H- NMR spektroskopie, protony fenylovou skupinou obvykle mají chemické posuny kolem 7.27 ppm. Tyto chemické posuny jsou ovlivňovány proudem aromatického kruhu a mohou se měnit v závislosti na substituentech.
Příprava, výskyt a aplikace
Fenylové skupiny se obvykle zavádějí za použití činidel, která se chovají jako zdroje fenylového aniontu nebo fenylového kationtu. Reprezentativní činidla zahrnují fenyllithium (C 6 H 5 Li) a fenylmagnesiumbromid (C 6 H 5 MgBr). Elektrofily útočí na benzen za vzniku fenylových derivátů:
- C 6 H 6 + E + → C 6 H 5 E + H +
kde E + („elektrofil“) = Cl + , NO 2 + , SO 3 . Tyto reakce se nazývají elektrofilní aromatické substituce .
- Reprezentativní sloučeniny obsahující fenylové skupiny
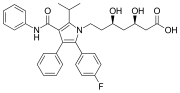
Atorvastatin (Lipitor) , trhák s dvěma fenylovými a jednou p - fluorfenylovou skupinou. Používá se ke snížení hladiny cholesterolu u lidí s hypercholesterolemií .
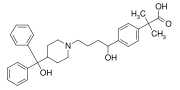
Fexofenadin (Allegra, Telfast) , další blockbuster lék, který představuje difenylmethyl, stejně jako p - fenylen (C 6 H 4 ) skupiny. Je to antihistaminikum používané k léčbě alergií .
Fenylalanin , běžná aminokyselina.
Bifenyl , sestávající ze dvou fenylových skupin. Tyto dva prstence nemají tendenci být koplanární.
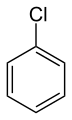
Chlorbenzen (nebo fenylchlorid), rozpouštědlo.
Fenylové skupiny se nacházejí v mnoha organických sloučeninách, přírodních i syntetických (viz obrázek). Nejběžnější mezi přírodními produkty je aminokyselina fenylalanin , která obsahuje fenylovou skupinu. Hlavním produktem petrochemického průmyslu je „ BTX “ skládající se z benzenu, toluenu a xylenu - všechny jsou stavebními kameny fenylových sloučenin. Polymer polystyren je odvozena od monomeru obsahující fenyl a vděčí za své vlastnosti tuhosti a hydrofobnosti fenylových skupin. Mnoho drog stejně jako mnoho znečišťujících látek obsahuje fenylové kruhy. Jeden z nejjednodušších sloučenin obsahující fenyl, je fenol , C 6 H 5 OH. Často se říká, že rezonanční stabilita fenolu z něj činí silnější kyselinu než u alifatických alkoholů, jako je ethanol ( p K a = 10 vs. 16–18). Nicméně, významný příspěvek je větší elektronegativita na sp 2 alfa uhlíku v fenolu ve srovnání s sp 3 alfa uhlíku v alifatické alkoholy.
Reference
externí odkazy
-
 Média související s fenylovou skupinou na Wikimedia Commons
Média související s fenylovou skupinou na Wikimedia Commons