Polymerázová řetězová reakce - Polymerase chain reaction
Polymerázová řetězová reakce ( PCR ) je metoda široce používaná k rychlé výrobě milionů až miliard kopií (úplných nebo částečných kopií) konkrétního vzorku DNA , což vědcům umožňuje odebrat velmi malý vzorek DNA a zesílit jej (nebo jeho část). it) na dostatečně velké množství, aby bylo možné podrobně studovat. PCR vymyslel v roce 1983 americký biochemik Kary Mullis ve společnosti Cetus Corporation . Je zásadní pro mnoho postupů používaných při genetickém testování a výzkumu, včetně analýzy starých vzorků DNA a identifikace infekčních agens. Pomocí PCR jsou kopie velmi malých množství sekvencí DNA exponenciálně amplifikovány v sérii cyklů teplotních změn. PCR je nyní běžnou a často nepostradatelnou technikou používanou v lékařském laboratorním výzkumu pro širokou škálu aplikací včetně biomedicínského výzkumu a kriminalistické kriminalistiky .
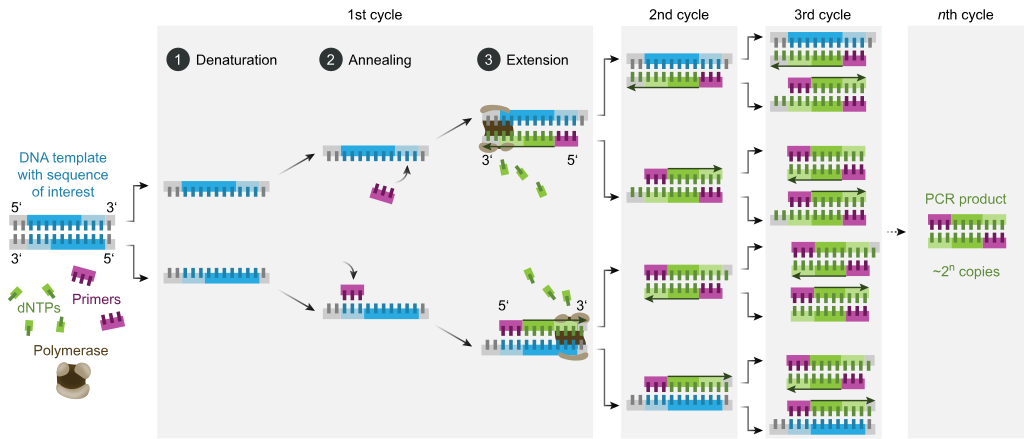
Většina metod PCR spoléhá na tepelné cyklování . Tepelné cyklování vystavuje reaktanty opakovaným cyklům zahřívání a ochlazování, což umožňuje různé reakce závislé na teplotě -konkrétně tavení DNA a replikaci DNA řízené enzymy . PCR využívá dvě hlavní činidla - primery (což jsou krátké jednovláknové fragmenty DNA známé jako oligonukleotidy, které jsou komplementární sekvencí k cílové oblasti DNA) a DNA polymerázu . V prvním kroku PCR jsou dvě vlákna dvojité šroubovice DNA fyzicky oddělena při vysoké teplotě v procesu nazývaném denaturace nukleových kyselin . Ve druhém kroku se teplota sníží a primery se vážou na komplementární sekvence DNA. Dvě vlákna DNA se pak stanou šablonami pro DNA polymerázu pro enzymatické sestavení nového řetězce DNA z volných nukleotidů , stavebních kamenů DNA. Jak postupuje PCR, generovaná DNA je sama použita jako templát pro replikaci, čímž se uvádí do pohybu řetězová reakce, ve které je původní templát DNA exponenciálně zesílen.
Téměř všechny aplikace PCR využívají tepelně stabilní DNA polymerázu, jako je Taq polymeráza , enzym původně izolovaný z termofilní bakterie Thermus aquaticus . Pokud by použitá polymeráza byla citlivá na teplo, denaturovala by za vysokých teplot denaturačního kroku. Před použitím Taq polymerázy musela být do každého cyklu ručně přidána DNA polymeráza, což byl únavný a nákladný proces.
Aplikace této techniky zahrnují klonování DNA pro sekvenování , klonování a manipulaci genů, genovou mutagenezi; Konstrukce DNA na bázi phylogenies nebo funkční analýzu genů ; diagnostiku a monitorování z genetických poruch ; amplifikace starověké DNA; analýza genetických otisků prstů pro profilování DNA (například ve forenzní vědě a testování rodičovství ); a detekce patogenů v testech nukleových kyselin pro diagnostiku infekčních chorob .

Zásady


PCR amplifikuje specifickou oblast řetězce DNA (cíl DNA). Většina metod PCR amplifikuje fragmenty DNA o délce 0,1 až 10 kilo párů bází (kbp), i když některé techniky umožňují amplifikaci fragmentů až na 40 kbp. Množství amplifikovaného produktu je určeno dostupnými substráty v reakci, které se v průběhu reakce stávají omezujícími.
Základní nastavení PCR vyžaduje několik komponent a reagencií, včetně:
- DNA templát , který obsahuje cílovou DNA oblast zesílit
- DNA polymerázy ; enzym, který polymeruje nová vlákna DNA; tepelně odolná Taq polymeráza je obzvláště běžná, protože je pravděpodobné, že zůstane neporušená během procesu denaturace DNA při vysoké teplotě
- dva DNA primery, které jsou komplementární ke 3 '(třem primárním) koncům každého z sense a anti-sense řetězců cíle DNA (DNA polymeráza se může vázat a prodlužovat pouze z dvouvláknové oblasti DNA; bez primerů, neexistuje žádné dvouvláknové iniciační místo, na které by se mohla polymeráza vázat); předem jsou vybrány specifické primery, které jsou komplementární k cílové oblasti DNA, a často jsou vyrobeny na zakázku v laboratoři nebo zakoupeny od komerčních biochemických dodavatelů
- deoxynukleosid trifosfáty nebo dNTP (někdy nazývané „deoxynukleotid trifosfáty“; nukleotidy obsahující trifosfátové skupiny), stavební bloky, ze kterých DNA polymeráza syntetizuje nové vlákno DNA
- roztok pufru vytvořením vhodného chemického prostředí pro optimální aktivitu a stabilitu DNA polymerázy
- bivalentní kationty , typicky ionty hořčíku (Mg) nebo manganu (Mn); Nejběžnější jeMg 2+ , ale Mn 2+ lze použít pro mutagenezi DNA zprostředkovanou PCR , protože vyššíkoncentraceMn 2+ zvyšuje chybovost během syntézy DNA; a monovalentní kationty , typickyionty draslíku (K)
Reakce se běžně provádí v objemu 10–200 μl v malých reakčních zkumavkách (objemy 0,2–0,5 ml) v termocykleru . Termocykler zahřívá a ochlazuje reakční zkumavky, aby dosáhl požadovaných teplot v každém kroku reakce (viz níže). Mnoho moderních tepelných cyklovačů využívá Peltierův efekt , který umožňuje jak ohřev, tak chlazení bloku držícího zkumavky PCR jednoduše obrácením elektrického proudu. Tenkostěnné reakční trubice umožňují příznivou tepelnou vodivost a umožňují rychlou tepelnou rovnováhu. Většina tepelných cyklovačů má vyhřívaná víka, aby se zabránilo kondenzaci v horní části reakční trubice. Starší termocyklery bez vyhřívaného víka vyžadují vrstvu oleje na reakční směsi nebo voskovou kouli uvnitř zkumavky.
Postup
PCR obvykle sestává ze série 20–40 opakovaných teplotních změn, nazývaných tepelné cykly, přičemž každý cyklus se obvykle skládá ze dvou nebo tří diskrétních teplotních kroků (viz obrázek níže). Cyklování často předchází jeden teplotní krok při velmi vysoké teplotě (> 90 ° C (194 ° F)) a následuje jedno přidržení na konci pro prodloužení konečného produktu nebo krátké skladování. Použité teploty a doba, po kterou jsou aplikovány v každém cyklu, závisí na řadě parametrů, včetně enzymu použitého pro syntézu DNA, koncentrace bivalentních iontů a dNTP v reakci a teploty tání ( T m ) primery. Jednotlivé kroky společné pro většinu metod PCR jsou následující:
- Inicializace : Tento krok je vyžadován pouze pro DNA polymerázy, které vyžadují aktivaci tepla pomocí PCR s horkým startem . Skládá se z ohřevu reakční komory na teplotu 94–96 ° C (201–205 ° F) nebo 98 ° C (208 ° F), pokud se používají extrémně termostabilní polymerázy, která se poté udržuje 1–10 minut.
- Denaturace : Tento krok je první pravidelnou cyklickou akcí a spočívá v zahřívání reakční komory na 94–98 ° C (201–208 ° F) po dobu 20–30 sekund. To způsobí roztavení DNA nebo denaturaci dvojvláknové DNA šablony přerušením vodíkových vazeb mezi komplementárními bázemi, čímž se získají dvě jednovláknové molekuly DNA.
- Žíhání : V dalším kroku se reakční teplota sníží na 50–65 ° C (122–149 ° F) na 20–40 sekund, což umožní připojení primerů ke každému z jednovláknových DNA templátů. Do reakční směsi jsou typicky zahrnuty dva různé primery: jeden pro každý ze dvou jednovláknových komplementů obsahujících cílovou oblast. Primery jsou samotné jednovláknové sekvence, ale jsou mnohem kratší než délka cílové oblasti a doplňují pouze velmi krátké sekvence na 3 'konci každého vlákna.
- Je důležité určit správnou teplotu pro krok žíhání, protože účinnost a specificita jsou silně ovlivněny teplotou žíhání. Tato teplota musí být dostatečně nízká, aby umožnila hybridizaci primeru na vlákno, ale dostatečně vysoká, aby byla hybridizace specifická, tj. Primer by se měl vázat pouze na dokonale komplementární část vlákna a nikde jinde. Pokud je teplota příliš nízká, základní nátěr se může nedokonale vázat. Pokud je příliš vysoký, základní nátěr se nemusí vůbec vázat. Typická teplota žíhání je asi 3–5 ° C pod T m použitých primerů. Stabilní vodíkové vazby mezi komplementárními bázemi se vytvářejí pouze tehdy, když sekvence primerů velmi shoduje se sekvencí templátu. Během tohoto kroku se polymeráza váže na hybrid primer-templát a začíná tvorba DNA.
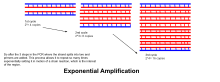
- Prodloužení/prodloužení : Teplota v tomto kroku závisí na použité DNA polymeráze; optimální teplota aktivity pro termostabilní DNA polymerázu Taq polymerázy je přibližně 75–80 ° C (167–176 ° F), ačkoli s tímto enzymem se běžně používá teplota 72 ° C (162 ° F). V tomto kroku DNA polymeráza syntetizuje nové vlákno DNA komplementární k řetězci DNA templátu přidáním volných dNTP z reakční směsi, která je komplementární k templátu ve směru 5'-na-3 ' , kondenzací 5'- fosfátové skupiny dNTP s 3'- hydroxyskupinou na konci rodícího se (prodlužujícího) řetězce DNA. Přesný čas požadovaný pro prodloužení závisí jak na použité DNA polymeráze, tak na délce cílové oblasti DNA k amplifikaci. Obecně platí, že většina DNA polymeráz při své optimální teplotě polymeruje tisíc bází za minutu. Za optimálních podmínek (tj. Pokud neexistují žádná omezení kvůli omezujícím substrátům nebo činidlům), v každém kroku prodloužení/prodloužení se počet cílových sekvencí DNA zdvojnásobí. S každým dalším cyklem se z původních templátových vláken plus všech nově generovaných vláken stanou templátová vlákna pro další kolo prodloužení, což vede k exponenciální (geometrické) amplifikaci specifické cílové oblasti DNA.
- Procesy denaturace, žíhání a prodlužování tvoří jeden cyklus. K zesílení cíle DNA na miliony kopií je zapotřebí více cyklů. Vzorec použitý pro výpočet počtu kopií DNA vytvořených po daném počtu cyklů je 2 n , kde n je počet cyklů. Výsledkem reakce nastavené na 30 cyklů je tedy 2 30 nebo 1 073 741 824 kopií původní cílové oblasti dvouřetězcové DNA.
- Konečné prodloužení : Tento jediný krok je volitelný, ale provádí se při teplotě 70–74 ° C (158–165 ° F) (teplotní rozsah požadovaný pro optimální aktivitu většiny polymeráz používaných v PCR) po dobu 5–15 minut po poslední cyklus PCR, aby se zajistilo, že veškerá zbývající jednovláknová DNA je plně prodloužena.
- Konečné držení : Poslední krok ochlazuje reakční komoru na 4–15 ° C (39–59 ° F) na dobu neurčitou a může být použit pro krátkodobé skladování produktů PCR.

Aby se zkontrolovalo, zda PCR úspěšně vygenerovala předpokládanou cílovou oblast DNA (někdy také označovanou jako zesilovač nebo amplikon ), lze pro separaci velikosti produktů PCR použít elektroforézu na agarózovém gelu . Velikost produktů PCR je určena porovnáním s DNA žebříčkem , markerem molekulové hmotnosti, který obsahuje fragmenty DNA známých velikostí, který běží na gelu vedle produktů PCR.
Fáze
Stejně jako u jiných chemických reakcí jsou rychlost reakce a účinnost PCR ovlivňovány omezujícími faktory. Celý proces PCR lze tedy dále rozdělit do tří fází na základě průběhu reakce:
- Exponenciální zesílení : V každém cyklu se množství produktu zdvojnásobí (za předpokladu 100% účinnosti reakce). Po 30 cyklech lze jednu kopii DNA zvýšit až na 1 000 000 000 (jedna miliarda) kopií. V jistém smyslu je tedy replikace diskrétního řetězce DNA manipulována v trubici za kontrolovaných podmínek. Reakce je velmi citlivá: musí být přítomno pouze nepatrné množství DNA.
- Vyrovnávání z fáze : Reakce se zpomaluje, protože DNA polymeráza ztrácí aktivitu a spotřeba reagencií, jako jsou dNTP a primery, způsobuje, že jsou omezenější.
- Plošina : Žádný další produkt se nehromadí v důsledku vyčerpání činidel a enzymu.
Optimalizace
V praxi může PCR selhat z různých důvodů, částečně kvůli své citlivosti na kontaminaci způsobující amplifikaci falešných produktů DNA. Z tohoto důvodu byla vyvinuta řada technik a postupů pro optimalizaci podmínek PCR. Kontaminace cizí DNA je řešena laboratorními protokoly a postupy, které oddělují směsi před PCR od potenciálních kontaminantů DNA. To obvykle zahrnuje prostorové oddělení oblastí nastavení PCR od oblastí pro analýzu nebo čištění produktů PCR, použití jednorázového plastového zboží a důkladné čištění pracovního povrchu mezi reakčními nastaveními. Techniky návrhu primeru jsou důležité při zlepšování výtěžku produktu PCR a při zamezení tvorby falešných produktů a použití alternativních složek pufru nebo polymerázových enzymů může pomoci při amplifikaci dlouhých nebo jinak problematických oblastí DNA. Přidání reagencií, jako je formamid , do pufračních systémů může zvýšit specificitu a výtěžek PCR. Počítačové simulace teoretických výsledků PCR ( elektronická PCR ) mohou být prováděny za účelem pomoci při návrhu primeru.
Aplikace
Selektivní izolace DNA
PCR umožňuje izolaci fragmentů DNA z genomové DNA selektivní amplifikací specifické oblasti DNA. Toto použití PCR zesiluje mnoho způsobů, jako je generování hybridizačních sond pro jižní nebo severní hybridizaci a klonování DNA , které vyžadují větší množství DNA představující specifickou oblast DNA. PCR dodává těmto technikám vysoké množství čisté DNA, což umožňuje analýzu vzorků DNA i z velmi malých množství výchozího materiálu.
Jiné aplikace PCR zahrnují sekvenování DNA k určení neznámých sekvencí amplifikovaných pomocí PCR, ve kterých může být jeden z amplifikačních primerů použit při Sangerově sekvenování , izolace sekvence DNA za účelem urychlení technologií rekombinantní DNA zahrnující vložení sekvence DNA do plazmidu , fága , nebo kosmid (v závislosti na velikosti) nebo genetický materiál jiného organismu. Bakteriální kolonie (jako je E. coli ) lze rychle skrínovat pomocí PCR na správné konstrukty vektorů DNA . PCR může být také použito pro genetické otisky prstů ; forenzní technika používaná k identifikaci osoby nebo organismu porovnáním experimentálních DNA pomocí různých metod založených na PCR.
Některé metody otisků prstů PCR mají vysokou rozlišovací schopnost a lze je použít k identifikaci genetických vztahů mezi jednotlivci, jako je rodič-dítě nebo mezi sourozenci, a používají se při testování otcovství (obr. 4). Tuto techniku lze také použít ke stanovení evolučních vztahů mezi organismy, pokud jsou použity určité molekulární hodiny (tj. 16S rRNA a recA geny mikroorganismů).
Amplifikace a kvantifikace DNA
Protože PCR zesiluje oblasti DNA, na které cílí, lze PCR použít k analýze extrémně malých množství vzorku. To je často kritické pro forenzní analýzu , kdy je jako důkaz k dispozici pouze stopové množství DNA. PCR lze také použít při analýze starověké DNA staré desítky tisíc let. Tyto techniky založené na PCR byly úspěšně použity na zvířatech, jako je čtyřicet tisíc let starý mamut , a také na lidské DNA, v aplikacích od analýzy egyptských mumií po identifikaci ruského cara a těla Anglický král Richard III .
Metody kvantitativní PCR nebo PCR v reálném čase (qPCR, nezaměňovat s RT-PCR ) umožňují odhadnout množství dané sekvence přítomné ve vzorku-technika často používaná ke kvantitativnímu stanovení úrovní genové exprese . Kvantitativní PCR je zavedený nástroj pro kvantifikaci DNA, který měří akumulaci produktu DNA po každém kole amplifikace PCR.
qPCR umožňuje kvantifikaci a detekci konkrétní sekvence DNA v reálném čase, protože měří koncentraci, zatímco probíhá proces syntézy. Existují dvě metody simultánní detekce a kvantifikace. První metoda spočívá v použití fluorescenčních barviv, která jsou nespecificky zadržována mezi dvojvlákny. Druhá metoda zahrnuje sondy, které kódují specifické sekvence a jsou fluorescenčně značeny. Detekci DNA pomocí těchto metod lze pozorovat až poté, co dojde k hybridizaci sond s její komplementární DNA. Zajímavou kombinací technik je PCR v reálném čase a reverzní transkripce. Tato sofistikovaná technika, nazývaná RT-qPCR, umožňuje kvantifikaci malého množství RNA. Prostřednictvím této kombinované techniky je mRNA převedena na cDNA, která je dále kvantifikována pomocí qPCR. Tato technika snižuje možnost chyby v koncovém bodě PCR a zvyšuje šance na detekci genů spojených s genetickými chorobami, jako je rakovina. Laboratoře používají RT-qPCR za účelem citlivého měření regulace genů. Matematické základy spolehlivé kvantifikace PCR a RT-qPCR usnadňují implementaci přesných postupů pro experimentální data ve výzkumu, lékařských, diagnostických a infekčních aplikacích.
Lékařské a diagnostické aplikace
Potenciální rodiče mohou být testováni na genetické nosiče nebo jejich děti mohou být testovány na to, že jsou skutečně postiženy nemocí . Vzorky DNA pro prenatální testování lze získat amniocentézou , odběrem choriových klků nebo dokonce analýzou vzácných fetálních buněk cirkulujících v krevním oběhu matky. PCR analýza je také nezbytná pro preimplantační genetickou diagnostiku , kde jsou jednotlivé buňky vyvíjejícího se embrya testovány na mutace.
- PCR lze také použít jako součást citlivého testu na typizaci tkáně , životně důležité pro transplantaci orgánů . Od roku 2008 existuje dokonce návrh nahradit tradiční testy na krvi podle protilátek testy založenými na PCR.
- Mnoho forem rakoviny zahrnuje změny onkogenů . Pomocí testů založených na PCR ke studiu těchto mutací lze terapeutické režimy někdy individuálně přizpůsobit pacientovi. PCR umožňuje včasnou diagnostiku maligních onemocnění, jako je leukémie a lymfomy , která je v současnosti nejrozvinutější ve výzkumu rakoviny a již se běžně používá. Testy PCR lze provádět přímo na vzorcích genomové DNA za účelem detekce maligních buněk specifických pro translokaci s citlivostí, která je alespoň 10 000krát vyšší než u jiných metod. PCR je velmi užitečná v lékařské oblasti, protože umožňuje izolaci a amplifikaci nádorových supresorů. Například kvantitativní PCR lze použít ke kvantifikaci a analýze jednotlivých buněk, stejně jako k rozpoznání potvrzení a kombinací DNA, mRNA a proteinů.
Aplikace infekčních chorob
PCR umožňuje rychlou a vysoce specifickou diagnostiku infekčních chorob, včetně těch způsobených bakteriemi nebo viry. PCR také umožňuje identifikaci nekultivovatelných nebo pomalu rostoucích mikroorganismů, jako jsou mykobakterie , anaerobní bakterie nebo viry z testů tkáňové kultury a zvířecích modelů . Základem pro diagnostické aplikace PCR v mikrobiologii je detekce infekčních agens a diskriminace nepatogenních od patogenních kmenů na základě specifických genů.
Charakterizace a detekce organismů infekčních chorob byly revoluční pomocí PCR následujícími způsoby:
- Virem lidské imunodeficience (nebo HIV ), je obtížné najít cíl a vymýtit. Nejčasnější testy na infekci vycházely z přítomnosti protilátek proti viru cirkulujících v krevním oběhu. Protilátky se však objevují až mnoho týdnů po infekci, mateřské protilátky maskují infekci novorozence a terapeutické prostředky na boj s infekcí na protilátky nemají vliv. Byly vyvinuty testy PCR, které dokážou detekovat co nejméně jeden virový genom mezi DNA více než 50 000 hostitelských buněk. Infekce mohou být detekovány dříve, darovaná krev může být vyšetřena přímo na virus, novorozenci mohou být okamžitě testováni na infekci a účinky antivirové léčby mohou být kvantifikovány .
- Některé choroboplodné zárodky, jako je například tuberkulóza , se obtížně odebírají od pacientů a pomalu se pěstují v laboratoři. Testy založené na PCR umožnily detekci malého počtu chorobných organismů (živých i mrtvých) ve vhodných vzorcích . Podrobnou genetickou analýzu lze také použít k detekci rezistence na antibiotika, což umožňuje okamžitou a efektivní terapii. Účinky terapie lze také okamžitě vyhodnotit.
- Šíření chorobného organismu populacemi domácích nebo divokých zvířat lze monitorovat pomocí testování PCR. V mnoha případech lze detekovat a sledovat výskyt nových virulentních podtypů . Podtypy organismu, které byly zodpovědné za dřívější epidemie, lze také určit pomocí analýzy PCR.
- Virovou DNA lze detekovat pomocí PCR. Použité primery musí být specifické pro cílové sekvence v DNA viru a PCR lze použít pro diagnostické analýzy nebo sekvenování DNA virového genomu. Vysoká citlivost PCR umožňuje detekci viru brzy po infekci a dokonce před nástupem onemocnění. Taková včasná detekce může lékařům poskytnout značnou dobu přípravy. Množství viru („ virová nálož “) u pacienta lze také kvantifikovat technikami kvantifikace DNA založenými na PCR (viz níže). Varianta PCR ( RT-PCR ) se používá pro detekci virové RNA spíše než DNA: v tomto testu je enzym reverzní transkriptázy použit ke generování sekvence DNA, která odpovídá virové RNA; tato DNA se pak amplifikuje obvyklou metodou PCR. RT-PCR se široce používá k detekci virového genomu SARS-CoV-2.
- Nemoci, jako je černý kašel (nebo černý kašel ), jsou způsobeny bakterií Bordetella pertussis . Tato bakterie je poznamenána vážnou akutní respirační infekcí, která postihuje různá zvířata a lidi a vedla ke smrti mnoha malých dětí. Toxin černého kašle je proteinový exotoxin, který se váže na buněčné receptory dvěma dimery a reaguje s různými typy buněk, jako jsou T lymfocyty, které hrají roli v imunitě buněk. PCR je důležitý testovací nástroj, který dokáže detekovat sekvence v genu pro toxin černého kašle. Protože PCR má vysokou citlivost na toxin a rychlou dobu obratu, je ve srovnání s kulturou velmi účinná pro diagnostiku černého kašle.
Forenzní aplikace
Vývoj protokolů genetických otisků prstů založených na PCR (nebo DNA ) zaznamenal široké uplatnění ve forenzní oblasti :
- Genetické otisky prstů mohou ve své nejvíce diskriminační formě jedinečně diskriminovat jakoukoli osobu z celé populace světa . Minutové vzorky DNA lze izolovat z místa činu a porovnat je s podezřelými nebo z databáze dřívějších důkazů nebo odsouzených DNA . Jednodušší verze těchto testů se často používají k rychlému vyloučení podezřelých během vyšetřování trestného činu. Lze otestovat důkazy ze zločinů starých desítky let a potvrdit nebo osvobodit původně odsouzené lidi.
- Forenzní typizace DNA byla účinným způsobem identifikace nebo osvobození podezřelých ze zločinu díky analýze důkazů objevených na místě činu. Lidský genom má mnoho opakujících se oblastí, které lze nalézt v genových sekvencích nebo v nekódujících oblastech genomu. Konkrétně až 40% lidské DNA se opakuje. V genomu existují dvě odlišné kategorie pro tyto opakující se nekódující oblasti. První kategorie se nazývá tandemové opakování s proměnným počtem (VNTR), které jsou dlouhé 10–100 párů bází, a druhá kategorie se nazývá krátké tandemové opakování (STR), které se skládají z opakovaných 2–10 sekcí základních párů. PCR se používá k amplifikaci několika dobře známých VNTR a STR pomocí primerů, které lemují každou z opakujících se oblastí. Velikosti fragmentů získaných od jakéhokoli jedince pro každý z STR budou indikovat, které alely jsou přítomny. Analýzou několika STR pro jednotlivce se zjistí sada alel pro každou osobu, která je statisticky pravděpodobně jedinečná. Vědci identifikovali kompletní sekvenci lidského genomu. K této sekvenci lze snadno přistupovat prostřednictvím webových stránek NCBI a používá se v mnoha reálných aplikacích. FBI například sestavila sadu míst DNA markerů používaných k identifikaci, která se nazývají databáze DNA Combined DNA Index System (CODIS). Použití této databáze umožňuje použít statistickou analýzu k určení pravděpodobnosti, že se vzorek DNA shoduje. PCR je velmi účinný a významný analytický nástroj, který lze použít pro forenzní typizaci DNA, protože výzkumníci potřebují k analýze použít jen velmi malé množství cílové DNA. Například jeden lidský vlas s připojeným vlasovým folikulem má dostatek DNA k provedení analýzy. Podobně několik spermií, kožních vzorků pod nehty nebo malé množství krve může poskytnout dostatek DNA pro přesvědčivou analýzu.
- Méně diskriminační formy otisků prstů DNA mohou pomoci při testování otcovství DNA , kde je jedinec spojen se svými blízkými příbuznými. DNA z neidentifikovaných lidských ostatků lze testovat a porovnat s DNA možných rodičů, sourozenců nebo dětí. Podobné testování lze použít k potvrzení biologických rodičů adoptovaného (nebo uneseného) dítěte. Lze také potvrdit (nebo vyloučit) skutečného biologického otce novorozence .
- Ukázalo se, že design PCR AMGX/AMGY nejen usnadňuje amplifikaci sekvencí DNA z velmi nepatrného množství genomu. Lze jej však také použít k určení pohlaví v reálném čase ze vzorků forenzních kostí. To poskytuje účinný a účinný způsob určení pohlaví ve forenzních případech a starověkých vzorcích.
Výzkumné aplikace
PCR byla použita v mnoha oblastech výzkumu molekulární genetiky:
- PCR umožňuje rychlou produkci krátkých částí DNA, i když není známo více než sekvence těchto dvou primerů. Tato schopnost PCR rozšiřuje mnoho metod, jako je generování hybridizačních sond pro hybridizaci Southern nebo Northern blot . PCR dodává těmto technikám velké množství čisté DNA, někdy jako jedno vlákno, což umožňuje analýzu i z velmi malého množství výchozího materiálu.
- Úkolu sekvenování DNA lze také pomoci pomocí PCR. Známé segmenty DNA lze snadno vyrobit z pacienta s mutací genetického onemocnění. Modifikace amplifikační techniky mohou extrahovat segmenty ze zcela neznámého genomu nebo mohou generovat pouze jeden řetězec oblasti zájmu.
- PCR má četné aplikace v tradičnějším procesu klonování DNA . Může extrahovat segmenty pro vložení do vektoru z většího genomu, který může být k dispozici pouze v malých množstvích. Pomocí jediné sady 'vektorových primerů' může také analyzovat nebo extrahovat fragmenty, které již byly vloženy do vektorů. Některé změny protokolu PCR mohou generovat mutace (obecné nebo místně zaměřené) vloženého fragmentu.
- Sekvenčně značená místa jsou proces, kde se PCR používá jako indikátor toho, že určitý segment genomu je přítomen v konkrétním klonu. Projekt lidského genomu shledal tuto aplikaci životně důležitou pro mapování kosmidových klonů, které sekvenovali, a pro koordinaci výsledků z různých laboratoří.
- Aplikace PCR je fylogenní analýza DNA ze starověkých zdrojů , jako je ta, která se nachází v regenerovaných kostech neandertálců , ze zmrazených tkání mamutů nebo z mozku egyptských mumií. V některých případech může být vysoce degradovaná DNA z těchto zdrojů znovu sestavena během raných fází amplifikace.
- Běžnou aplikací PCR je studium vzorců genové exprese . Tkáně (nebo dokonce jednotlivé buňky) lze analyzovat v různých fázích a zjistit, které geny se staly aktivními nebo které byly vypnuty. Tato aplikace může také použít kvantitativní PCR ke kvantifikaci skutečných úrovní exprese
- Schopnost PCR simultánně amplifikovat několik lokusů z jednotlivých spermií výrazně posílila tradičnější úlohu genetického mapování studiem chromozomálních crossoverů po meióze . Vzácné události křížení mezi velmi blízkými lokusy byly přímo pozorovány analýzou tisíců jednotlivých spermií. Podobně lze analyzovat neobvyklé delece, inzerce, translokace nebo inverze, to vše bez nutnosti čekat (nebo platit) na dlouhé a namáhavé procesy oplodnění, embryogeneze atd.
- Místně cílená mutageneze : PCR lze použít k vytvoření mutantních genů s mutacemi zvolenými vědci podle libosti. Tyto mutace mohou být zvoleny tak, aby porozuměly tomu, jak proteiny plní své funkce, a aby změnily nebo zlepšily funkci proteinu.
Výhody
PCR má řadu výhod. Je poměrně jednoduché pochopit a používat a rychle přináší výsledky. Tato technika je vysoce citlivá a má potenciál produkovat miliony až miliardy kopií konkrétního produktu pro sekvenování, klonování a analýzu. qRT-PCR sdílí stejné výhody jako PCR, s další výhodou kvantifikace syntetizovaného produktu. Proto má své využití k analýze změn úrovní genové exprese v nádorech, mikrobech nebo jiných chorobných stavech.
PCR je velmi účinný a praktický výzkumný nástroj. Sekvenování neznámých etiologií mnoha nemocí se zjišťuje pomocí PCR. Tato technika může pomoci identifikovat sekvenci dříve neznámých virů souvisejících s již známými viry a tím nám poskytne lepší pochopení samotné nemoci. Pokud bude možné postup dále zjednodušit a vyvinout citlivé neradiometrické detekční systémy, bude PCR v příštích letech zaujímat prominentní místo v klinické laboratoři.
Omezení
Jedním z hlavních omezení PCR je, že předchozí informace o cílové sekvenci jsou nezbytné pro generování primerů, které umožní její selektivní amplifikaci. To znamená, že uživatelé PCR obvykle musí znát přesné sekvence (upstream) od cílové oblasti na každém ze dvou jednovláknových templátů, aby se zajistilo, že se DNA polymeráza správně váže na hybridy primer-templát a následně generuje celá cílová oblast během syntézy DNA.
Jako všechny enzymy jsou i DNA polymerázy náchylné k chybám, což následně způsobuje mutace generovaných fragmentů PCR.
Dalším omezením PCR je, že lze amplifikovat i nejmenší množství kontaminující DNA, což má za následek zavádějící nebo nejednoznačné výsledky. Aby se minimalizovala možnost kontaminace, měli by vyšetřovatelé vyhradit oddělené místnosti pro přípravu reagencií, PCR a analýzu produktu. Činidla by měla být dávkována do alikvotů na jedno použití . Pipetory s jednorázovými písty a extra dlouhými špičkami pipet by měly být běžně používány. Kromě toho se doporučuje zajistit, aby nastavení laboratoře sledovalo jednosměrný pracovní postup. Bez důkladné dekontaminace by nikdy neměly být do přípravny PCR používány žádné materiály ani činidla používaná v místnostech pro analýzu a analýzu.
Vzorky prostředí, které obsahují huminové kyseliny, mohou inhibovat amplifikaci PCR a vést k nepřesným výsledkům.
Variace
- Alelově specifická PCR : diagnostická nebo klonovací technika založená na jednonukleotidových variacích (SNV nelze zaměňovat s SNP ) (rozdíly na jedné bázi u pacienta). Vyžaduje předchozí znalost sekvence DNA, včetně rozdílů mezi alelami , a používá primery, jejichž 3 'konce obklopují SNV (obvykle je začleněn pufr párů bází kolem SNV). Amplifikace PCR za přísných podmínek je mnohem méně účinná za přítomnosti nesouladu mezi templátem a primerem, takže úspěšná amplifikace pomocí primeru specifického pro SNP signalizuje přítomnost specifického SNP v sekvenci. Další informace viz genotypizace SNP .
- Assembly PCR nebo Polymerase Cycling Assembly (PCA) : umělá syntéza dlouhých sekvencí DNA provedením PCR na souboru dlouhých oligonukleotidů s krátkými překrývajícími se segmenty. Oligonukleotidy se střídají mezi smyslovými a antisense směry a překrývající se segmenty určují pořadí fragmentů PCR, čímž selektivně produkují konečný dlouhý produkt DNA.
- Asymetrická PCR : přednostně amplifikuje jedno vlákno DNA v dvouvláknovém DNA templátu. Používá se při sekvenování a hybridizačním sondování, kde je požadována amplifikace pouze jednoho ze dvou komplementárních řetězců. PCR se provádí jako obvykle, ale s velkým přebytkem primeru pro vlákno cílené na amplifikaci. Vzhledem k pomalé ( aritmetické ) amplifikaci později v reakci po vyčerpání omezujícího primeru jsou nutné další cykly PCR. Nedávné modifikace na tento proces, známý jako L inear-fter- T he- E xponential-PCR (pozdní-PCR), používá omezený základ s vyšší teplotou tání ( T m ), než je přebytek primeru zachovat účinnost reakce jako limitující koncentrace primerů se snižuje uprostřed reakce.
- Konvektivní PCR : pseudoizotermický způsob provádění PCR. Místo opakovaného zahřívání a chlazení směsi PCR je roztok podroben tepelnému gradientu. Výsledný konvekční tok řízený tepelnou nestabilitou automaticky míchá reagencie PCR z horkých a studených oblastí a opakovaně umožňuje PCR. Parametry, jako jsou termální okrajové podmínky a geometrie krytu PCR, lze optimalizovat tak, aby poskytovaly robustní a rychlou PCR, využitím vzniku chaotických tokových polí. Takové nastavení PCR s konvekčním tokem výrazně snižuje požadavek na výkon zařízení a dobu provozu.
- Dial-out PCR : vysoce paralelní metoda pro získávání přesných molekul DNA pro syntézu genů. Složitá knihovna molekul DNA je před masivně paralelním sekvenováním modifikována jedinečnými lemujícími značkami. Tagově řízené primery pak umožňují získání molekul s požadovanými sekvencemi pomocí PCR.
- Digitální PCR (dPCR) : používá se k měření množství cílové sekvence DNA ve vzorku DNA. Vzorek DNA je velmi zředěný, takže po paralelním běhu mnoha PCR některé z nich neobdrží jedinou molekulu cílové DNA. Cílová koncentrace DNA se vypočítá pomocí podílu negativních výsledků. Odtud název „digitální PCR“.
- Amlikáce závislá na amplifikaci : podobná tradiční PCR, ale používá spíše konstantní teplotu než cyklování denaturačními a žíhacími/prodlužovacími cykly. Místo tepelné denaturace se používá DNA helikáza , enzym, který odvíjí DNA.
- Hot start PCR : technika, která snižuje nespecifickou amplifikaci během počátečních fází nastavení PCR. Lze to provést ručně zahřátím reakčních složek na denaturační teplotu (např. 95 ° C) před přidáním polymerázy. Byly vyvinuty specializované enzymové systémy, které inhibují aktivitu polymerázy při teplotě okolí, a to buď navázáním protilátky nebo přítomností kovalentně vázaných inhibitorů, které se disociují až po vysokoteplotním aktivačním kroku. PCR s teplým startem/za studena je dosaženo pomocí nových hybridních polymeráz, které jsou neaktivní při teplotě okolí a jsou okamžitě aktivovány při teplotě prodloužení.
- In silico PCR (digitální PCR, virtuální PCR, elektronická PCR, e-PCR) označuje výpočetní nástroje používané k výpočtu teoretických výsledků polymerázové řetězové reakce s použitím dané sady primerů ( sond ) k amplifikacisekvencí DNA ze sekvenovaného genomu nebo transkriptomu . In silico PCR byla navržena jako vzdělávací nástroj pro molekulární biologii.
- Intersekvenčně specifická PCR (ISSR): metoda PCR pro snímání otisků prstů DNA, která zesiluje oblasti mezi jednoduchými sekvenčními opakováními za vzniku jedinečného otisku prstu amplifikovaných délek fragmentů.
- Inverzní PCR : běžně se používá k identifikaci lemujících sekvencí kolem genomových inzertů. Zahrnuje sérii štěpení DNA a vlastní ligaci , což vede ke známým sekvencím na obou koncích neznámé sekvence.
- Ligací zprostředkovaná PCR : používá malé DNA linkery ligované k požadované DNA a více primerů hybridizujících k DNA linkerům; bylo použito pro sekvenování DNA , genomovou chůzi a stopu DNA .
- Methylačně specifická PCR (MSP): vyvinuta Stephenem Baylinem a Jamesem G. Hermanem na Johns Hopkins School of Medicine a slouží k detekci methylace ostrovů CpG v genomové DNA. DNA je nejprve ošetřena hydrogensiřičitanem sodným, který převádí nemetylované cytosinové báze na uracil, který je pomocí primerů PCR rozpoznán jako thymin. Poté se na modifikované DNA provedou dvě PCR s použitím identických sad primerů kromě jakýchkoli ostrovů CpG v sekvencích primerů. V těchto bodech jedna sada primerů rozpoznává DNA s cytosiny pro amplifikaci methylované DNA a jedna sada rozpoznává DNA s uracilem nebo thyminem pro amplifikaci nemetylované DNA. MSP pomocí qPCR lze také provést za účelem získání kvantitativních spíše než kvalitativních informací o methylaci.
- Miniprimer PCR : používá termostabilní polymerázu (S-Tbr), která se může rozšířit z krátkých primerů („smalligos“) krátkých až 9 nebo 10 nukleotidů. Tato metoda umožňuje cílení PCR na menší oblasti vázající primer a používá se k amplifikaci konzervovaných sekvencí DNA, jako je gen 16S (nebo eukaryotický 18S) rRNA.
- Amplifikace sondy závislá na multiplexní ligaci ( MLPA ): umožňuje amplifikaci více cílů jedním párem primerů, čímž se vyhýbá omezením rozlišení multiplexní PCR (viz níže).
- Multiplexní PCR : sestává z více sad primerů v rámci jedné směsi PCR za vzniku amplikonů různých velikostí, které jsou specifické pro různé sekvence DNA. Zacílením více genů najednou lze získat další informace z jednoho testovacího běhu, které by jinak vyžadovaly několikanásobné provedení reagencií a více času na provedení. Teploty žíhání pro každou ze sad primerů musí být optimalizovány tak, aby fungovaly správně v rámci jedné reakce, a velikosti amplikonu. To znamená, že jejich délka párů bází by měla být dostatečně odlišná, aby při vizualizaci gelovou elektroforézou vytvářela odlišná pásma.
- Nanočástice asistovaná PCR (nanoPCR) : některé nanočástice (NP) mohou zvýšit účinnost PCR (proto se jim říká nanoPCR) a některé mohou dokonce překonat původní zesilovače PCR. Bylo oznámeno, že kvantové tečky (QD) mohou zlepšit specificitu a účinnost PCR. Jednostěnné uhlíkové nanotrubice (SWCNT) a vícestěnné uhlíkové nanotrubice (MWCNT) účinně posilují amplifikaci dlouhé PCR. Oxid nanoprášek (CNP), může zvýšit účinnost opakovaného PCR a dlouhé PCR, přičemž oxid zinečnatý , oxid titaničitý byly nalezeny a Ag NP zvýšit výtěžek PCR. Předchozí údaje naznačovaly, že nekovové NP si zachovaly přijatelnou věrnost zesílení. Vzhledem k tomu, že mnoho NP je schopno zvýšit účinnost PCR, je zřejmé, že existuje pravděpodobně velký potenciál pro vylepšení technologie nanoPCR a vývoj produktů.
- Vnořená PCR : zvyšuje specificitu amplifikace DNA snížením pozadí v důsledku nespecifické amplifikace DNA. Ve dvou po sobě následujících PCR jsou použity dvě sady primerů. V první reakci je k vytvoření produktů DNA použit jeden pár primerů, který kromě zamýšleného cíle může stále sestávat z nespecificky amplifikovaných fragmentů DNA. Produkty (produkty) se pak použijí ve druhé PCR se sadou primerů, jejichž vazebná místa jsou zcela nebo částečně odlišná od a nacházejí se 3 'od každého z primerů použitých v první reakci. Vnořená PCR je často úspěšnější ve specificky amplifikaci dlouhých fragmentů DNA než konvenční PCR, ale vyžaduje podrobnější znalosti cílových sekvencí.
- Overlap- extend PCR nebo Splicing by overlap extend (SOEing) :technika genetického inženýrství, která se používá ke spojení dvou nebo více fragmentů DNA, které obsahují komplementární sekvence. Používá se ke spojení částí DNA obsahujících geny, regulační sekvence nebo mutace; tato technika umožňuje vytvoření specifických a dlouhých DNA konstruktů. Může také zavést delece, inzerce nebo bodové mutace do sekvence DNA.
- PAN-AC : používá k amplifikaci izotermické podmínky a může být použit v živých buňkách.
- kvantitativní PCR (qPCR): používá se k měření množství cílové sekvence (běžně v reálném čase). Kvantitativně měří počáteční množství DNA, cDNA nebo RNA. kvantitativní PCR se běžně používá ke stanovení, zda je ve vzorku přítomna sekvence DNA a počet jejích kopií ve vzorku. Kvantitativní PCR má velmi vysoký stupeň přesnosti. Kvantitativní metody PCR používajík měření množství amplifikovaného produktu v reálném časefluorescenční barviva, jako je Sybr Green, EvaGreen nebosondy DNA obsahující fluorofor , jako je TaqMan . Někdy je také zkrácen na RT-PCR ( real-time PCR), ale tato zkratka by měla být použita pouze pro PCR s reverzní transkripcí . qPCR je vhodná kontrakce pro kvantitativní PCR (real-time PCR).
- Reverzní komplementární PCR (RC-PCR): Umožňuje přidání funkčních domén nebo sekvencí podle volby nezávisle na obou koncích generovaného amplikonu v reakci s jednou uzavřenou zkumavkou. Tato metoda generuje cílově specifické primery v rámci reakce interakcí univerzálních primerů (které obsahují požadované sekvence nebo domény, které mají být připojeny) a RC sond.
- Reverzní transkripce PCR ( RT-PCR ) : pro amplifikaci DNA z RNA. Reverzní transkriptáza reverzní transkribuje RNA do cDNA , která je pak amplifikována pomocí PCR. RT-PCR je široce používána v expresním profilování , ke stanovení exprese genu nebo k identifikaci sekvence transkriptu RNA, včetně počátečních a koncových míst transkripce. Pokud je známá genomová sekvence DNA genu, lze k mapování umístění exonů a intronů v genu použít RT-PCR . 5 'konec genu (odpovídající místu zahájení transkripce) je typicky identifikován pomocí RACE-PCR ( Rapid Amplification of cDNA Ends ).
- PCR závislá na RNáze H (rhPCR): modifikace PCR, která využívá primery s 3 'prodlužovacím blokem, který lze odstranit termostabilním enzymem RNázy HII. Tento systém redukuje dimery primerů a umožňuje provádět multiplexní reakce s vyšším počtem primerů.
- Single Specific Primer-PCR (SSP-PCR): umožňuje amplifikaci dvouvláknové DNA, i když jsou informace o sekvenci dostupné pouze na jednom konci. Tato metoda umožňuje amplifikaci genů, pro které je k dispozici pouze částečná informace o sekvenci, a umožňuje jednosměrné procházení genomu ze známých do neznámých oblastí chromozomu.
- PCR v pevné fázi : zahrnuje více významů, včetně Polonyho amplifikace (kde jsou kolonie PCR odvozeny například v gelové matrici), Bridge PCR (primery jsou kovalentně spojeny s povrchem na pevné podložce), konvenční PCR v pevné fázi (kde je asymetrická PCR aplikován v přítomnosti primeru nesoucího pevný podklad se sekvencí odpovídající jednomu z vodných primerů) a Enhanced Solid Phase PCR (kde konvenční PCR v pevné fázi lze zlepšit použitím vysokého Tm a vnořeného pevného nosného primeru s volitelnou aplikací tepelného „kroku“ upřednostnění základního nátěru pevné podpory).
- Suicide PCR : typicky se používá v paleogenetice nebo jiných studiích, kde je nejvyšší prioritou vyhýbání se falešně pozitivním výsledkům a zajištění specifičnosti amplifikovaného fragmentu. Původně byl popsán ve studii k ověření přítomnosti mikroba Yersinia pestis v zubních vzorcích získaných z hrobů lidí ze 14. století, kteří byli údajně zabiti morem během středověké epidemie černé smrti . Metoda předepisuje použití jakékoli kombinace primerů pouze jednou v PCR (odtud termín „sebevražda“), která nikdy neměla být použita v žádné pozitivní kontrolní PCR reakci, a primery by se vždy měly zaměřit na genomovou oblast, která nikdy předtím nebyla amplifikována. laboratoř používající tuto nebo jakoukoli jinou sadu primerů. Tím je zajištěno, že v laboratoři není přítomna žádná kontaminující DNA z předchozích reakcí PCR, která by jinak mohla generovat falešně pozitivní výsledky.
- Tepelně asymetrická prokládaná PCR (TAIL-PCR) : pro izolaci neznámé sekvence lemující známou sekvenci. V rámci známé sekvence TAIL-PCR používá vnořený pár primerů s různými teplotami nasedání; degenerovaný primer se používá k amplifikaci v opačném směru od neznámé sekvence.
- Touchdown PCR ( Step-down PCR ): varianta PCR, jejímž cílem je redukovat nespecifické pozadí postupným snižováním teploty nasedání v průběhu cyklování PCR. Teplota žíhání v počátečních cyklech je obvykle o několik stupňů (3–5 ° C) nad T m použitých primerů, zatímco v pozdějších cyklech je o několik stupňů (3–5 ° C) nižší než primer T m . Vyšší teploty dávají větší specificitu pro vazbu primeru a nižší teploty umožňují účinnější amplifikaci ze specifických produktů vytvořených během počátečních cyklů.
- Universal Fast Walking : pro genomovou chůzi a genetické otisky prstů pomocí specifičtějšího „oboustranného“ PCR než konvenční „jednostranné“ přístupy (použití pouze jednoho genově specifického primeru a jednoho obecného primeru-což může vést k artefaktovému „šumu“) na základě mechanismu zahrnujícího tvorbu struktury larev. Efektivními deriváty UFW jsou LaNe RAGE (vnořená PCR závislá na lariatě pro rychlou amplifikaci konců genomové DNA), 5'RACE LaNe a 3'RACE LaNe.
Dějiny
Žáruvzdorné enzymy, které jsou klíčovou složkou polymerázové řetězové reakce, byly objeveny v šedesátých letech minulého století jako produkt mikrobiální formy života, který žil v přehřátých vodách Yellowstonského houbového pramene.
Papír z roku 1971 v časopise Journal of Molecular Biology od Kjella Kleppeho a spolupracovníků v laboratoři H. Gobinda Khorany poprvé popsal způsob použití enzymatického testu k replikaci krátké šablony DNA s primery in vitro . Tomuto časnému projevu základního principu PCR se však v té době nevěnovala velká pozornost a vynález polymerázové řetězové reakce v roce 1983 je obecně připisován Kary Mullis .
Když Mullis v roce 1983 vyvinul PCR, pracoval v Emeryville v Kalifornii pro Cetus Corporation , jednu z prvních biotechnologických společností, kde byl zodpovědný za syntézu krátkých řetězců DNA. Mullis napsal, že nápad na PCR pojal při jedné noci ve svém autě po dálnici Pacific Coast Highway . V mysli si pohrával s novým způsobem analýzy změn (mutací) v DNA, když si uvědomil, že místo toho vynalezl metodu amplifikace jakékoli oblasti DNA prostřednictvím opakovaných cyklů duplikace řízených DNA polymerázou. V časopise Scientific American shrnul Mullis postup: „Počínaje jedinou molekulou DNA genetického materiálu může PCR generovat 100 miliard podobných molekul za odpoledne. Reakci lze snadno provést. Nevyžaduje více než zkumavku, několik jednoduchých činidel a zdroj tepla. " Otisky prstů DNA byly poprvé použity k testování otcovství v roce 1988.
Mullis připsal jeho použití LSD jako nedílnou součást jeho vývoje PCR: "Vyvinul bych PCR, kdybych nebral LSD? Vážně o tom pochybuji. Mohl bych sedět na molekule DNA a sledovat, jak polymery procházejí. Naučil jsem se že částečně na psychedelických drogách “.
Mullis a profesor Michael Smith , kteří vyvinuli další základní způsoby manipulace s DNA, byli společně oceněni Nobelovou cenou za chemii v roce 1993, sedm let poté, co Mullis a jeho kolegové z Cetu poprvé uvedli svůj návrh do praxe. Mullisův dokument z roku 1985 s RK Saiki a HA Erlich „Enzymatická amplifikace genomových sekvencí β-globinů a analýza restrikčních míst pro diagnostiku srpkovité anémie“-vynález polymerázové řetězové reakce (PCR)-byl oceněn cenou Citation for Chemical Breakthrough Award od divize historie chemie Americké chemické společnosti v roce 2017.
Jádrem metody PCR je použití vhodné DNA polymerázy schopné odolat vysokým teplotám> 90 ° C (194 ° F) potřebným k oddělení dvou řetězců DNA ve dvojité šroubovici DNA po každém replikačním cyklu. DNA polymerázy původně používané pro experimenty in vitro předvádějící PCR nebyly schopné těmto vysokým teplotám odolat. Počáteční postupy replikace DNA byly tedy velmi neúčinné a časově náročné a vyžadovaly velké množství DNA polymerázy a kontinuální manipulaci v průběhu celého procesu.
Objev v roce 1976 z Taq polymerázy -a DNA polymerázy purifikována z termofilní bakterie , Thermus aquaticus , který přirozeně žije v teplé (50 až 80 ° C (122 až 176 ° F)), prostředí, jako jsou horké prameny, otevřela cestu k dramatické vylepšení metody PCR. DNA polymeráza izolovaná z T. aquaticus je stabilní při vysokých teplotách a zůstává aktivní i po denaturaci DNA, což eliminuje potřebu přidání nové DNA polymerázy po každém cyklu. To umožnilo automatizovaný proces na bázi termocykleru pro amplifikaci DNA.
Patentové spory
Technika PCR byla patentována Kary Mullisem a přidělena společnosti Cetus Corporation , kde Mullis pracoval, když tuto techniku vynalezl v roce 1983. Na enzym Taq polymerázy se rovněž vztahují patenty. S touto technikou proběhlo několik významných soudních sporů, včetně neúspěšného soudního sporu podaného společností DuPont . Švýcarská farmaceutická společnost Hoffmann-La Roche koupila práva na patenty v roce 1992 a v současné době vlastní ty, které jsou stále chráněny.
V několika jurisdikcích po celém světě mezi Roche a Promega stále probíhá související patentová bitva o enzym Taq polymerázy . Právní argumenty přesahují životnost původních patentů PCR a Taq polymerázy, jejichž platnost skončila 28. března 2005.
Viz také
- Testování na COVID-19
- Spiknutí DNA
- Smyčkově zprostředkovaná izotermická amplifikace
- Selektorová technika
- Thermus thermophilus
- Pfu DNA polymeráza
Reference
externí odkazy
|
Knihovní zdroje o polymerázové řetězové reakci |
- Patent USA pro PCR
- Co je to plateau efekt PCR? Výukové video na YouTube
- Historie polymerázové řetězové reakce z archivů Smithsonian Institution