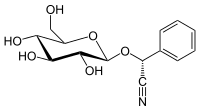
Prunasin - Prunasin
|
|
| Jména | |
|---|---|
|
Preferovaný název IUPAC
( 2R ) -Fenyl {[( 2R , 3R , 4S , 5S , 6R ) -3,4,5-trihydroxy-6- (hydroxymethyl) oxan-2-yl] oxy} acetonitril |
|
| Ostatní jména
( R ) -Prunasin
D -Prunasin D -Mandelonitril-β- D- glukosid Prulaurasin Laurocerasin Sambunigrin |
|
| Identifikátory | |
|
3D model ( JSmol )
|
|
| ChEBI | |
| ChemSpider | |
| Informační karta ECHA |
100,002 489 |
| Číslo ES | |
| KEGG | |
|
PubChem CID
|
|
| UNII | |
|
|
|
|
| Vlastnosti | |
| C 14 H 17 N O 6 | |
| Molární hmotnost | 295,291 g · mol -1 |
|
Není-li uvedeno jinak, jsou uvedeny údaje o materiálech v jejich standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|
| Reference Infoboxu | |
( R ) -prunasin je kyanogenní glykosid příbuzný amygdalinu . Chemicky je to glukosid ( R ) - mandelonitrilu .
Přirozené výskyty
Prunasin se vyskytuje u druhů rodu Prunus, jako je Prunus japonica nebo P. maximowiczii, a v hořkých mandlích . Vyskytuje se také v listech a stoncích Olinia ventosa , O. radiata , O. emarginata a O. rochetiana a v Acacia greggii . Je to biosyntetický prekurzor a meziprodukt v biosyntéze amygdalinu , chemické sloučeniny odpovědné za chuť hořkých mandlí .
Vyskytuje se také v pampeliškové kávě , náhražce kávy .
Sambunigrin
Sambunigrin, diastereomer prunasinu získaného z ( S ) -mandelonitrilu místo ( R ) -izomeru, byl izolován z listů bezového stromu ( Sambucus nigra ). Sambunigrin je přítomen v listech a stoncích bezu v poměru 1: 3 sambunigrinu k prunasinu a 2: 5 v nezralém semeni. V kořenovém adresáři se nenachází.
Biosyntéza
Přehled
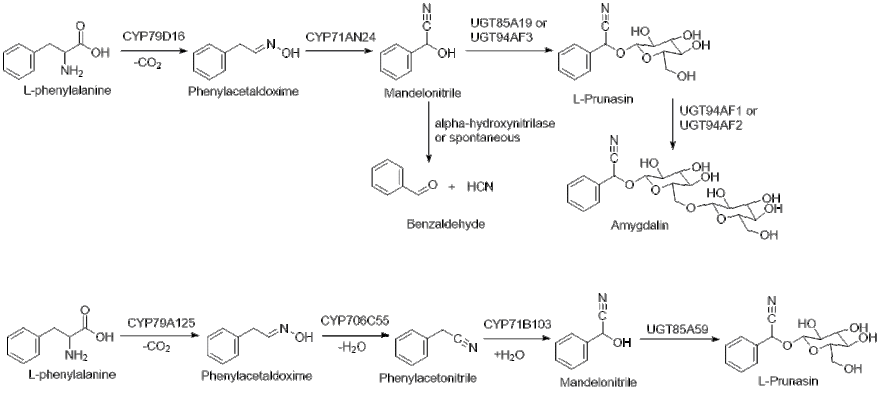
( R ) -prunasin začíná běžnou aminokyselinou fenylalaninem , který je v rostlinách produkován cestou Shikimate v primárním metabolismu . Cesta je katalyzována hlavně dvěma enzymy cytochromu P450 (CYP) a UDP-glukosyltransferázou ( UGT ). Poté, co se vytvoří ( R ) -prunasin, se buď převede na amygdalin další UDP-glukosyltransferázou, nebo se rozloží na benzaldehyd a kyanovodík.
Vědci prokázali, že akumulace (nebo nedostatek) prunasinu a amygdalinu v mandlovém jádru je zodpovědná za sladké a hořké genotypy. Protože amygdalin je zodpovědný za hořkou mandlovou chuť, pěstitelé mandlí vybrali genotypy, které minimalizují biosyntézu amygdalinu. Enzymy CYP odpovědné za tvorbu prunasinu jsou konzervovány napříč druhy Prunus . Existuje korelace mezi vysokou koncentrací prunasinu ve vegetativních oblastech rostliny a sladkostí mandlí, která je relevantní pro mandlový zemědělský průmysl. V mandlích, že amygdalin biosyntetické geny jsou vyjádřeny na různých úrovních v osemení (matka tkáně, nebo vnější části) a děloh (jádro nebo otec tkání), a významně měnit během mandlové ontogeneze . K biosyntéze prunasinu dochází v tegumentu, poté je transportován do jiných tkání za účelem přeměny na amygdalin nebo degradován.
Biosyntéza ( R ) -prunasinu
Biosyntéza ( R ) -prunasinu v Prunus dulcis
L-fenylalanin je nejprve hydroxylován CYP79D16, následuje dekarboxylace a dehydratace za vzniku E- oxime fenylacetaldoximu. Poté CYP71AN24 katalyzuje přeskupení E- oximu na Z- oxim, po kterém následuje dehydratace a hydroxylace za vzniku mandelonitrilu. Nakonec UGT85A19 nebo UGT94AF3 využívají UDP-glukózu ke glykosylaci mandelonitrilu za vzniku ( R ) -prunasinu.
Po generování ( R ) -prunasinu je produkt dále glykosylován na amygdalin buď izoformou UGT94AF1 nebo UGT94AF2. Exprese UGTAF1 / 2 a prunasinových hydroláz vede k nízké celkové koncentraci ( R ) -prunasinu v mandlových tkáních. Je důležité si uvědomit, že alfa- glukosidáza nebo prunasinová hydroláza mohou převést ( R ) -prunasin na mandelonitril, jeho prekurzor, který pak může být spontánně nebo enzymaticky hydrolyzován na benzaldehyd a kyanovodík.
Biosyntéza ( R ) -prunasinu v Eucalyptus cladocalyx
Ukázalo se, že biosyntéza ( R ) -prunasinu v E. cladocalyx , stromu cukrové gumy , syntetizuje ( R ) -prunasin pomocí dalšího meziproduktu, fenylacetonitrilu , za použití CYP706C55. Cesta probíhá podobně jako cesta u druhů Prunus , kde multifunkční CYP79A125 katalyzuje přeměnu L-fenylalaninu na fenylacetaldoxim. Poté CYP706C55 katalyzuje dehydrataci fenylacetaldoximu na fenylacetonitril. Fenylacetonitril je poté hydroxylován CYP71B103 na mandelonitril . Po generování mandelonitrilu UGT85A59 přenáší glukózu na výtěžek ( R ) -prunasinu.
Interakce metabolické dráhy
Jelikož ( R ) -prunasin je produktem sekundárního metabolismu, jeho tvorba a degradace ovlivňuje více metabolických cest konzumací L-fenylalaninu nebo zvýšením množství benzaldehydu a toxického kyanovodíku degradací prunasinu.
Metabolické profilování v mandlích, manioku a čiroku identifikovalo potenciální recyklační mechanismus, kde lze ( R ) -prunasin a další kyanogenové glykosidy použít pro skladování dusíku a recyklaci dusíku bez generování HCN. V roce 2017, výzkumníci používali stabilní izotop označování prokázat, že 13 C-značeného L-fenylalanin začleněny do ( R ) -prunasin by mohl být přeměněn na benzaldehydu a kyseliny salicylové za použití nitrilu kyseliny mandlové jako meziprodukt.
Toxicita
Toxicita prunasinu je založena na jeho degradačních produktech: ( R ) -prunasin je hydrolyzován za vzniku benzaldehydu a kyanovodíku , což způsobuje toxicitu. Rostliny obsahující prunasin proto mohou být toxické pro zvířata, zejména přežvýkavce .
K degradaci amygdalinu na prunasin amygdalinová beta-glukosidáza hydrolyzuje disacharid za vzniku ( R ) -prunasinu a D- glukózy. Potom prunasin beta-glukosidáza používá ( R ) -prunasin a vodu k výrobě D - glukózy a mandelonitrilu . Po vytvoření aglykonového mandelonitrilu může mandelonitrilová lyáza degradovat sloučeninu na benzaldehyd a kyanovodík .