Robinsonova anulace - Robinson annulation
| Robinsonova anulace | |
|---|---|
| Pojmenoval podle | Robert Robinson |
| Typ reakce | Prstenotvorná reakce |
| Identifikátory | |
| Portál organické chemie | robinsonova anulace |
| ID ontologie RSC | RXNO: 0000380 |
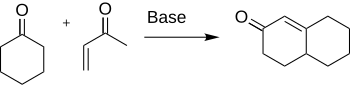
Robinson anelace je chemická reakce používají v organické chemii pro tvorby kruhu. Byl objeven Robertem Robinsonem v roce 1935 jako metoda k vytvoření šestičlenného kruhu vytvořením tří nových vazeb uhlík -uhlík. Metoda používá keton a methylvinylketon k vytvoření a, P-nenasyceného ketonu v cyklohexanovém kruhu Michaelovou adicí následovanou aldolovou kondenzací . Tento postup je jednou z klíčových metod pro vytvoření kondenzovaných prstencových systémů.
Tvorba cyklohexenonu a derivátů je v chemii důležitá pro jejich aplikaci na syntézu mnoha přírodních produktů a dalších zajímavých organických sloučenin, jako jsou antibiotika a steroidy . Syntéza kortizonu je konkrétně dokončena použitím Robinsonovy anulace.
Počáteční příspěvek o Robinsonově anulaci publikovali William Rapson a Robert Robinson, zatímco Rapson studoval na Oxfordu u profesora Robinsona. Před jejich prací nebyly cyklohexenonové syntézy odvozeny od α, β-nenasycené ketonové složky. Počáteční přístupy spojily methylvinylketon s naftolem za vzniku naftoloxidu, ale tento postup nebyl dostatečný k vytvoření požadovaného cyklohexenonu. To bylo přičítáno nevhodným podmínkám reakce.
Robinson a Rapson v roce 1935 zjistili, že interakce mezi cyklohexanonem a a, p-nenasyceným ketonem poskytuje požadovaný cyklohexenon. Zůstává jednou z klíčových metod pro konstrukci šestičlenných kruhových sloučenin. Protože je tak široce používán, existuje mnoho aspektů reakce, které byly zkoumány, jako jsou variace substrátů a reakční podmínky, jak jsou diskutovány v části rozsahu a variací. Robert Robinson získal v roce 1947 Nobelovu cenu za chemii za přínos při studiu alkaloidů.
Reakční mechanismus
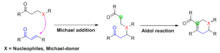
Původní postup Robinsonovy anulace začíná nukleofilním útokem ketonu v Michaelově reakci na vinylketon za vzniku intermediárního Michaelova aduktu. Následné uzavření kruhu aldolového typu vede ke keto alkoholu, po kterém následuje dehydratace za vzniku anulačního produktu.
Při Michaelově reakci je keton deprotonován zásadou za vzniku enolátového nukleofilu, který útočí na akceptor elektronů (červeně). Tento akceptor je obecně a, P-nenasycený keton, ačkoli mohou fungovat i aldehydy , deriváty kyselin a podobné sloučeniny (viz rozsah). V zde uvedeném příkladu je regioselektivita diktována tvorbou termodynamického enolátu. Alternativně je regioselektivita často kontrolována použitím β-diketonu nebo β-ketoesteru jako enolátové složky, protože deprotonace na uhlíku lemovaném karbonylovými skupinami je silně preferována. Intramolekulární aldolová kondenzace pak probíhá takovým způsobem, který instaluje šestičlenný kruh. V konečném produktu tvoří tři atomy uhlíku α, β-nenasyceného systému a uhlík α k jeho karbonylové skupině čtyřuhlíkový můstek nově instalovaného kruhu.
Aby se zabránilo reakci mezi původním enolátem a cyklohexenonovým produktem, počáteční Michaelův adukt je často nejprve izolován a poté cyklizován za získání požadovaného oktalonu v samostatném kroku.
Stereochemie
Byly dokončeny studie o tvorbě hydroxyketonů v reakčním schématu Robinsonovy anulace. Trans sloučenina je zvýhodněna díky antiperiplanárním účinkům konečné aldolové kondenzace v kineticky kontrolovaných reakcích. Bylo také zjištěno, že cyklizace může probíhat v synchronizační orientaci. Následující obrázek ukazuje tři možné stereochemické dráhy za předpokladu stavu přechodu židle.
Předpokládalo se, že rozdíl ve tvorbě těchto přechodových stavů a jejich odpovídajících produktů je způsoben interakcemi rozpouštědel. Scanio zjistil, že změna rozpouštědla reakce z dioxanu na DMSO poskytuje v kroku D výše odlišnou stereochemii. To naznačuje, že přítomnost protických nebo aprotických rozpouštědel vede k různým přechodovým stavům.
Mechanická klasifikace
Robinsonova anulace je pozoruhodným příkladem širší třídy chemických transformací nazývaných tandemové Michael-aldolové reakce, které postupně kombinují Michaelovu adici a aldolovou reakci do jediné reakce. Stejně jako v případě Robinsonovy anulace se Michaelův adiční obvykle nejprve spojí dva reaktanty dohromady, poté aldolová reakce probíhá intramolekulárně za vzniku kruhového systému v produktu. Obvykle se generují pětičlenné nebo šestičlenné prsteny.
Rozsah a variace
Reakční podmínky
Ačkoli se Robinsonova anulace obecně provádí za zásaditých podmínek, reakce byly prováděny za různých podmínek. Heathcock a Ellis uvádějí podobné výsledky jako metoda katalyzovaná bází za použití kyseliny sírové . Michaelova reakce může nastat za neutrálních podmínek prostřednictvím enaminu . Mannichova báze lze zahřívat v přítomnosti ketonu za vzniku Michaelův adukt. Byla popsána úspěšná příprava sloučenin metodami Robinsonovy anulace.
Michaelův akceptor
Typickým Michaelovým akceptorem je a, P-nenasycený keton, ačkoli fungují také aldehydy a deriváty kyselin. Kromě toho Bergmann a kol. uvádí, že dárci, jako jsou nitrily , nitrosloučeniny, sulfony a určité uhlovodíky, mohou být použity jako akceptory. Celkově jsou Michaelovými akceptory obecně aktivované olefiny, jako jsou uvedeny níže, kde EWG označuje skupinu odebírající elektrony, jako je kyano, keto nebo ester, jak je uvedeno.
Wichterleova reakce
Wichterleova reakce je variantou Robinsonovy anulace, která nahrazuje methylvinylketon 1,3-dichlor- cis -2-butenem. To dává příklad použití odlišného Michaelova akceptoru od typického a, P-nenasyceného ketonu. 1,3-dichlor- cis -2-buten se používá k zabránění nežádoucí polymeraci nebo kondenzaci během Michaelovy adice.
Hauserova anulace
Reakční sekvence v související Hauserově anulaci je Michaelova adice následovaná Dieckmannovou kondenzací a nakonec eliminací. Dieckmannova kondenzace je podobný kruh uzavírající intramolekulární chemickou reakci diesterů s bází za vzniku beta-ketoesterů. Hauserovým dárcem je aromatický sulfon nebo methylensulfoxid se skupinou karboxylových esterů v orto poloze. Hauserův akceptor je Michaelův akceptor . V původní Hauserově publikaci ethyl 2-karboxybenzyl fenylsulfoxid reaguje s pent-3-en-2-onem s LDA jako bází v THF při -78 ° C.
Asymetrická Robinsonova anulace
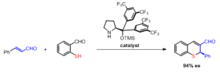
Asymetrická syntéza produktů Robinsonovy anulace nejčastěji zahrnuje použití prolinového katalyzátoru . Studie uvádějí použití L-prolinu a několika dalších chirálních aminů k použití jako katalyzátorů v obou krocích reakce Robinsonovy anulace. Výhodou použití opticky aktivní prolinové katalýzy je, že jsou stereoselektivní s enantiomerními přebytky 60–70%.
Wang a kol. popsali syntézu chirálních thiochromenů v jedné nádobě takovou organokatalytickou Robinsonovou anulací.
Aplikace pro syntézu
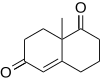
Wieland-Miescher keton je Robinson anelace produkt 2-methyl-cyklohexan-1,3-dionu a methylvinylketonem. Tato sloučenina se používá při syntéze mnoha steroidů, které mají důležité biologické vlastnosti, a může být vyrobena enantiomerně za použití prolinové katalýzy.
F. Dean Toste a spolupracovníci použili Robinsonovu anulaci při celkové syntéze (+)-fawcettiminu, tetracyklického alkaloidu Lycopodium, který má potenciální aplikaci k inhibici acetylcholin esterázy .
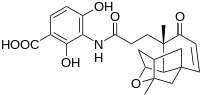
Enantioselektivní cesta k platensimycinu
Vědci ze společnosti Merck objevili platensimycin , novou antibiotickou olovnatou sloučeninu s potenciálními léčebnými aplikacemi, jak je vidět na sousedním obrázku.
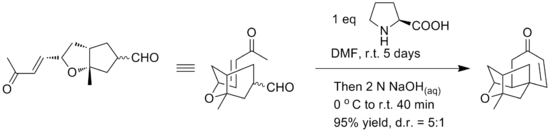
Počáteční syntéza poskytla racemickou formu sloučeniny za použití intramolekulární etherifikační reakce alkoholových motivů a dvojné vazby. Yamamoto a spolupracovníci uvádějí použití alternativní intramolekulární Robinsonovy anulace k zajištění jednoduché enantioselektivní syntézy tetracyklického jádra platensimycinu. Bylo oznámeno, že klíčový krok Robinsonovy anulace byl proveden v jedné nádobě s použitím L-prolinu pro chirální kontrolu. Reakční podmínky lze vidět níže.