Oxid cínatý - Tin(II) oxide
|
|

|
|

|
|
| Jména | |
|---|---|
|
Název IUPAC
Oxid cínatý
|
|
| Ostatní jména
Oxid cínatý, oxid cínu
|
|
| Identifikátory | |
|
3D model ( JSmol )
|
|
| Informační karta ECHA |
100,040,439 |
| Číslo ES | |
|
PubChem CID
|
|
| Číslo RTECS | |
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Vlastnosti | |
| SnO | |
| Molární hmotnost | 134,709 g/mol |
| Vzhled | bezvodý černý nebo červený prášek, bílý hydratovaný |
| Hustota | 6,45 g / cm 3 |
| Bod tání | 1 080 ° C (1 980 ° F; 1 350 K) |
| nerozpustný | |
| −19,0 · 10 −6 cm 3 /mol | |
| Struktura | |
| tetragonální | |
| Termochemie | |
|
Standardní molární
entropie ( S |
56 J · mol −1 · K −1 |
|
Standardní entalpie
tvorby (Δ f H ⦵ 298 ) |
−285 kJ · mol −1 |
| Nebezpečí | |
| Bezpečnostní list | ICSC 0956 |
| Bod vzplanutí | Nehořlavé |
| NIOSH (limity expozice USA pro zdraví): | |
|
PEL (přípustné)
|
žádný |
|
REL (doporučeno)
|
PEL 2 mg/m 3 |
|
IDLH (bezprostřední nebezpečí)
|
ND |
| Související sloučeniny | |
|
Jiné anionty
|
Sulfid cínu selenid cínu Telurid cínu |
|
Jiné kationty
|
Oxid uhelnatý Oxid křemičitý Oxid germania (II) Oxid olovnatý |
| Oxid cínu | |
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Reference na infobox | |
Oxid cínatý ( oxid cínatý ) je sloučenina vzorce SnO. Je složen z cínu a kyslíku, kde má cín oxidační stav +2. Existují dvě formy, stabilní modročerná forma a metastabilní červená forma.
Příprava a reakce
Modročerný SnO je možno vyrobit zahříváním hydrátu oxidu cínu (II), SnO · xH 2 O (x <1) se vysráží, pokud je cín (II) soli nechá reagovat s hydroxidem alkalického kovu, jako hydroxidu sodného.
Metastabilní, červený SnO lze připravit jemným zahřátím sraženiny vytvořené působením vodného amoniaku na sůl cínu (II).
SnO lze v laboratoři připravit jako čistou látku řízeným zahříváním oxalátu cínatého ( cínavého oxalátu ) za nepřítomnosti vzduchu nebo v atmosféře CO 2 . Tato metoda se také používá k výrobě oxidu železitého a oxidu manganatého .
- SnC 2 O 4 · 2H 2 O → SnO + CO 2 + CO + 2 H 2 O
Oxid cínatý hoří na vzduchu slabým zeleným plamenem za vzniku SnO 2 .
- 2 SnO + O 2 → 2 SnO 2
Když se zahřívá v inertní atmosféře na počátku disproporcionace dochází dává Sn kovu a Sn 3 O 4 , který dále reaguje za vzniku SnO 2 a Sn kov.
- 4SnO → Sn 3 O 4 + Sn
- Sn 3 O 4 → 2SnO 2 + Sn
SnO je amfoterní , rozpouští se v silné kyselině za vzniku solí cínu (II) a v silné bázi za vzniku stannitů obsahujících Sn (OH) 3 - . To může být rozpuštěn v silně kyselých roztocích, aby iontové komplexy Sn (OH 2 ) 3 2+ a Sn (OH) (OH 2 ) 2 + , a v méně kyselých roztoků, čímž se získá Sn 3 (OH) 4 2+ . Všimněte si, že jsou také známy bezvodé stanity, např. K 2 Sn 2 O 3 , K 2 SnO 2 . SnO je redukční činidlo a předpokládá se, že redukuje měď (I) na kovové shluky při výrobě takzvaného „měděného rubínového skla“.
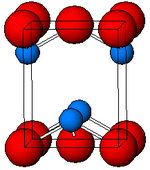
Struktura
Černý, α-SnO přijímá strukturu tetragonální vrstvy PbO obsahující čtyři souřadnicové čtvercové pyramidové atomy cínu. Tato forma se v přírodě vyskytuje jako vzácný minerál romarchit . Asymetrie je obvykle jednoduše připsána stericky aktivnímu osamělému páru; výpočty elektronové hustoty však ukazují, že asymetrie je způsobena vzájemnou vazbou orbitálů Sn (5s) a O (2p). Elektronická struktura a chemie osamělého páru určuje většinu vlastností materiálu.
U SnO byla pozorována nestechiometrie.
Mezera elektronického pásma byla naměřena mezi 2,5 eV a 3eV.
Využití
Dominantní použití oxidu cínatého je jako prekurzor při výrobě jiných, obvykle dvojmocných sloučenin nebo solí cínu. Oxid cínatý může být také použit jako redukční činidlo a při výrobě rubínového skla . Má menší použití jako esterifikační katalyzátor.
K osvětlení ultrafialovým světlem se používá oxid ceritý v keramické formě společně s oxidem cínatým (SnO).

