Přepis (biologie) - Transcription (biology)
Transkripce je proces kopírování segmentu DNA do RNA. O segmentech DNA přepsaných do molekul RNA, které mohou kódovat proteiny, se říká, že produkují messengerovou RNA (mRNA). Další segmenty DNA jsou kopírovány do molekul RNA nazývaných nekódující RNA (ncRNA). Průměrováno z více typů buněk v dané tkáni je množství mRNA více než 10krát větší než množství ncRNA (i když v konkrétních typech jednotlivých buněk mohou ncRNA přesahovat mRNA). Obecná převaha mRNA v buňkách je platná, i když méně než 2% lidského genomu lze transkribovat do mRNA ( lidský genom#kódující vs. nekódující DNA ), zatímco alespoň 80% savčí genomové DNA lze aktivně transkribovat (v jeden nebo více typů buněk), přičemž většina z těchto 80% je považována za ncRNA.
Obě DNA a RNA jsou nukleové kyseliny , které se používají párů bází z nukleotidů jako doplňkový jazyk. Během transkripce je sekvence DNA čtena RNA polymerázou, která produkuje komplementární, antiparalelní vlákno RNA nazývané primární transkript .
Přepis probíhá v následujících obecných krocích:
- RNA polymeráza, společně s jedním nebo více obecnými transkripčními faktory , se váže na promotorovou DNA .
- RNA polymeráza generuje transkripční bublinu , která odděluje dvě vlákna šroubovice DNA. To se provádí přerušením vodíkových vazeb mezi komplementárními nukleotidy DNA.
- RNA polymeráza přidává RNA nukleotidy (které jsou komplementární k nukleotidům jednoho řetězce DNA).
- Páteř RNA cukr-fosfát se tvoří s pomocí RNA polymerázy za vzniku řetězce RNA.
- Vodíkové vazby šroubovice RNA – DNA se rozbijí a uvolní nově syntetizované vlákno RNA.
- Pokud má buňka jádro , může být RNA dále zpracována. To může zahrnovat polyadenylaci , uzavření a spojování .
- RNA může zůstat v jádru nebo vystupovat do cytoplazmy prostřednictvím komplexu jaderných pórů .
Pokud je úsek DNA transkribován do molekuly RNA, která kóduje protein , RNA se nazývá messenger RNA (mRNA); mRNA zase slouží jako templát pro syntézu proteinu translací . Jiné úseky DNA mohou být transkribovány do malých nekódujících RNA, jako je mikroRNA , přenosová RNA (tRNA), malá nukleolární RNA (snoRNA), malá nukleární RNA (snRNA) nebo molekuly enzymatické RNA zvané ribozymy a také větší nekódující RNA, jako je ribozomální RNA (rRNA), a dlouhá nekódující RNA (lncRNA). Celkově RNA pomáhá syntetizovat, regulovat a zpracovávat bílkoviny; proto hraje zásadní roli při provádění funkcí v buňce.
Ve virologii může být termín transkripce také použit, když se odkazuje na syntézu mRNA z molekuly RNA (tj. Ekvivalent k replikaci RNA). Například genom viru jednovláknové RNA (ssRNA-) s negativním smyslem může být templátem pro jednovláknovou RNA s pozitivním smyslem (ssRNA +). Důvodem je, že řetězec pozitivního smyslu obsahuje informace o sekvenci potřebné k translaci virových proteinů potřebných pro replikaci viru . Tento proces je katalyzován replikázou virové RNA .
Pozadí
Transkripční jednotka DNA kódující protein může obsahovat jak kódující sekvenci , která bude translatována do proteinu, tak regulační sekvence , které řídí a regulují syntézu tohoto proteinu. Regulační sekvence před (" upstream " od) kódující sekvence se nazývá pět hlavních netranslatovaných oblastí (5'UTR); sekvence po (" downstream " od) kódující sekvenci se nazývá tři primární netranslatované oblasti (3'UTR).
Na rozdíl od replikace DNA vede transkripce k RNA komplementu, který obsahuje nukleotid uracil (U) ve všech případech, kdy by se v komplementu DNA vyskytoval thymin (T).
Pouze jeden ze dvou řetězců DNA slouží jako templát pro transkripci. Antisense řetězec DNA je čten RNA polymerázy z konec na 5' konci v průběhu 3' transkripce (3' → 5' ). Komplementární RNA je vytvořena v opačném směru, ve směru 5 '→ 3', přičemž odpovídá sekvenci smyslového řetězce s výjimkou přepnutí uracilu na thymin. Tato směrovost je způsobena tím, že RNA polymeráza může přidat nukleotidy pouze na 3 'konec rostoucího řetězce mRNA. Toto použití pouze 3 '→ 5' řetězce DNA eliminuje potřebu fragmentů Okazaki, které jsou vidět při replikaci DNA. Tím se také odstraní potřeba RNA primeru k zahájení syntézy RNA, jak je tomu v případě replikace DNA.
Non -template (sense) řetězec DNA se nazývá kódující vlákno , protože jeho sekvence je stejná jako nově vytvořené RNA transkriptu (s výjimkou substituce uracilu za thymin). Toto je vlákno, které se běžně používá při prezentaci sekvence DNA.
Transkripce má určité korektorské mechanismy, ale jsou méně a méně účinné než kontroly pro kopírování DNA. V důsledku toho má transkripce nižší věrnost kopírování než replikace DNA.
Hlavní kroky
Přepis je rozdělen na zahájení , únik promotoru , prodloužení a ukončení .
Nastavení pro přepis
Zesilovače, transkripční faktory, mediátorový komplex a DNA smyčky v transkripci savců

Nastavení pro transkripci u savců je regulováno mnoha cis-regulačními prvky , včetně jádrového promotoru a promotor-proximálních prvků, které jsou umístěny v blízkosti počátečních míst transkripce genů. Jádrové promotory kombinované s obecnými transkripčními faktory postačují k přímému zahájení transkripce, ale obecně mají nízkou bazální aktivitu. Další důležité cis-regulační moduly jsou lokalizovány v oblastech DNA, které jsou vzdálené od počátečních míst transkripce. Patří sem zesilovače , tlumiče , izolátory a upínací prvky. Mezi touto konstelací prvků mají zesilovače a jim přidružené transkripční faktory vedoucí úlohu při zahájení genové transkripce. Zesilovač lokalizovaný v oblasti DNA vzdálené od promotoru genu může mít velmi velký účinek na transkripci genu, přičemž některé geny procházejí až 100násobně zvýšenou transkripcí v důsledku aktivovaného zesilovače.
Enhancery jsou oblasti genomu, které jsou hlavními prvky regulace genů. Zesilovače kontrolují programy transkripce genů specifické pro buněčný typ, nejčastěji smyčkou na dlouhé vzdálenosti, aby se dostaly do fyzické blízkosti promotorů jejich cílových genů. Přestože existují stovky tisíc oblastí DNA zesilovače, pro konkrétní typ tkáně se do blízkosti promotorů, které regulují, dostanou pouze specifické zesilovače. Ve studii mozkových kortikálních neuronů bylo nalezeno 24 937 smyček, které přinesly zesilovače jejich cílovým promotorům. Několik zesilovačů, každý často v desítkách nebo stovkách tisíc nukleotidů vzdálených od jejich cílových genů, se smyčkou spojí se svými promotory cílového genu a mohou se navzájem koordinovat za účelem řízení transkripce jejich společného cílového genu.
Schematické znázornění v této části ukazuje smyčku zesilovače, aby se dostala do těsné fyzické blízkosti s promotorem cílového genu. Smyčka je stabilizována dimerem spojovacího proteinu (např. Dimerem CTCF nebo YY1 ), přičemž jeden člen dimeru je ukotven ke svému vazebnému motivu na zesilovači a druhý člen je ukotven ke svému vazebnému motivu na promotoru (reprezentovaném červené cikcaky na obrázku). Několik transkripčních faktorů specifických pro buněčnou funkci (v lidské buňce je asi 1 600 transkripčních faktorů) se obecně váže na specifické motivy na zesilovači a řídí se malá kombinace těchto transkripčních faktorů vázaných na zesilovač, když se přiblíží k promotoru pomocí smyčky DNA. úroveň transkripce cílového genu. Mediátor (komplex obvykle sestávající z přibližně 26 proteinů v interagující struktuře) komunikuje regulační signály z transkripčních faktorů vázaných na zesilovač DNA přímo k enzymu RNA polymerázy II (pol II) navázanému na promotor.
Pokud jsou zesilovače aktivní, jsou obecně transkribovány z obou řetězců DNA RNA polymerázami působícími ve dvou různých směrech, čímž se vytvoří dvě zesilovací RNA (eRNA), jak je znázorněno na obrázku. Neaktivní zesilovač může být vázán neaktivním transkripčním faktorem. Fosforylace transkripčního faktoru jej může aktivovat a aktivovaný transkripční faktor pak může aktivovat zesilovač, ke kterému je vázán (viz malá červená hvězda představující na obrázku fosforylaci transkripčního faktoru vázaného na zesilovač). Aktivovaný zesilovač začíná transkripci své RNA před aktivací transkripce messengerové RNA ze svého cílového genu.
Methylace a demetylace ostrova CpG
Regulace transkripce u přibližně 60% promotorů je také řízena methylací cytosinů v CpG dinukleotidech (kde 5 'cytosin následuje 3' guanin nebo CpG místa ). 5-methylcytosin (5-mC) je methylovaná forma cytosinu na bázi DNA (viz obrázek). 5-mC je epigenetický marker nacházející se převážně v místech CpG. V lidském genomu se vyskytuje asi 28 milionů dinukleotidů CpG. Ve většině tkání savců je v průměru methylováno 70% až 80% CpG cytosinů (tvořících 5-methylCpG nebo 5-mCpG). Metylované cytosiny v 3'-sekvencích cytosin-guanin 3 'se často vyskytují ve skupinách, nazývaných CpG ostrovy . Asi 60% sekvencí promotoru má ostrov CpG, zatímco pouze asi 6% sekvencí zesilovače má ostrov CpG. CpG ostrovy představují regulační sekvence, protože pokud jsou CpG ostrovy methylované v promotoru genu, může to snížit nebo umlčet transkripci genu.
Methylace DNA reguluje transkripci genu interakcí s proteiny domény methylové vazebné domény (MBD), jako je MeCP2, MBD1 a MBD2. Tyto MBD proteiny se nejsilněji vážou na vysoce methylované CpG ostrovy . Tyto MBD proteiny mají jak doménu vázající methyl-CpG, tak doménu transkripční represe. Vázají se na methylovanou DNA a navádějí nebo směrují proteinové komplexy s remodelací chromatinu a/nebo aktivitou modifikující histon na methylované CpG ostrovy. Proteiny MBD obecně potlačují místní chromatin, například katalyzováním zavedení represivních histonových značek nebo vytvořením celkového represivního chromatinového prostředí prostřednictvím remodelace nukleosomů a reorganizace chromatinu.
Jak bylo uvedeno v předchozí části, transkripční faktory jsou proteiny, které se vážou ke specifickým sekvencím DNA, aby regulovaly expresi genu. Vazebná sekvence pro transkripční faktor v DNA je obvykle dlouhá asi 10 nebo 11 nukleotidů. Jak bylo shrnuto v roce 2009, Vaquerizas et al. naznačeno, že existuje přibližně 1400 různých transkripčních faktorů kódovaných v lidském genomu geny, které tvoří asi 6% všech genů kódujících lidský protein. Asi 94% vazebných míst transkripčního faktoru (TFBS), která jsou spojena s geny reagujícími na signál, se vyskytuje v zesilovačích, zatímco pouze asi 6% takových TFBS se vyskytuje v promotorech.
Protein EGR1 je konkrétním transkripčním faktorem, který je důležitý pro regulaci methylace ostrovů CpG. EGR1 vazebné místo transkripčního faktoru se často nachází v zesilovací nebo promotorové sekvence. V savčím genomu je asi 12 000 vazebných míst pro EGR1 a asi polovina vazebných míst EGR1 je umístěna v promotorech a polovina v zesilovačích. Vazba EGR1 na jeho cílové vazebné místo DNA je necitlivá na methylaci cytosinu v DNA.
Zatímco v buňkách, které nejsou stimulovány, je detekovatelné pouze malé množství proteinu transkripčního faktoru EGR1, translace genu EGR1 do proteinu jednu hodinu po stimulaci se drasticky zvýší. Exprese proteinů transkripčního faktoru EGR1 v různých typech buněk může být stimulována růstovými faktory, neurotransmitery, hormony, stresem a zraněním. V mozku, když jsou aktivovány neurony, jsou proteiny EGR1 up-regulovány a vážou se (rekrutují) již existující enzymy TET1, které jsou v neuronech vysoce exprimovány. Enzymy TET mohou katalyzovat demetylaci 5-methylcytosinu. Když transkripční faktory EGR1 přivedou enzymy TET1 na vazebná místa EGR1 v promotorech, mohou enzymy TET demetylovat methylované ostrovy CpG na těchto promotorech. Po demetylaci mohou tyto promotory poté zahájit transkripci svých cílových genů. Stovky genů v neuronech jsou různě exprimovány po aktivaci neuronů prostřednictvím EGR1 náboru TET1 do methylovaných regulačních sekvencí v jejich promotorech.
Metylace promotorů se také mění v reakci na signály. Tři savčí DNA, methyltransferasess (DNMT1, DNMT3A a DNMT3B), katalyzují adici methylových skupin k cytosinům v DNA. Zatímco DNMT1 je „udržovací“ methyltransferáza, DNMT3A a DNMT3B mohou provádět nové methylace. Existují také dvě izoformy sestřihového proteinu produkované z genu DNMT3A : proteiny DNA methyltransferázy DNMT3A1 a DNMT3A2.
Izoforma sestřihu DNMT3A2 se chová jako produkt klasického bezprostředně časného genu a je například robustně a přechodně produkována po neuronální aktivaci. Tam, kde se izoforma DNA methyltransferázy DNMT3A2 váže a přidává k cytosinům methylové skupiny, se zdá být určeno posttranslačními modifikacemi histonu.
Na druhé straně nervová aktivace způsobuje degradaci DNMT3A1 doprovázenou sníženou methylací alespoň jednoho vyhodnoceného cíleného promotoru.
Zahájení
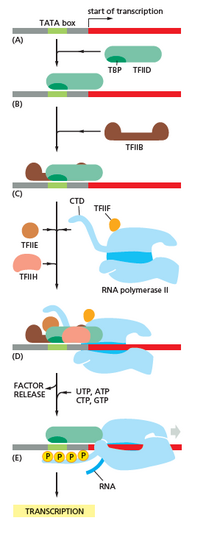
Transkripce začíná vazbou RNA polymerázy, společně s jedním nebo více obecnými transkripčními faktory , na specifickou sekvenci DNA označovanou jako " promotor " za vzniku "uzavřeného komplexu" RNA polymerázy-promotoru. V „uzavřeném komplexu“ je promotorová DNA stále plně dvouvláknová.
RNA polymeráza, podporovaná jedním nebo více obecnými transkripčními faktory, poté odvíjí přibližně 14 párů bází DNA za vzniku „otevřeného komplexu“ RNA polymerázy a promotoru. V „otevřeném komplexu“ je promotorová DNA částečně odvinuta a jednovláknová. Exponovaná jednovláknová DNA se označuje jako „transkripční bublina“.
RNA polymeráza, podporovaná jedním nebo více obecnými transkripčními faktory, pak vybere místo zahájení transkripce v transkripční bublině, váže se na iniciační NTP a prodlužující NTP (nebo krátký primer RNA a prodlužující NTP) komplementární k sekvenci místa zahájení transkripce a katalyzuje tvorbu vazby za vzniku počátečního produktu RNA.
U bakterií se RNA polymerázový holoenzym skládá z pěti podjednotek: 2 α podjednotky, 1 β podjednotka, 1 β 'podjednotka a 1 ω podjednotka. V bakteriích existuje jeden obecný transkripční faktor RNA známý jako sigma faktor . Enzym jádra RNA polymerázy se váže na faktor bakteriální obecné transkripce (sigma) za vzniku holoenzymu RNA polymerázy a poté se váže na promotor. (RNA polymeráza se nazývá holoenzym, když je podjednotka sigma připojena k jádrovému enzymu, který se skládá pouze ze 2 podjednotek α, 1 β podjednotky, 1 β 'podjednotky). Na rozdíl od eukaryot není iniciační nukleotid rodící se bakteriální mRNA uzavřen modifikovaným guaninovým nukleotidem. Iniciační nukleotid bakteriálních transkriptů nese 5'-trifosfát (5'-PPP), který lze použít pro mapování genomových míst iniciace transkripce v celém genomu.
U archea a eukaryot obsahuje RNA polymeráza podjednotky homologické s každou z pěti podjednotek RNA polymerázy v bakteriích a také obsahuje další podjednotky. U archea a eukaryot jsou funkce bakteriálního obecného transkripčního faktoru sigma prováděny několika obecnými transkripčními faktory, které spolupracují. V archaea existují tři obecné transkripční faktory: TBP , TFB a TFE . V eukaryotech je v RNA polymerázy II závislou transkripci, je šest obecné transkripční faktory: TFIIA , TFIIB (AN ortolog archaeal TFB), TFIID (a mnohopodsložkový faktor, ve kterém klíč podjednotku TBP , je ortolog archaeal TBP), TFIIE (AN ortolog archaeal TFE), TFIIF a TFIIH . TFIID je první složkou, která se váže na DNA v důsledku vazby TBP, zatímco TFIIH je poslední složkou, která se rekrutuje. U archea a eukaryot je uzavřený komplex RNA polymerázy a promotoru obvykle označován jako „ preiniciační komplex “.
Zahájení transkripce je regulováno dalšími proteiny, známými jako aktivátory a represory , a v některých případech přidruženými koaktivátory nebo korepresory , které modulují tvorbu a funkci komplexu iniciace transkripce.
Útěk promotéra
Po syntéze první vazby musí RNA polymeráza uniknout z promotoru. Během této doby existuje tendence uvolňovat transkript RNA a produkovat zkrácené transkripty. Toto se nazývá abortivní iniciace a je běžné pro eukaryoty i prokaryoty. Abortivní iniciace pokračuje, dokud není syntetizován RNA produkt s prahovou délkou přibližně 10 nukleotidů, v tomto okamžiku dojde k úniku promotoru a vytvoří se komplex prodloužení transkripce.
Mechanicky dochází k úniku promotoru skrz skrčení DNA , které poskytuje energii potřebnou k rozbití interakcí mezi holoenzymem RNA polymerázy a promotorem.
U bakterií se historicky předpokládalo, že sigma faktor je definitivně uvolněn poté, co nastane clearance promotoru. Tato teorie byla známá jako model povinného vydání. Pozdější údaje však ukázaly, že po a po vyčištění promotoru se sigma faktor uvolňuje podle stochastického modelu známého jako stochastický uvolňovací model .
V eukaryotech, na promotoru závislém na RNA polymeráze II, po vymizení promotoru TFIIH fosforyluje serin 5 na karboxy-koncové doméně RNA polymerázy II, což vede k náboru uzavíracího enzymu (CE). Přesný mechanismus toho, jak CE indukuje clearance promotoru v eukaryotech, není dosud znám.
Prodloužení
Jedno vlákno DNA, templátové vlákno (nebo nekódující vlákno), se používá jako templát pro syntézu RNA. Jak transkripce pokračuje, RNA polymeráza prochází templátovým řetězcem a využívá komplementaritu párování bází s templátem DNA k vytvoření kopie RNA (která se prodlužuje během procházení). Přestože RNA polymeráza prochází templátovým řetězcem od 3 '→ 5', kódující (bez templátového) vlákna a nově vytvořená RNA mohou být také použity jako referenční body, takže transkripci lze popsat jako 5 '→ 3'. Toto produkuje molekulu RNA z 5' → 3' , přesná kopie kódujícího řetězce (kromě toho, že thymines jsou nahrazeny uracilů a nukleotidy jsou složeny z ribosa (5-oxid), cukru, v níž má DNA deoxyribózu (jeden menší počet kyslíku atom) v páteři cukru a fosfátu).
Transkripce mRNA může zahrnovat více RNA polymeráz na jednom DNA templátu a více cyklů transkripce (amplifikace konkrétní mRNA), takže z jedné kopie genu lze rychle vyrobit mnoho molekul mRNA. Charakteristické rychlosti prodloužení u prokaryot a eukaryot jsou přibližně 10 až 100 nts/s. V eukaryotech však nukleosomy působí jako hlavní bariéry transkripce polymeráz během prodloužení transkripce. V těchto organismech může být pauza indukovaná nukleosomy regulována faktory prodloužení transkripce, jako je TFIIS.
Prodloužení také zahrnuje mechanismus korektury, který může nahradit nesprávně začleněné báze. U eukaryot to může odpovídat krátkým přestávkám během transkripce, které umožňují vazbu vhodných faktorů pro úpravu RNA. Tyto pauzy mohou být vlastní RNA polymeráze nebo v důsledku struktury chromatinu.
Ukončení
Bakterie používají pro ukončení transkripce dvě různé strategie-ukončení nezávislé na Rho a ukončení závislé na Rho. Při ukončení transkripce nezávislé na Rho se transkripce RNA zastaví, když nově syntetizovaná molekula RNA vytvoří vlásenkovou smyčku bohatou na GC, po níž následuje běh nás. Když se vytvoří vlásenka, mechanické napětí rozbije slabé vazby rU-dA, čímž se nyní naplní hybrid DNA-RNA. Tím se vytáhne poly-U transkript z aktivního místa RNA polymerázy, čímž se transkripce ukončí. U typu ukončení "závislého na Rho" proteinový faktor zvaný " Rho " destabilizuje interakci mezi templátem a mRNA, čímž uvolňuje nově syntetizovanou mRNA z elongačního komplexu.
Ukončení transkripce u eukaryot je méně dobře srozumitelné než u bakterií, ale zahrnuje štěpení nového transkriptu, po kterém následuje adice adenin nezávislá na šabloně na jeho novém 3 'konci, v procesu zvaném polyadenylace .
Role RNA polymerázy v posttranskripčních změnách v RNA
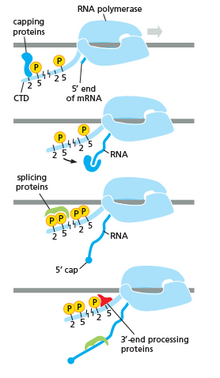
RNA polymeráza hraje velmi zásadní roli ve všech krocích, včetně post-transkripčních změn v RNA.
Jak je vidět na obrázku vpravo, je evidentní, že CTD (koncová doména C) je ocas, který mění svůj tvar; tento ocas bude použit jako nosič sestřihu, uzavření a polyadenylace , jak je znázorněno na obrázku vlevo.
Inhibitory
Inhibitory transkripce lze použít jako antibiotika například proti patogenním bakteriím ( antibakteriální ) a plísním ( antimykotika ). Příkladem takové antibakteriální látky je rifampicin , který inhibuje bakteriální transkripci DNA do mRNA inhibicí DNA polymerázy závislé na DNA vazbou její beta podjednotky, zatímco 8-hydroxychinolin je antifungální transkripční inhibitor. Účinky methylace histonu mohou také působit na inhibici účinku transkripce. Silné, bioaktivní přírodní produkty, jako je triptolid, které inhibují savčí transkripci prostřednictvím inhibice podjednotky XPB obecného transkripčního faktoru TFIIH, byly nedávno popsány jako konjugát glukózy pro cílení hypoxických rakovinotvorných buněk se zvýšenou expresí transportéru glukózy.
Endogenní inhibitory
V vertebrates, většina genových promotorů obsahuje CpG ostrov s četnými CpG míst . Když je methylováno mnoho míst CpG promotoru genu, gen se inhibuje (umlčí). Kolorektální karcinomy mají obvykle 3 až 6 mutací řidiče a 33 až 66 mutací stopaře nebo spolujezdce. Transkripční inhibice (umlčení) však může mít při postupu do rakoviny větší význam než mutace. Například u kolorektálních karcinomů je 600 až 800 genů transkripčně inhibováno methylací CpG Island (viz regulace transkripce u rakoviny ). K transkripční represi u rakoviny může dojít také jinými epigenetickými mechanismy, jako je změněná exprese mikroRNA . U rakoviny prsu může k transkripční represi BRCA1 docházet častěji nadměrně exprimovanou mikroRNA-182 než hypermethylací promotoru BRCA1 (viz Nízká exprese BRCA1 u rakoviny prsu a vaječníků ).
Továrny na přepis
Aktivní transkripční jednotky jsou seskupeny v jádru, v diskrétních místech nazývaných transkripční továrny nebo euchromatin . Taková místa lze vizualizovat tím, že se umožní polymerům zapojeným rozšířit jejich transkripty ve značených prekurzorech (Br-UTP nebo Br-U) a imunoznačit označenou rodící se RNA. Transkripční továrny mohou být také lokalizovány pomocí fluorescenční in situ hybridizace nebo označeny protilátkami namířenými proti polymerázám. V nukleoplazmě buňky HeLa je ~ 10 000 továren , mezi nimiž je ~ 8 000 továren na polymerázu II a ~ 2 000 továren na polymerázu III. Každá továrna na polymerázu II obsahuje ~ 8 polymeráz. Protože většina aktivních transkripčních jednotek je spojena pouze s jednou polymerázou, každá továrna obvykle obsahuje ~ 8 různých transkripčních jednotek. Tyto jednotky mohou být spojeny prostřednictvím promotorů a/nebo zesilovačů, přičemž smyčky tvoří kolem tohoto faktoru „oblak“.
Dějiny
Molekula, která umožňuje, aby byl genetický materiál realizován jako protein, byla poprvé hypotézována Françoisem Jacobem a Jacquesem Monodem . Severo Ochoa získal v roce 1959 Nobelovu cenu za fyziologii nebo medicínu za vývoj postupu pro syntézu RNA in vitro s polynukleotidovou fosforylázou , který byl užitečný pro prolomení genetického kódu . Syntéza RNA pomocí RNA polymerázy byla zavedena in vitro několika laboratořemi v roce 1965; RNA syntetizovaná těmito enzymy však měla vlastnosti, které naznačovaly existenci dalšího faktoru potřebného ke správnému ukončení transkripce.
V roce 1972 se Walter Fiers stal prvním člověkem, který skutečně dokázal existenci ukončujícího enzymu.
Roger D. Kornberg získal v roce 2006 Nobelovu cenu za chemii „za studium molekulárního základu eukaryotické transkripce “.
Měření a detekce

Přepis lze měřit a detekovat různými způsoby:
- Přepisový test kazety G-Less : měří sílu promotoru
- Test vypuštění transkripce : identifikuje místa zahájení transkripce (TSS)
- Nuclear run-on test: měří relativní nadbytek nově vytvořených transkriptů
- KAS-seq : měří jednovláknovou DNA generovanou RNA polymerázami; může pracovat s 1 000 buňkami.
- Test ochrany RNázy a ChIP-Chip z RNAP : detekovat aktivní místa transkripce
- RT-PCR : měří absolutní množství celkových nebo nukleárních hladin RNA, které se však mohou lišit od rychlosti transkripce
- Mikročipy DNA : měří relativní nadbytek globálních celkových nebo jaderných hladin RNA; tyto se však mohou lišit od rychlosti transkripce
- Hybridizace in situ : detekuje přítomnost transkriptu
- Značkování MS2 : začleněním kmenových smyček RNA , jako je MS2, do genu, se začlení do nově syntetizované RNA. Kmenové smyčky pak mohou být detekovány pomocí fúze GFP a obalového proteinu MS2, který má vysokou afinitu, sekvenčně specifickou interakci s kmenovými smyčkami MS2. Nábor GFP do místa transkripce je vizualizován jako jediné fluorescenční místo. Tento nový přístup odhalil, že k transkripci dochází v nespojitých dávkách nebo pulsech (viz Transkripční prasknutí ). S výraznou výjimkou technik in situ poskytuje většina ostatních metod průměry buněčné populace a nejsou schopny detekovat tuto základní vlastnost genů.
- Northern blot : tradiční způsob a až do příchodu RNA Seq , nejvíce kvantitativní
- RNA-Seq : aplikuje sekvenační techniky příští generace na sekvenování celých transkriptomů , což umožňuje měření relativní hojnosti RNA a také detekci dalších variací, jako jsou fúzní geny, posttranskripční úpravy a nová místa sestřihu
- Jednobuněčná RNA-Seq : amplifikuje a čte částečné transkriptomy z izolovaných buněk, což umožňuje detailní analýzu RNA v tkáních, embryích a rakovině
Reverzní přepis
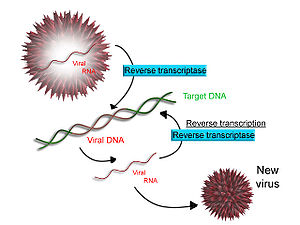
Některé viry (například HIV , původce AIDS ) mají schopnost přepisovat RNA do DNA. HIV má genom RNA, který je reverzně transkribován do DNA. Výsledná DNA může být sloučena s genomem DNA hostitelské buňky. Hlavní enzym zodpovědný za syntézu DNA z templátu RNA se nazývá reverzní transkriptáza .
V případě HIV je reverzní transkriptáza zodpovědná za syntézu komplementárního řetězce DNA (cDNA) do genomu virové RNA. Enzym ribonukleáza H poté štěpí vlákno RNA a reverzní transkriptáza syntetizuje komplementární vlákno DNA za vzniku struktury DNA s dvojitou šroubovicí („cDNA“). CDNA je integrována do genomu hostitelské buňky pomocí enzymové integrázy , která způsobuje, že hostitelská buňka generuje virové proteiny, které se znovu skládají do nových virových částic. HIV, v návaznosti na to, že hostitelská buňka podstoupí naprogramován buněčné smrti nebo apoptózy a T buněk . U jiných retrovirů však hostitelská buňka zůstává neporušená, protože virus z buňky vychází.
Některé eukaryotické buňky obsahují enzym s reverzní transkripční aktivitou zvaný telomeráza . Telomeráza je reverzní transkriptáza, která prodlužuje konce lineárních chromozomů. Telomeráza nese RNA templát, ze kterého syntetizuje opakující se sekvenci DNA neboli „nevyžádané“ DNA. Tato opakovaná sekvence DNA se nazývá telomera a lze ji považovat za „čepici“ chromozomu. Je to důležité, protože pokaždé, když se lineární chromozom duplikuje, zkrátí se. S touto „nevyžádanou“ DNA nebo „víčkem“ na koncích chromozomů zkracování eliminuje některé neesenciální, opakující se sekvence spíše než sekvenci DNA kódující protein, která je dále od konce chromozomu.
Telomeráza je často aktivována v rakovinných buňkách, aby rakovinným buňkám umožnila duplikovat své genomy na neurčito, aniž by ztratily důležitou sekvenci DNA kódující protein. Aktivace telomerázy by mohla být součástí procesu, který umožňuje rakovinným buňkám stát se nesmrtelnými . Bylo prokázáno, že imortalizující faktor rakoviny prostřednictvím prodloužení telomer v důsledku telomerázy se vyskytuje u 90% všech karcinogenních nádorů in vivo se zbývajícími 10% pomocí alternativní cesty udržování telomer zvané ALT nebo Alternativní prodloužení telomer.
Viz také
- Život
- Buněčná biologie)
- Buněčné dělení
- gen
- genová regulace
- genová exprese
- Epigenetika
- Genom
- Crickovo centrální dogma , ve kterém je produkt transkripce, mRNA, přeložen za vzniku polypeptidů a kde se tvrdí, že nikdy nedochází k reverzním procesům
- Genová regulace
- Dlouhá nekódující RNA
- Missense mRNA
- Sestřih - proces odstranění intronů z prekurzorové messengerové RNA ( pre -mRNA ) za vzniku messengerové RNA ( mRNA )
- Transkriptomika
- Překlad (biologie)
Reference
externí odkazy
- Interaktivní Java simulace zahájení transkripce. Archivováno 2011-07-22 na Wayback Machine z Centra pro modely života v Institutu Nielse Bohra.
- Interaktivní Java simulace transkripčního rušení-hra o dominanci promotoru v bakteriálním viru. Z Centra pro modely života v Institutu Nielse Bohra.
- Sbírka virtuální mobilní animace, představující přepis