Chlorid uranu (III) - Uranium(III) chloride
|
|
| Jména | |
|---|---|
|
Název IUPAC
Chlorid uranu (III)
|
|
| Ostatní jména
Chlorid uranu Chlorid
uranu Hypouranous chlorid |
|
| Identifikátory | |
|
3D model ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
| UNII | |
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Vlastnosti | |
| Cl 3 U | |
| Molární hmotnost | 344,38 g · mol −1 |
| Vzhled | Zelená krystalická pevná látka |
| Hustota | 5,500 g / cm 3 , kapalný |
| Bod tání | 837 ° C (1539 ° F; 1110 K) |
| Bod varu | 1657 ° C (3015 ° F; 1930 K) |
| Rozpustný | |
| Struktura | |
| Hybridizace | Odtržený trigonální prizmatický |
| Nebezpečí | |
| Bod vzplanutí | Nehořlavé |
| Nehořlavé | |
| Související sloučeniny | |
|
Související sloučeniny
|
Uran (IV) chlorid , uran (V) chlorid , uran (VI) chlorid |
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Reference na infobox | |
Uran (III) chlorid , UCL 3 , je chemická sloučenina , která obsahuje zemin uran a chloru . UCl 3 se používá převážně k přepracování vyhořelého jaderného paliva. Chlorid uranu je syntetizován různými způsoby z chloridu uranu ; nicméně, UCL 3 je méně stabilní než UCL 4 .
Příprava
Existují dva způsoby, jak syntetizovat chlorid uranitý. Následující postupy popisují, jak vyrábět chlorid uranitý.
(1) Do směsi NaCl-KCl při 670–710 ° C přidejte chlorid uranitý s kovem uranu.
(2) Zahřívejte chlorid uranitý v plynném vodíku.
Vlastnosti
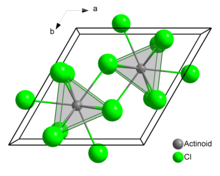
V pevném chloridu uranu (III) má každý atom uranu devět atomů chloru jako blízké sousedy, přibližně ve stejné vzdálenosti, v trojúhelníkové trigonální prizmatické konfiguraci.
Chlorid uranu (III) je při pokojové teplotě zelená krystalická pevná látka. UCl 3 taje při 837 ° C a vře při 1657 ° C. Uran (III) chlorid má hustotu 5500 kg / m 3 nebo 5.500 g / cm 3 .
Jeho hmotnostní složení:
- Chlor: 30,84%
- Uran: 69,16%
Jeho formální oxidační stavy:
- Chlor: -1
- Uran: +3
Chlorid uranu je velmi rozpustný ve vodě a je také velmi hygroskopický . UCl 3 je stabilnější v roztoku kyseliny chlorovodíkové .
Využití
Činidlo
Chlorid uranitý se používá při reakcích s tetrahydrofuranem (THF) a methylcyklopentadienem sodným k přípravě různých komplexů uranového metalocenu .
Katalyzátor
Uran (III) chlorid se používá jako katalyzátoru během reakce mezi lithiumaluminiumhydrid (LiAlH 4 ) a olefinů za vzniku alkylových hlinitanové sloučeniny.
Roztavená forma
Roztavená forma chloridu uranitého je typickou sloučeninou v pyrochemických procesech, protože je důležitá při přepracování vyhořelých jaderných paliv. UCl 3 je obvykle forma, kterou uran získává jako vyhořelé palivo v procesech elektrolytického rafinace.
Hydratuje
Existují tři hydráty chloridu uranitého:
- UCl 3 . 2H 2 O . 2CH 3 KN
- UCl 3 . 6H 2 O
- UCl 3 . 7H 2 O
Každý z nich je syntetizován redukcí chloridu uranitého v methylkyanidu ( acetonitrilu ) se specifickým množstvím vody a kyseliny propionové .
Opatření
I když neexistují žádné dlouhodobé údaje o toxické účinky thas UCL 3 , je důležité minimalizovat vystavení této sloučeniny, pokud je to možné.
Podobně jako jiné rozpustné sloučeniny uranu je UCl 3 pravděpodobně absorbován do krve alveolárními kapsami plic během několika dní po expozici. Expozice chloridu uranu (III) vede k toxicitě renálního systému .
Reference
- ^ Serrano, K .; Taxil, P .; Dugne, O .; Bouvet, S .; Puech, EJ Nucl. Mater. 2000, 282, 137–145.
- ^ Remsen, Ira. Anorganická chemie. New York: Henry Holt and Company, 1890.
- ^ Wells AF (1984) Structural Anorganic Chemistry 5. vydání Oxford Science Publications ISBN 0-19-855370-6
- ^ Comey, Arthur M .; Hahn, Dorothy A. Slovník chemických rozpustností: anorganický. New York: Společnost MacMillan, 1921.
- ^ Brenna, JG; Anderson, RA; Zalkin, A. Inorg. Chem. 1986, 25, 1756–1760.
- ^ Le Marechal, JF; Ephritikhine, M .; Folcher, GJ Organomet. Chem. 1986, 309, C1 – C3.
- ^ a b Okamoto, Y .; Madden, P .; Minato, KJ Nucl. Mater. 2005, 344, 109–114.
- ^ Okamoto, Y .; Kobayashi, F .; Ogawa, TJ Alloys Compd. 1998, 271, 355–358.
- ^ Mech, A .; Karbowick, M .; Lis, T. Polyhedron. 2006, 25, 2083–2092.
- ^ Bertell, Rosalie. „Veteráni z války v Perském zálivu a ochuzený uran.“ Květen 1999. Dostupné: http://ccnr.org/du_hague.html
externí odkazy
- Informace o chloridu uranu (III) na Webelements
- Chlorid uranitý International Bio-Analytical Industries, Inc.
- Depleted Uranium: Všechny otázky týkající se DU a syndromu války v Perském zálivu dosud nebyly zodpovězeny
