Kontrolní bod buněčného cyklu - Cell cycle checkpoint
Kontrolní body buněčného cyklu jsou kontrolní mechanismy v eukaryotickém buněčném cyklu, které zajišťují jeho správnou progresi. Každý kontrolní bod slouží jako potenciální koncový bod podél buněčného cyklu , během kterého se vyhodnocují podmínky buňky, přičemž postup v různých fázích buněčného cyklu nastává pouze při splnění příznivých podmínek. V buněčném cyklu je mnoho kontrolních bodů, ale tři hlavní jsou: kontrolní bod G1, také známý jako kontrolní nebo počáteční nebo omezovací kontrolní bod nebo hlavní kontrolní bod; G2 / M kontrolní bod ; a přechod metafáze na anafázi, také známý jako kontrolní bod vřetena . Progrese těmito kontrolními body je do značné míry určena aktivací cyklin-dependentních kináz regulačními proteinovými podjednotkami nazývanými cykliny , jejichž různé formy se vytvářejí v každém stádiu buněčného cyklu za účelem kontroly specifických událostí, ke kterým v nich dochází.
Pozadí
Všechny živé organismy jsou produkty opakovaných kol růstu a dělení buněk. Během tohoto procesu, známého jako buněčný cyklus , buňka duplikuje svůj obsah a poté se rozdělí na dvě části. Účelem buněčného cyklu je přesně duplikovat DNA každého organismu a poté buňku a její obsah rovnoměrně rozdělit mezi dvě výsledné buňky. U eukaryot se buněčný cyklus skládá ze čtyř hlavních fází: G 1 , během nichž je buňka metabolicky aktivní a kontinuálně roste; S fáze , během níž probíhá replikace DNA; G 2 , během kterého buněčný růst pokračuje a buňka syntetizuje různé proteiny v rámci přípravy na dělení; a fáze M ( mitóza ), během níž se duplikované chromozomy (známé jako sesterské chromatidy ) rozdělí na dvě dceřinná jádra a buňka se rozdělí na dvě dceřiné buňky, z nichž každá má úplnou kopii DNA. Ve srovnání s eukaryotickým buněčným cyklem je prokaryotický buněčný cyklus (známý jako binární štěpení ) relativně jednoduchý a rychlý: chromozom se replikuje od počátku replikace, sestaví se nová membrána a buněčná stěna vytvoří přepážku, která rozdělí buňku na dva.
Protože eukaryotický buněčný cyklus je složitý proces, vyvinula eukaryota síť regulačních proteinů, známých jako řídicí systém buněčného cyklu , který monitoruje a diktuje postup buňky buněčným cyklem. Tento systém funguje jako časovač nebo hodiny, které nastavují pevný čas, který buňka stráví v každé fázi buněčného cyklu, a zároveň také reaguje na informace přijaté z procesů, které řídí. Kontrolní body buněčného cyklu hrají důležitou roli v řídicím systému tím, že snímají defekty, ke kterým dochází během základních procesů, jako je replikace DNA nebo segregace chromozomů , a indukují zastavení buněčného cyklu v odezvě, dokud nejsou defekty opraveny. Hlavním mechanismem účinku kontrolních bodů buněčného cyklu je regulace aktivit rodiny proteinových kináz známých jako cyklin dependentní kinázy (CDK), které se vážou na různé třídy regulačních proteinů známých jako cykliny , se specifickými cyklinovými Komplexy CDK se vytvářejí a aktivují v různých fázích buněčného cyklu. Tyto komplexy zase aktivují různé navazující cíle k podpoře nebo prevenci progrese buněčného cyklu.
Kontrolní bod G 1 (omezení)
Kontrolní bod G1, také známý jako restrikční bod v savčích buňkách a počáteční bod v kvasinkách, je bod, ve kterém se buňka zavazuje vstoupit do buněčného cyklu. Jak buňka postupuje přes G1, v závislosti na vnitřních a vnějších podmínkách může buď zpozdit G1, vstoupit do klidového stavu známého jako G0 , nebo pokračovat za restrikční bod. Poškození DNA je hlavní indikací, že buňka „omezuje“ a nevstupuje do buněčného cyklu. Rozhodnutí zavázat se k novému kolu buněčného dělení nastává, když buňka aktivuje transkripci závislou na cyklinu a CDK, která podporuje vstup do S fáze. Tento kontrolní bod zajišťuje další postup.
Během raného G1 existují tři transkripční represory, známé jako kapesní proteiny, které se vážou na transkripční faktory E2F . Rodina genů E2F je skupina transkripčních faktorů, které se zaměřují na mnoho genů, které jsou důležité pro řízení buněčného cyklu, včetně cyklinů , CDK, regulátorů kontrolních bodů a proteinů pro opravu DNA. Nesprávná regulace rodiny E2F se často vyskytuje v případech rakoviny, což poskytuje důkaz, že rodina E2F je nezbytná pro přísnou regulaci replikace a dělení DNA. Tři kapesní proteiny jsou Retinoblastoma (Rb), p107 a p130, které se vážou na transkripční faktory E2F, aby zabránily progresi za kontrolní bod G1.
Genová rodina E2F obsahuje některé proteiny s aktivačními mechanismy a některé proteiny s represivními mechanismy. P107 a p130 působí jako korepresory pro E2F 4 a E2F 5, které pracují na potlačení transkripce faktorů podporujících G1-to-S. Třetí kapesní protein, Rb, se váže a potlačuje E2F 1, E2F 2 a E2F 3, což jsou proteiny E2F s aktivačními schopnostmi.
Pozitivní zpětná vazba hraje zásadní roli při regulaci postupu z G1 do S fáze, zejména zahrnuje fosforylaci Rb komplexem proteinu Cyclin/CDK. Rb bez fosfátu nebo nefosforylovaného Rb reguluje odchod a diferenciaci buněčného cyklu G0. Během začátku fáze G1 růstové faktory a poškození DNA signalizují vzestup hladin cyklinu D, který se poté váže na Cdk4 a Cdk6 za vzniku komplexu CyclinD: Cdk4/6. Je známo, že tento komplex deaktivuje Rb fosforylací. Podrobnosti o fosforylaci Rb jsou však ve srovnání s předchozími znalostmi o kontrolním bodě G1 poměrně složité a specifické. CyklinD: Cdk4/6 umístí pouze jeden fosfát nebo monofosforyláty, Rb na jedno ze svých čtrnácti přístupných a jedinečných fosforylačních míst. Každá ze čtrnácti specifických mono-fosforylovaných izoforem má odlišnou vazebnou preferenci vůči členům rodiny E2F, což pravděpodobně přispívá k rozmanitosti buněčných procesů v těle savce.
E2F 4 a E2F 5 jsou závislé na p107 a p130, aby si udržely svoji jadernou lokalizaci. Cyclin D: Cdk 4/6 však také fosforyluje p107 a p130, což je proces, který uvolňuje jejich vazbu z E2F 4 a 5 (které pak uniknou do cytoplazmy) a umožňuje E2F 1-3 vázat se na DNA a iniciovat transkripci proteinů Cyclin E. Rb si zachovávají svůj mono-fosforylovaný stav během rané fáze G1, zatímco cyklin E se hromadí a váže na Cdk2.
CyklinE: Cdk2 hraje další důležitou fosforylační roli při přechodu G1 na S. Zejména CyclinE: Cdk2 podporuje smyčku pozitivní zpětné vazby, která vytváří přepínač „všechno nebo nic“. V mnoha sítích genetické kontroly pozitivní zpětná vazba zajišťuje, že buňky neklouzají tam a zpět mezi fázemi buněčného cyklu. . Hyperfosforylace Rb je považována za pozdní restrikční bod G1, po kterém se buňka nemůže vrátit zpět v buněčném cyklu. V tomto okamžiku se proteiny E2F 1-3 váží na DNA a přepisují cyklin A a Cdc 6.
Cyklin-dependentní kinázový inhibitor 1B (CDKN1B), také známý jako p27, se váže na inhibici a brání aktivaci CyclinE: Cdk2. Jak se však cyklin A hromadí a váže na Cdk2, tvoří komplex a inhibují p27. Cyklinově závislá kináza fáze G1 spolupracuje s degradací cyklinu závislou kinázou závislou na p27 na fázi S27. Na druhé straně to umožňuje plnou aktivaci Cyclin A: Cdk2, komplexu, který fosforyluje E2F 1-3, čímž se zahájí jejich disociace z promotorových míst DNA. To umožňuje E2F 6-8 vázat se na DNA a inhibovat transkripci. Smyčka negativní zpětné vazby použitá k úspěšné inhibici inhibitoru p27 je dalším zásadním procesem, který buňky používají k zajištění jednosměrného pohybu a bez zpětného pohybu buněčným cyklem.
Když dojde k poškození DNA nebo když buňka detekuje jakékoli defekty, které vyžadují, aby zpozdila nebo zastavila buněčný cyklus v G1, dochází k zástavě několika mechanismy. Rychlá odezva zahrnuje fosforylační události, které začínají buď kinázou ATM ( mutovaná Ataxia telangiectasia ) nebo ATR (související s Ataxia Telangiectasia a Rad3 ), které fungují jako senzory v závislosti na typu poškození. Tyto kinázy fosforylují a aktivují efektorové kinázy Chk2, respektive Chk1, které zase fosforylují fosfatázu Cdc25A, čímž ji označují pro ubikvitinaci a degradaci. Protože Cdc25A aktivuje dříve uvedený komplex cyklinů E-CDK2 odstraněním inhibičních fosfátů z CDK2, v nepřítomnosti Cdc25A zůstává cyklin E-CDK2 neaktivní a buňka zůstává v G1.
K udržení zástavy je zahájena další reakce, pomocí které Chk2 nebo Chk1 fosforyluje p53, nádorový supresor, a to stabilizuje p53 tím, že mu brání ve vazbě na Mdm2, ubikvitin ligázu, která inhibuje p53 zacílením na degradaci. Stabilní p53 pak působí jako transkripční aktivátor několika cílových genů, včetně p21, inhibitoru komplexu cyklinu E-CDK2 podporujícího G1-to-S. Kromě toho je dalším mechanismem, kterým je p21 aktivován, akumulace p16 v reakci na poškození DNA. p16 narušuje cyklinové D-CDK4 komplexy, což způsobuje uvolnění p21 z komplexů, což vede k defosforylaci a aktivaci Rb, což umožňuje Rb vázat a inhibovat E2F 1-3, čímž brání buňce v přechodu do S fáze. V poslední době jsou některé aspekty tohoto modelu sporné.
Kontrolní bod G 2
Po replikaci DNA ve fázi S prochází buňka růstovou fází známou jako G2. Během této doby se produkují potřebné mitotické proteiny a buňka se znovu podrobí regulačním mechanismům, aby zajistila správný stav pro vstup do proliferativní mitotické (M) fáze. Do tohoto přechodu z G2 do M je zapojeno více mechanických kontrolních bodů se společným jednotícím faktorem aktivity cyklin-Cdk.
Ačkoli variace v požadovaných komplexech cyklin-Cdk existují napříč organismy, nezbytnost aktivity kinázy je zachována a typicky se zaměřuje na jediné párování. U štěpných kvasinek existují tři různé formy mitotických cyklinů a šest u pučících, ale primárním cyklinem je cyklin B. Cyklin B bude sloužit jako reference pro diskusi o přechodu kontrolního bodu G2/M.
Podobně jako v S fázi, G2 prochází kontrolním bodem poškození DNA. Buňka je ještě jednou vyšetřena na místa poškození DNA nebo neúplné replikace a kinázy ATR a ATM jsou přijaty na místa poškození. Aktivace Chk1 a Chk2 se také projevuje, stejně jako aktivace p53, k vyvolání zástavy buněčného cyklu a zastavení progrese do mitózy. Další složka S fáze, Pre-replikativní komplex, musí být inaktivována fosforylací cyklinu B-Cdk1.
Jak se hodnotí tyto předchozí kontrolní body, akumulace G2 proteinu slouží k aktivaci aktivity cyklinB-Cdk1 prostřednictvím více mechanismů. CyclinA-Cdk2 aktivuje Cdc25, aktivátor cyclinB-Cdk1, který poté deaktivuje inhibitor cyklinB-Cdk1, Wee1. Výsledkem je pozitivní zpětnovazební smyčka, která výrazně zvyšuje expresi cyclinB a aktivaci Cdk1. Jak buňka postupuje přes G2 a dosahuje přechodu G2/M, kináza Plk1 fosforyluje Wee1, který se zaměřuje na Wee1 pro degradaci prostřednictvím komplexu ubikvitin ligázy SCF. Další funkcí Plk1 je aktivace Cdc25 prostřednictvím fosforylace. Složený účinek degradace Wee1 a aktivace Cdc25 je čisté odstranění inhibiční fosforylace z cdc2, která aktivuje cdc2. Plk1 je aktivován při přechodu G2/M Aurora A a Bora, které se hromadí během G2 a tvoří aktivační komplex. Komplex Plk1-Cdc2-cdc25 poté iniciuje smyčku pozitivní zpětné vazby, která slouží k další aktivaci Cdc2, a ve spojení se zvýšením hladin cyklinu B během G2 pak výsledné komplexy cdc2-cyklin B poté aktivují navazující cíle, které podporují vstup do mitózy. Výsledná aktivita Cdk1 také aktivuje expresi Mem1-Fkh, G2/M přechodového genu. Rychlý nárůst aktivity cyclinB-Cdk1 je nezbytný, protože zahájení fáze M je událost typu vše nebo nic, která se účastní hystereze. Hystereze aktivity Cdk1 prostřednictvím cyklinu B pohání vstup do fáze M stanovením minimálního prahu koncentrace cyklinu B. To existuje na úrovni vyšší, než je minimum potřebné pro pokračování fáze M po vstupu, přičemž jedná o zajištění události vše nebo nic. Tato vstupní koncentrace se dále zvyšuje v případě neúplné replikace DNA přidáním dalšího regulačního mechanismu v bodě přechodu G2/M. Přítomnost hystereze umožňuje, aby byl vstup M fáze vysoce regulován jako funkce aktivity cyclinB-Cdk1.
Mechanismy, kterými je zabráněno vstupu mitózy v reakci na poškození DNA, jsou podobné mechanismům v kontrolním bodě G1/S. Poškození DNA spouští aktivaci výše uvedené dráhy ATM/ATR, ve které ATM/ATR fosforyluje a aktivuje kinázy kontrolního bodu Chk1/Chk2. Chk1/2 fosforyluje cdc25, který kromě toho, že je inhibován, je také izolován v cytoplazmě proteiny 14-3-3. 14-3-3 jsou upregulovány p53, který, jak již bylo zmíněno, je aktivován Chk1 a ATM/ATR. p53 také transaktivuje p21 a p21 i 14-3-3 zase inhibují komplexy cyklinu B-cdc2 prostřednictvím fosforylace a cytoplazmatického sekvestrování cdc2. Kromě toho má inaktivace cdc25 za následek jeho neschopnost defosforylovat a aktivovat cdc2. Konečně je dalším mechanismem reakce na poškození negativní regulace Plk1 pomocí ATM/ATR, což má za následek stabilizaci Wee1 a Myt1, které pak mohou fosforylovat a inhibovat cdc2, čímž se buňka zastaví v G2, dokud nedojde k poškození pevný.
Přechod G2-M v oocytech Xenopus
Na konci G2 buňka přechází do mitózy, kde se jádro rozděluje. Přechod G2 na M je dramatický; existuje efekt vše nebo nic a přechod je nevratný. To je pro buňku výhodné, protože vstup do mitózy je kritickým krokem v životním cyklu buňky. Pokud se plně nezaváže, buňka by narazila na mnoho problémů s částečným rozdělením, což by v konečném důsledku pravděpodobně vedlo ke smrti buňky.
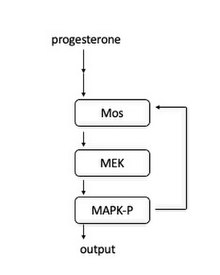
V žabích oocytech je signální kaskáda indukována, když se progesteron váže na membránově vázaný receptor. Po proudu je aktivován Mos. Mos poté fosforyluje MEK1, který fosforyluje MAPK. MAPK plní dvě role: aktivace komplexu CyclinB-Cdk1 k zahájení vstupu do mitózy a aktivace Mos. Aktivace Mos vede k pozitivní smyčce zpětné vazby, a proto funguje jako „přepínací přepínač“, který vytváří vstup do mitózy vše nebo nic.
Tato smyčka zpětné vazby byla poprvé nalezena ukázkou, že koncentrace MAPK-P (fosforylovaný MAPK) se zvyšovaly v reakci na rostoucí hladiny progesteronu. Na úrovni jedné buňky měla každá buňka buď úplně fosforylovaný MAPK, nebo žádný fosforylovaný MAPK, což potvrzuje, že v každé buňce funguje jako mechanismus podobný přepínači. Dále bylo ukázáno, že blokování syntézy proteinů Mos činí reakce MAPK-P více odstupňované, což ukazuje, že syntéza proteinu Mos je nezbytná pro charakter aktivace MAPK buď úplně nebo vůbec.
Bistabilita
Tento proces lze pochopit pomocí bistability. Pomocí grafu zobrazeného vpravo se rychlost syntézy Mos posouvá s přidáním dalšího progesteronu. S každou křivkou existují stabilní pevné body a nestabilní pevné body. Na nestabilních pevných bodech bude systém tlačit směrem k jednomu ze stabilních pevných bodů. Systém tedy může být buď ve stavu „zapnuto“ nebo „vypnuto“, nikoli mezi nimi. Když je hladina progesteronu dostatečně vysoká, křivka Mos se posune výše a nakonec protne degradační čáru pouze v jednom bodě, takže existuje pouze jeden stabilní stav „zapnuto“, což naznačuje vstup do mitózy.
Nevratnost, kterou vidíme v bodě přechodu mitózy, pochází z dostatečně vysokých hladin progesteronu v buňce. Při dostatečně vysokých hladinách progesteronu je systém monostabilní díky smyčce pozitivní zpětné vazby mezi Mapk a Mos. Bod, ve kterém se systém přepne z bistabilního na monostabilní, se nazývá bifurkace sedlového uzlu.
Můžeme tedy chápat nevratnou reakci mitotického přechodu vše nebo nic s matematickým modelem molekulárních regulátorů jako bistabilní systém, který závisí na existenci pozitivní zpětné vazby. „Vypnutý stav“ je zničen dostatečně vysokou hladinou progesteronu a jakmile se buňka dostane mimo stav mimo stav, pak se zasekne v zapnutém stavu.
Hystereze a model Novaka Tysona
Pocházíme-li z tohoto bistabilního modelu, můžeme mitotický přechod chápat tak, že se při jeho řízení spoléháme na hysterezi. Hystereze je definována jako závislost stavu systému na jeho historii. Novak Tyson Model je matematický model progrese buněčného cyklu, který předpovídá, že nevratné přechody vstupující a vystupující z mitózy jsou poháněny hysterezí. Tento model má tři základní předpovědi, které by měly platit při cyklování oocytových extraktů, jejichž postup buněčného cyklu závisí na hysterezi:
(1) Koncentrace cyklinu B nezbytná pro vstup do mitózy je vyšší než koncentrace potřebná k udržení mitotického extraktu v mitóze.
(2) Nereplikovaná DNA zvyšuje hladinu cyklinu nezbytného pro aktivaci Cdc2 a tedy vstup do mitózy.
(3) V koncentracích cyklinu B těsně nad aktivačním prahem dochází ke snížení rychlosti aktivace Cdc2.
Sha et al provedli experimenty s vaječnými extrakty Xenopus laevis v roce 2003, aby prokázali tuto hysteretickou povahu. Pomocí cyklických extraktů pozorovali, že práh aktivace pro Acyklin B je mezi 32 a 42 nM, zatímco práh pro deaktivaci je mezi 16 a 24 nM pro Acyklin B. Proto tyto experimenty potvrdily bistabilitu tohoto systému a důležitost hystereze v této buňce přechod cyklu. Při středních koncentracích cyklinu B je možný buď interfázní nebo mitotický stav buňky.
Reakce na stres replikace
Vzhledem k tomu, že vstup do mitózy je pro buňku velkým a nákladným závazkem, je logické, že by existovaly systémy, které by zabránily předčasnému vstupu do tohoto kroku. Bylo ukázáno, že chyby v předchozích krocích, jako je například nereplikované sekce DNA, blokují progresi v buněčném cyklu. Model Novak Tyson předpovídá, že k tomu dojde zvýšením hladiny cyklinu B nezbytného pro vstup do mitózy.
Sha a kol. zkoumali, zda je to pravda ve vaječných extraktech Xenopus . Aphidicolin (APH) použili k inhibici DNA polymerázy a zabránění replikace DNA. Při léčbě cyklinem B v mezifázi se práh aktivace zvýšil na 80 až 100 nM, jak předpovídal model Novak Tyson. Tyto experimenty tedy potvrzují, že stres nereplikované DNA v buňce ovlivňuje hysterezní smyčku a má za následek mnohem vyšší práh cyklinu B pro vstup do mitózy.
Kontrolní bod metafáze
Kontrolní bod mitotického vřetene se vyskytuje v bodě v metafázi, kde by všechny chromozomy měly/měly být zarovnány na mitotické destičce a být pod bipolárním napětím. Je pociťováno napětí vytvořené touto bipolární přílohou, které iniciuje vstup do anafáze. K tomu zajišťuje snímací mechanismus, aby již nebyl inhibován komplex podporující anafázu (APC/C), který nyní může degradovat cyklin B , který obsahuje D-box (destrukční box), a rozbít sekurin . Ten je protein, jehož funkcí je inhibovat separázu , která zase štěpí koheziny , proteinový kompozit zodpovědný za soudržnost sesterských chromatidů. Jakmile je tento inhibiční protein degradován ubikvitinací a následnou proteolýzou, separáza pak způsobí separaci sesterských chromatidů. Poté, co se buňka rozdělí na dvě dceřiné buňky, buňka vstoupí do G 1 .
Rakovina
Procesy opravy DNA a kontrolní body buněčného cyklu byly úzce spojeny s rakovinou díky jejich funkcím regulujícím stabilitu genomu a postup buněk. Přesné molekulární mechanismy, které spojují dysfunkce v těchto drahách s nástupem konkrétních rakovin, nejsou ve většině případů dobře známy. Bylo prokázáno, že ztráta ATM předchází vývoji lymfomu pravděpodobně v důsledku nadměrné homologní rekombinace, což vede k vysoké nestabilitě genomu. Narušení Chk1 u myší vedlo k významné nesprávné regulaci kontrolních bodů buněčného cyklu, akumulaci poškození DNA a zvýšenému výskytu tumorigeneze. Snad nejslavnější je, že dědičnost BRCA1 nebo BRCA2 s jednou mutací predisponuje ženy k rakovině prsu a vaječníků. Je známo, že BRCA1 je nezbytný pro přechody S a G2/M a podílí se na buněčné reakci na poškození DNA. Předpokládá se, že BRCA2 se podílí na homologní rekombinaci a regulaci kontrolního bodu fáze S a mutace nedostatků v BRCA2 jsou silně spojeny s tumorigenezí.
Viz také
- Biochemické spínače v buněčném cyklu
- Analýza buněčného cyklu
- Kontrolní bod poškození DNA G2-M
- Kontrolní bod po replikaci
- Kontrolní bod meiotické rekombinace