Ferricyanide - Ferricyanide
|
|
|
|
| Jména | |
|---|---|
|
Název IUPAC
hexacyanid železa (3+)
|
|
|
Systematický název IUPAC
hexacyanidoferrát (III) |
|
| Ostatní jména
hexacyanid železitý; hexacyanidoferrate (3−); hexacyanoferát (III)
|
|
| Identifikátory | |
|
3D model ( JSmol )
|
|
| ČEBI | |
| ChemSpider | |
| KEGG | |
|
PubChem CID
|
|
|
CompTox Dashboard ( EPA )
|
|
|
|
|
|
| Vlastnosti | |
| [Fe (CN) 6 ] 3− | |
| Související sloučeniny | |
|
Jiné kationty
|
Hexacyanonickelate (III) |
|
Související sloučeniny
|
Ferokyanid |
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|
|
|
|
| Reference na infobox | |
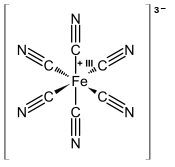
Ferricyanid je anion [Fe (CN) 6 ] 3− . Říká se mu také hexacyanoferát (III) a ve vzácném, ale systematickém názvosloví hexacyanidoferát (III). Nejběžnější solí tohoto aniontu je ferricyanid draselný , červený krystalický materiál, který se používá jako oxidant v organické chemii .
Vlastnosti
[Fe (CN) 6 ] 3− sestává ze středu Fe 3+ vázaného v oktaedrické geometrii na šest kyanidových ligandů . Komplex má O h symetrii . Železo má nízké otáčky a snadno se redukuje na příbuzný ferokyanidový ion [Fe (CN) 6 ] 4− , což je derivát železa (Fe 2+ ). Tento redoxní pár je reverzibilní a neznamená žádné vytváření ani lámání vazeb Fe -C:
- [Fe (CN) 6 ] 3− + e - ⇌ [Fe (CN) 6 ] 4−
Tento redoxní pár je standardem v elektrochemii .
Ve srovnání s kyanidy hlavní skupiny, jako je kyanid draselný , jsou ferricyanidy mnohem méně toxické kvůli silné vazbě mezi kyanidovým iontem (CN - ) a Fe 3+ . Reagují však s minerálními kyselinami a uvolňují vysoce toxický plynný kyanovodík .
Využití
Zpracování ferricyanidu solemi železa (II) poskytuje brilantní, dlouhotrvající pigment pruskou modrou , tradiční barvu modrotisků .
