Spliceosome - Spliceosome
Spliceosom je velká ribonukleoproteinového (RNP) komplex nachází především v jádru z eukaryotických buněk . Spliceosom je sestaven z malých jaderných RNA ( snRNA ) a mnoha proteinů (molekuly malé nukleární RNA (snRNA) se vážou na specifické proteiny za vzniku malého komplexu nukleárního ribonukleoproteinu (snRNP, vyslovováno „snurps“), který se zase kombinuje s dalšími snRNP tvoří velký ribonukleoproteinový komplex nazývaný spliceosom) . Spliceosom odstraňuje introny z přepsané pre-mRNA , což je typ primárního transkriptu . Tento proces se obecně nazývá spojování . Analogií je filmový střihač, který selektivně vystřihne irelevantní nebo nesprávný materiál (ekvivalent intronů ) z původního filmu a vyčištěnou verzi pošle řediteli k finálnímu střihu.
Někdy však RNA uvnitř intronu funguje jako ribozym, který se spojuje bez použití spliceosomu nebo proteinových enzymů.
Dějiny
V roce 1977 práce laboratoří Sharp a Roberts odhalila, že geny vyšších organismů jsou „rozděleny“ nebo přítomny v několika odlišných segmentech podél molekuly DNA. Kódující oblasti genu jsou odděleny nekódující DNA, která se nepodílí na expresi proteinu. Struktura rozštěpeného genu byla nalezena, když byly adenovirové mRNA hybridizovány na fragmenty štěpící endonukleázu jednovláknové virové DNA. Bylo pozorováno, že mRNA hybridů mRNA-DNA obsahovaly 5 ' a 3' konce nevodíkově vázaných oblastí. Když byly použity větší fragmenty virových DNA, byly při hybridizaci s virovými mRNA pozorovány rozvětvené struktury smyčkové DNA. Bylo zjištěno, že smyčkové oblasti, introny , jsou vyříznuty z prekurzorových mRNA v procesu Sharp s názvem „sestřih“. Následně bylo shledáno, že struktura štěpeného genu je společná většině eukaryotických genů. Phillip Sharp a Richard J. Roberts získali Nobelovu cenu za fyziologii nebo medicínu v roce 1993 za objev intronů a proces spojování.
Složení
Každý spliceosom se skládá z pěti malých jaderných RNA (snRNA) a řady souvisejících proteinových faktorů. Jsou-li tyto malé RNA v kombinaci s proteinovými faktory, dělají RNA-proteinové komplexy zvané snRNPs ( s mall n uclear r Ibo n ucleo p roteins, vyslovuje "snurps"). SnRNA, které tvoří hlavní spliceosom, se nazývají U1 , U2 , U4 , U5 a U6 , takzvaně proto, že jsou bohaté na uridin , a účastní se několika interakcí RNA-RNA a RNA-protein.
Sestavení spliceosomu probíhá na každé pre-mRNA (také známé jako heterogenní nukleární RNA, hn-RNA) na každém spojení exon: intron. Introny pre-mRNA obsahují specifické sekvenční prvky, které jsou rozpoznávány a využívány během sestřihu spliceosomu. Patří sem 5 'koncové sestřihové místo, sekvence rozvětveného bodu, polypyrimidinový trakt a 3' koncové sestřihové místo. Spliceosom katalyzuje odstranění intronů a ligaci lemujících exonů.
Introny typicky mají nukleotidovou sekvenci GU na 5 'koncovém místě sestřihu a AG na 3' konci místě sestřihu. 3 'místo sestřihu může být dále definováno proměnlivou délkou polypyrimidinů, nazývaných polypyrimidinový trakt (PPT), které slouží dvojí funkci náboru faktorů do místa sestřihu 3' a případně náboru faktorů do sekvence bodu větvení (BPS) . BPS obsahuje konzervovaný adenosin potřebný pro první krok sestřihu.
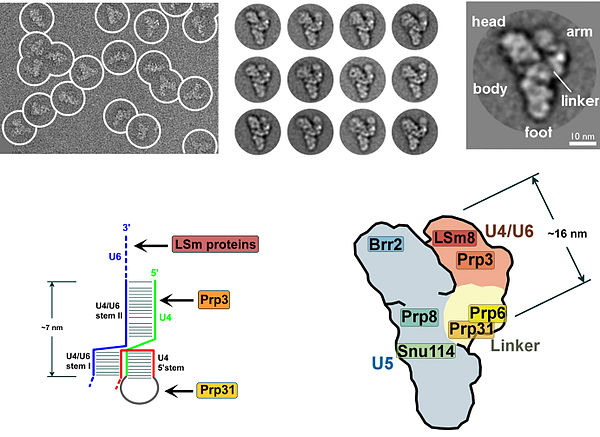
Mnoho proteinů vykazuje motiv vázající zinek, což podtrhuje důležitost zinku v sestřihovém mechanismu. První rekonstrukce molekulárního rozlišení trojitého malého nukleárního ribonukleoproteinového komplexu U4/U6.U5 (tri-snRNP) byla hlášena v roce 2016.
Cryo-EM byl rozsáhle aplikován Shi et al k objasnění blízké/atomové struktury spliceosomu v kvasinkách i u lidí. Molekulární rámec spliceosomu v téměř atomovém rozlišení ukazuje, že složka Spp42 U5 snRNP tvoří centrální lešení a ukotví katalytické centrum v kvasinkách. Atomová struktura lidského spliceosomu ilustruje krok II komponenta Slu7 přijímá rozšířenou strukturu, připravenou pro výběr 3'-spojovacího místa. Všech pět kovů (přiřazených jako Mg2+) v kvasinkovém komplexu je zachováno v lidském komplexu.
Alternativní spojování
Alternativní sestřih ( rekombinace různých exonů ) je hlavním zdrojem genetické rozmanitosti eukaryot. Varianty sestřihu byly použity k vysvětlení relativně malého počtu genů kódujících protein v lidském genomu , v současné době se odhaduje na přibližně 20 000. O jednom konkrétním genu Drosophila , Dscam , se spekulovalo, že je alternativně spojen do 38 000 různých mRNA , za předpokladu, že všechny jeho exony se mohou spojovat nezávisle na sobě.
Shromáždění
Model pro tvorbu aktivního místa spliceosomu zahrnuje uspořádanou, postupnou sestavu diskrétních částic snRNP na substrátu pre-mRNA. První rozpoznání pre-mRNA zahrnuje vazbu U1 snRNP na 5 'koncové místo sestřihu pre-mRNA a další faktory, které nejsou spojeny s snRNP, za vzniku komplexu vazeb nebo časného (E) komplexu u savců. Komplex závazků je komplex nezávislý na ATP, který zavazuje pre-mRNA do cesty sestřihu. U2 snRNP se rekrutuje do oblasti větve prostřednictvím interakcí s komponentou E komplexu U2AF (pomocný faktor U2 snRNP) a případně U1 snRNP. V reakci závislé na ATP se U2 snRNP pevně spojí se sekvencí bodu větvení (BPS) za vzniku komplexu A. Duplex vytvořený mezi U2 snRNP a oblastí větve pre-mRNA vyboulí větví adenosin, který jej specifikuje jako nukleofil pro první transesterifikace.
Přítomnost pseudouridinového zbytku v U2 snRNA, téměř naproti místu větvení, má za následek změněnou konformaci duplexu RNA-RNA po vazbě U2 snRNP. Konkrétně změněná struktura duplexu indukovaná pseudouridinem uvádí 2 'OH vypouklého adenosinu do výhodné polohy pro první krok sestřihu. Tri-snRNP U4/U5/U6 (viz obrázek 1) se rekrutuje do spojovacího spliceosomu za vzniku komplexu B a po několika přestavbách se komplex C aktivuje pro katalýzu. Není jasné, jak se tri-snRNP rekrutuje do komplexu A, ale tento proces může být zprostředkován interakcemi protein-protein a/nebo interakcemi párování bází mezi U2 snRNA a U6 snRNA.
U5 snRNP interaguje se sekvencemi v 5 'a 3' sestřihových místech prostřednictvím invariantní smyčky U5 snRNA a proteinové složky U5 interagují s oblastí 3 'sestřiženého místa.
Po náboru tri-snRNP předchází prvnímu katalytickému kroku několik přeuspořádání RNA-RNA a v katalyticky aktivním spliceosomu dochází k dalším přesmykům. Několik interakcí RNA-RNA se vzájemně vylučuje; není však známo, co spouští tyto interakce, ani pořadí těchto přeskupení. První přeskupení je pravděpodobně posunutí U1 snRNP z 5 'místa sestřihu a vytvoření interakce U6 snRNA. Je známo, že U1 snRNP je pouze slabě asociován s plně vytvořenými spliceozomy a U1 snRNP je inhibiční pro tvorbu interakce místa sestřihu U6-5 'na modelu substrátového oligonukleotidu obsahujícího krátký 5' exon a 5 'sestřihové místo. Vazba U2 snRNP na sekvenci rozvětveného bodu (BPS) je jedním příkladem interakce RNA-RNA vytěsňující interakci protein-RNA. Po náboru U2 snRNP je protein vázající větve SF1 ve vazebném komplexu vytlačen, protože vazebné místo U2 snRNA a SF1 jsou vzájemně se vylučující události.
V rámci U2 snRNA existují další vzájemně se vylučující přeskupení, ke kterým dochází mezi konkurenčními konformacemi. Například v aktivní formě je upřednostňována kmenová smyčka IIa; v neaktivní formě převládá vzájemně se vylučující interakce mezi smyčkou a navazující sekvencí. Není jasné, jak je U4 vytlačen z U6 snRNA, přestože se RNA podílí na sestavení spliceosomů a může fungovat tak, že uvolní U4/U6 a podpoří tvorbu interakce U2/U6 snRNA. Interakce U4/U6 kmenových smyček I a II se disociují a uvolněná oblast II kmenové smyčky U6 se sama složí a vytvoří intramolekulární kmenovou smyčku a U4 již není při dalším sestavování spliceosomů zapotřebí. Uvolněná oblast I kmenové smyčky párů bází U6 s U2 snRNA tvořící šroubovici U2/U6 I. Struktura šroubovice I se však vzájemně vylučuje s 3 'polovinou vnitřní 5' oblasti smyčky kmene U2 snRNA.
Menší spliceosome
Některé eukaryoty mají druhý spliceosom, takzvaný menší spliceosome . Skupina méně hojných snRNA, U11 , U12 , U4atac a U6atac , spolu s U5, jsou podjednotky menšího spliceosomu, který spojuje vzácnou třídu pre-mRNA intronů, označovaných jako typ U12. Menší spliceosom se nachází v jádře jako jeho hlavní protějšku, ačkoli existují výjimky, v některých specializovaných buněk, včetně krevních destiček a anucleate dendroplasm ( dendrit cytoplazmy) nervových buněk.
Reference
Další čtení
- Butcher SE (2011). „Kapitola 8. Spliceosome a jeho kovové ionty“. V Sigel A, Sigel H, Sigel RK (eds.). Strukturální a katalytické role kovových iontů v RNA . Kovové ionty v biologických vědách. 9 . Publikování RSC. s. 235–51. doi : 10,1039/9781849732512-00235 . ISBN 978-1-84973-094-5. PMID 22010274 .
- Nilsen TW (prosinec 2003). „Spliceosom: nejsložitější makromolekulární stroj v buňce?“ . BioEsays . 25 (12): 1147–9. doi : 10,1002/bies.10394 . PMID 14635248 .
externí odkazy
- 3D makromolekulární struktury spliceozomů z EM Data Bank (EMDB)
- Spliceosomes at the US National Library of Medicine Medical Subject Headings (MeSH)

