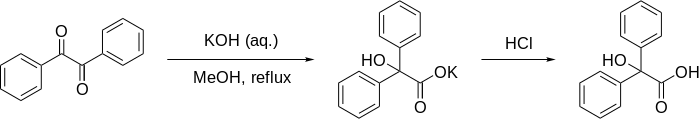
Přeuspořádání kyseliny benzilové - Benzilic acid rearrangement
Kyselina přesmyk benzilové je formálně 1,2-přesmyk z 1,2- diketonů vzniku a- hydroxy - karboxylových kyselin pomocí báze . Název této reakce pochází z reakce benzilu s hydroxidem draselným za vzniku kyseliny benzilové . Poprvé provedl Justus von Liebig v roce 1838, jedná se o první uváděný příklad přesmykové reakce . Stala se klasickou reakcí v organické syntéze a byla již mnohokrát přezkoumána. Lze to považovat za intramolekulární disproporcionační reakci, protože jedno uhlíkové centrum je oxidováno, zatímco druhé je redukováno.
Ukázalo se, že reakce probíhá v aromatických , semiaromatických, alifatických a heterocyklických substrátech. Reakce funguje nejlépe, když ketonové funkční skupiny nemají sousední enolizovatelné protony, protože to umožňuje konkurovat aldolové kondenzaci . Při použití na cyklické diketony je reakcí formálně kruhová kontrakce. Bylo zjištěno, že arylové skupiny snadněji migrují než alkylové skupiny a že arylové skupiny se skupinami přitahujícími elektrony migrují nejrychleji.
Reakční mechanismus
Reakce je zástupcem 1,2-přesmyku. Dlouhodobě zavedený reakční mechanismus poprvé jako celek navrhl Christopher Kelk Ingold a byl aktualizován pomocí in silico dat, jak je uvedeno níže. Reakce je druhého řádu celkově z hlediska rychlosti, je prvního řádu v diketonu a prvního řádu v bázi.
A hydroxid anion útoky jeden z ketonových skupin v 1 v nukleofilní adice za vzniku alkoxidu 2 . Další krok vyžaduje rotaci vazby na konformer 3, který umístí migrující skupinu R do polohy pro útok na druhou karbonylovou skupinu. Ve společném kroku migrující skupina R útočí na a-karbonylovou skupinu a vytváří další alkoxid se současnou tvorbou ketoskupiny na druhém uhlíku. Tento krok migrace je určující rychlostí . Tato sekvence připomíná nukleofilní acylovou substituci . Výpočty ukazují, že když R je methylová skupina, může být nárůst náboje na této skupině v přechodovém stavu až 0,22 a že methylová skupina je umístěna mezi centrální vazbou uhlík-uhlík!
Karboxylové kyseliny v meziproduktu 4, je menší než základní alkoxidu, a proto reverzibilní přenos protonu probíhá zvýhodňuje meziproduktu 5 , který je protonována na kyselém zpracování ke konečnému a- hydroxy - karboxylové kyseliny 6 . Výpočty ukazují, že je možný přesný popis reakční sekvence za účasti 4 molekul vody, které přebírají odpovědnost za stabilizaci nárůstu náboje. Poskytují také raketoplán pro efektivní přenos jednoho protonu při tvorbě meziproduktu 5 .
Výše uvedený mechanismus je v souladu se všemi dostupnými experimentálními důkazy. Rovnováha mezi druhy 1 a 2, je podporován 18 O izotopické značení experimentů. Ve deuterované vodě dochází k výměně karbonylového kyslíku mnohem rychleji než k přeskupení, což naznačuje, že první rovnováha není krokem určujícím rychlost. Další experimenty ukázaly větší relativní rychlost v deuterovaném rozpouštědlovém systému ve srovnání s nedeuterovaným rozpouštědlovým systémem jinak identického složení. To bylo vysvětleno jako způsobené větší relativní bazicitou deuterovaného hydroxidového aniontu ve srovnání s normálním hydroxidovým aniontem a bylo použito k označení, že k migraci vodíku nedošlo v kroku určujícím rychlost reakce. To vyloučilo společný mechanismus reakce, protože k přenosu vodíku by došlo v kroku určujícím rychlost.
Variace
Přesmyk benzylesteru
Tato reakce je identická s normálním přesmykem benzilové kyseliny, kromě toho, že místo hydroxidového iontu je použit alkoxid nebo amidový anion. Použitý alkoxid by neměl být snadno oxidovatelný (jako je ethoxid draselný ), protože to upřednostňuje redukční cestu Meerwein – Ponndorf – Verley jako vedlejší reakci. Reakce je druhého řádu celkově z hlediska rychlosti, přičemž je prvního řádu z hlediska alkoxidu a prvního řádu z hlediska diketonu. Produktem reakce je α- hydroxy - ester , nebo α-hydroxy- amid .
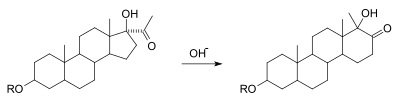
Přeskupení alfa-ketolu
Alfa-ketol přesmyk je interkonverze hydroxylové alfa ke karbonylu doplňkových karbonylové a hydroxylové skupiny, s migrací substituent. Je mechanicky ekvivalentní přeuspořádání kyseliny benzylové v bodě po napadení nukleofilu 1,2-dikarbonylovou skupinou. Je známo, že tato variace reakce se vyskytuje na mnoha substrátech nesoucích acyloinovou funkční skupinu. Obrázek níže ukazuje expanzi kruhu cyklopentanu na cyklohexanový kruh jako příklad reakce.