Chymotrypsin - Chymotrypsin
| Chymotrypsin | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Krystalografická struktura chymotrypsinogenu Bos taurus
| |||||||||
| Identifikátory | |||||||||
| Č. ES | 3.4.21.1 | ||||||||
| Č. CAS | 9004-07-3 | ||||||||
| Databáze | |||||||||
| IntEnz | Pohled IntEnz | ||||||||
| BRENDA | BRENDA vstup | ||||||||
| EXPAS | Pohled NiceZyme | ||||||||
| KEGG | KEGG vstup | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktury | Součet RCSB PDB PDBe PDB | ||||||||
| Genová ontologie | Amigo / QuickGO | ||||||||
| |||||||||
| Chymotrypsin C | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Č. ES | 3.4.21.2 | ||||||||
| Č. CAS | 9036-09-3 | ||||||||
| Databáze | |||||||||
| IntEnz | Pohled IntEnz | ||||||||
| BRENDA | BRENDA vstup | ||||||||
| EXPAS | Pohled NiceZyme | ||||||||
| KEGG | KEGG vstup | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktury | Součet RCSB PDB PDBe PDB | ||||||||
| |||||||||
Chymotrypsin ( EC 3.4.21.1 , chymotrypsiny A a B, alfa-chymar ophth, avazyme, chymar, chymotest, enzeon, quimar, quimotrase, alfa-chymar, alfa-chymotrypsin A, alfa-chymotrypsin) je složkou trávicího enzymu pankreatické šťávy působící v duodenu , kde provádí proteolýzu , rozpad proteinů a polypeptidů. Chymotrypsin přednostně štěpí peptidové amidové vazby, kde postranní řetězec N-konce aminokyseliny k štěpné amidové vazbě ( poloha P 1 ) je velká hydrofobní aminokyselina ( tyrosin , tryptofan a fenylalanin ). Tyto aminokyseliny obsahují ve svém postranním řetězci aromatický kruh, který zapadá do hydrofobní kapsy ( poloha S 1 ) enzymu. Aktivuje se v přítomnosti trypsinu . Hydrofobní a tvarová komplementarita mezi postranním řetězcem peptidového substrátu P 1 a dutinou vázající enzym S 1 odpovídá substrátové specificitě tohoto enzymu. Chymotrypsin také hydrolyzuje další amidové vazby v peptidu pomaleji, a to zejména ty, které obsahují leucin a methionin v P 1 polohy.
Strukturálně je to archetypální struktura pro svou superrodinu , PA klan proteáz.
Aktivace
Chymotrypsin je syntetizován v pankreatu proteinovou biosyntézou jako prekurzor zvaný chymotrypsinogen, který je enzymaticky neaktivní. Trypsin aktivuje chymotrypsinogen štěpením peptidových vazeb v polohách Arg15 - Ile16 a produkuje π -chymotrypsin. Na druhé straně, aminová skupina (-NH3 + ) zbytku Ile16 interaguje s postranním řetězcem Asp194, čímž vzniká "oxyanionový otvor" a hydrofobní "S1 kapsa". Chymotrypsin navíc indukuje svou vlastní aktivaci štěpením v polohách 14-15, 146-147 a 148-149 za vzniku a-chymotrypsinu (který je aktivnější a stabilnější než π-chymotrypsin). Výsledná molekula je molekula tří polypeptidů propojená disulfidovými vazbami .
Mechanismus účinku a kinetika
In vivo je chymotrypsin proteolytický enzym ( serinová proteáza ) působící v trávicím systému mnoha organismů. Usnadňuje štěpení peptidových vazeb hydrolytickou reakcí, která přesto, že je termodynamicky výhodná, probíhá extrémně pomalu v nepřítomnosti katalyzátoru. Hlavními substráty chymotrypsinu jsou peptidové vazby, ve kterých je N-koncovou aminokyselinou vazby tryptofan, tyrosin, fenylalanin nebo leucin. Jako mnoho proteáz, chymotrypsin také hydrolyzuje amidové vazby in vitro , což je vlastnost, která umožnila použití analogů substrátu, jako je N-acetyl-L-fenylalanin p-nitrofenylamid, pro enzymatické testy.
Chymotrypsin štěpí peptidové vazby útokem na nereaktivní karbonylovou skupinu silným nukleofilem, serinovým zbytkem 195 umístěným v aktivním místě enzymu, který se nakrátko kovalentně naváže na substrát a vytvoří meziprodukt enzym-substrát. Spolu s histidinem 57 a kyselinou asparagovou 102 tvoří tento serinový zbytek katalytickou trojici aktivního místa.
Tato zjištění se opírají o inhibiční testy a studium kinetiky štěpení výše uvedeného substrátu s využitím skutečnosti, že meziprodukt p -nitrofenolát enzym -substrát má žlutou barvu, což umožňuje měření jeho koncentrace měřením absorbance světla při 410 nm.
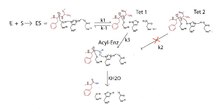
Chymotrypsinová katalýza hydrolýzy proteinového substrátu (červeně) se provádí ve dvou krocích. Za prvé, nukleofilita Ser-195 je zvýšena katalýzou obecné báze, při které je proton serinové hydroxylové skupiny přenesen na imidazolovou část His-57 během jejího útoku na elektronově deficientní karbonylový uhlík hlavního proteinového substrátu řetězec (krok k1). K tomu dochází prostřednictvím společného působení tří aminokyselinových zbytků v katalytické triádě. Nahromadění negativního náboje na výsledném tetraedrickém meziproduktu je stabilizováno v oxyanionové díře aktivního místa enzymu vytvořením dvou vodíkových vazeb na sousední amidové vodíky hlavního řetězce.
Imidazolová skupina His-57 vytvořená v kroku k1 je obecným kyselým katalyzátorem reakce k-1. Důkazy pro podobnou obecnou kyselou katalýzu reakce k2 (Tet2) však byly kontroverzní; voda zjevně poskytuje proton odcházející skupině aminů.
Rozpad Tet1 (přes k3) generuje acylový enzym, který je hydrolyzován pomocí His-57, který působí jako obecná báze (kH2O) za vzniku čtyřbokého meziproduktu, který se rozpadá za účelem regenerace serinové hydroxylové skupiny a také proteinového fragmentu s nově vytvořeným karboxylovým koncem.
Izozymy
|
|
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
Viz také
Reference
Další čtení
- Stryer L, Berg JM, Tymoczko JL (2002). Biochemie . San Francisco: WH Freeman. ISBN 0-7167-4684-0.
- Grisham CM, Reginald H (2005). Biochemie . Austrálie: Thomson Brooks/Cole. ISBN 0-534-49033-6.
externí odkazy
- Merops online databázi pro peptidáz a jejich inhibitorů: S01.001
- Chymotrypsin v Americké národní knihovně lékařských lékařských oborových nadpisů (MeSH)