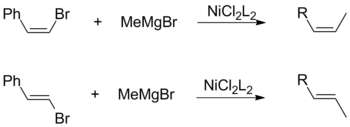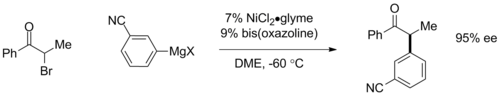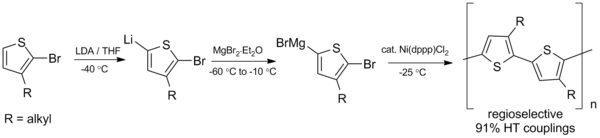Spojka Kumada - Kumada coupling
| Spojka Kumada | |
|---|---|
| Pojmenoval podle | Makoto Kumada |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | spojka kumada |
| RSC ontologické ID | RXNO: 0000144 |
V organické chemii je Kumadova vazba typem křížové vazebné reakce , která je užitečná pro vytváření vazeb uhlík-uhlík reakcí Grignardova činidla a organického halogenidu. Postup používá katalyzátory na bázi přechodného kovu , typicky nikl nebo palladium, pro spojení kombinace dvou alkylových , arylových nebo vinylových skupin . Skupiny Roberta Corriua a Makoto Kumady ohlásily reakci nezávisle v roce 1972.
Reakce je pozoruhodná tím, že patří mezi první uváděné metody katalytické křížové vazby. Navzdory následnému vývoji alternativních reakcí ( Suzuki , Sonogashira , Stille , Hiyama , Negishi ) se spojka Kumada nadále používá v mnoha syntetických aplikacích, včetně průmyslové výroby aliskirenu , hypertenze a polythiofenů , které jsou užitečné v organických elektronická zařízení.
Dějiny
První vyšetřování katalytické vazby Grignardových činidel s organickými halogenidy sahají až ke studii kobaltových katalyzátorů z roku 1941, kterou provedli Karasch a Fields. V roce 1971 Tamura a Kochi tuto práci zpracovali v řadě publikací, které ukazují životaschopnost katalyzátorů na bázi stříbra, mědi a železa. Tyto rané přístupy však vedly ke špatným výtěžkům v důsledku podstatné tvorby produktů homocouplingu, kde byly spojeny dva stejné druhy.
Tyto snahy vyvrcholily v roce 1972, kdy skupiny Corriu a Kumada současně oznámily použití katalyzátorů obsahujících nikl. Se zavedením palladiových katalyzátorů v roce 1975 skupinou Murahashi se rozsah reakce dále rozšířil. Následně bylo vyvinuto mnoho dalších spojovacích technik, které vyvrcholily Nobelovou cenou za chemii za rok 2010 uznanou Ei-ichi Negishi , Akirou Suzuki a Richardem F. Heckem za jejich přínos v této oblasti.
Mechanismus
Palladiová katalýza
Podle široce přijímaného mechanismu je palladiem katalyzovaná Kumadova vazba chápána jako analogie s rolí palladia v jiných křížových vazebných reakcích. Navrhovaný katalytický cyklus zahrnuje jak oxidační stavy palladia (0), tak palladia (II). Zpočátku se elektronově bohatý Pd (0) katalyzátor ( 1 ) vloží do vazby R – X organického halogenidu. Tato oxidační adice tvoří organo-Pd (II) -komplex ( 2 ). Následná transmetalace s Grignardovým činidlem vytváří heteroorganokovový komplex ( 3 ). Před dalším krokem je nutná izomerace, aby se organické ligandy vedle sebe dostaly do vzájemně cis poloh. Nakonec redukční eliminace ( 4 ) vytvoří vazbu uhlík-uhlík a uvolní produkt s křížovou vazbou při regeneraci katalyzátoru Pd (0) ( 1 ). U palladiových katalyzátorů k oxidačnímu přídavku, který často určuje rychlost, dochází pomaleji než u niklových katalyzátorových systémů.
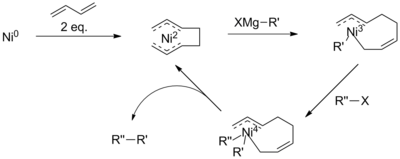
Niklová katalýza
Současné chápání mechanismu niklem katalyzované vazby je omezené. Ve skutečnosti se předpokládá, že reakční mechanismus probíhá odlišně za různých reakčních podmínek a při použití různých niklových ligandů. Obecně lze mechanismus popsat jako analogický ke schématu palladia (vpravo). Za určitých reakčních podmínek však mechanismus nedokáže vysvětlit všechna pozorování. Zkoumání Vicicem a spolupracovníky s použitím tridentátního terpyridinového ligandu identifikovalo meziprodukty katalytického cyklu Ni (II) -Ni (I) -Ni (III), což naznačuje komplikovanější schéma. Dále se předpokládá, že s přídavkem butadienu zahrnuje reakce meziprodukt Ni (IV).
Rozsah
Organické halogenidy a pseudohalogenidy
Vazba Kumada byla úspěšně prokázána pro různé aryl nebo vinylhalogenidy. Místo halogenidového činidla lze také použít pseudohalogenidy a ukázalo se, že vazba je docela účinná při použití druhů tosylátu a triflátu za různých podmínek.
Navzdory širokému úspěchu s arylovými a vinylovými vazbami je použití alkylhalogenidů méně obecné kvůli několika komplikujícím faktorům. Bez halogenových elektronů vyžadují alkylhalogenidy jiné oxidační adiční mechanismy než arylové nebo vinylové skupiny a tyto procesy jsou v současné době špatně pochopeny. Kromě toho přítomnost β-vodíků činí alkylhalogenidy citlivé na kompetitivní eliminační procesy.
Tyto problémy byly obcházeny přítomností aktivační skupiny, jako je karbonylová skupina v a-bromketonech, která řídí reakci vpřed. Vazby Kumada se však také prováděly s neaktivovanými alkylovými řetězci, často za použití dalších katalyzátorů nebo činidel. Například s přídavkem 1,3-butadienů Kambe a spolupracovníci prokázali niklem katalyzované alkylalkylové vazby, které by jinak byly nereaktivní.
I když to není dobře pochopeno, navrhuje se, aby mechanismus této reakce zahrnoval tvorbu komplexu oktadienylu a niklu. Předpokládá se, že tento katalyzátor nejprve podstoupí transmetalaci Grignardovým činidlem, před redukční eliminací halogenidu, čímž se sníží riziko eliminace β-hydridu. Přítomnost meziproduktu Ni (IV) je však v rozporu s mechanismy navrženými pro aryl nebo vinylhalogenidové vazby.
Grignardovo činidlo
Spojky zahrnující aryl a vinyl Grignardova činidla byly popsány v původních publikacích Kumady a Corriu. Alkyl Grignardova činidla lze také použít bez obtíží, protože netrpí eliminačními procesy p-hydridu. Ačkoli Grignardovo činidlo má ze své podstaty špatnou toleranci funkčních skupin, byly připraveny nízkoteplotní syntézy s vysoce funkcionalizovanými arylovými skupinami.
Katalyzátory
Spojky Kumada lze provádět s různými katalyzátory na bázi niklu (II) nebo palladia (II). Struktury katalytických prekurzorů mohou být obecně formulovány jako ML 2 X 2 , kde L je fosfinový ligand. Mezi běžné volby pro L 2 patří mimo jiné bidentátní difosfinové ligandy, jako jsou dppe a dppp .
Práce Fürstnera a spolupracovníků na katalyzátorech na bázi železa ukázaly přiměřené výtěžky. Katalytickou látkou v těchto reakcích se navrhuje být „anorganické Grignardovo činidlo“ sestávající z Fe (MgX)
2 .
Reakční podmínky
Reakce se typicky provádí v tetrahydrofuranu nebo diethyletheru jako rozpouštědle. Taková etherická rozpouštědla jsou vhodná, protože se jedná o typická rozpouštědla pro generování Grignardova činidla. Kvůli vysoké reaktivitě Grignardova činidla mají spojky Kumada omezenou toleranci funkčních skupin, což může být problematické ve velkých syntézách. Zejména Grignardova činidla jsou citlivá na protonolýzu i z mírně kyselých skupin, jako jsou alkoholy . Rovněž se přidávají do karbonylů a dalších oxidačních skupin.
Stejně jako v mnoha vazebných reakcích je katalyzátor na bázi přechodného kovu palladia často citlivý na vzduch a vyžaduje inertní prostředí reakce argonu nebo dusíku.
Ukázkový syntetický přípravek je k dispozici na webových stránkách Organic Syntheses .
Selektivita
Stereoselektivita
Oba cis- a trans- olefinové halogenidy podporují celkovou retenci geometrické uspořádání, když v kombinaci s alkyl Grignardova činidla. Toto pozorování je nezávislé na dalších faktorech, včetně volby ligandů katalyzátoru a vinylových substituentů.
Naopak, Kumadova vazba s použitím vinylových Grignardových činidel probíhá bez stereospecificity za vzniku směsi cis- a trans- alkenů. Stupeň izomerizace závisí na řadě faktorů, včetně poměrů činidel a identity halogenidové skupiny. Podle Kumady lze tuto ztrátu stereochemie přičíst vedlejším reakcím mezi dvěma ekvivalenty allylického Grignardova činidla.
Enantioselektivita
Asymetrické vazby Kumada lze uskutečnit pomocí chirálních ligandů. Při použití rovinných chirálních ferrocenových ligandů byly v arylových vazbách pozorovány enantiomerní přebytky (ee) vyšší než 95%. V poslední době Gregory Fu a spolupracovníci prokázali enantiokonvergentní vazby a-bromketonů za použití katalyzátorů na bázi bis-oxazolinových ligandů, přičemž chirální katalyzátor převádí racemickou směs výchozí látky na jeden enantiomer produktu až s 95% ee. Druhá reakce je také významná pro zapojení tradičně nepřístupné alkylhalogenidové vazby.
Chemoselektivita
Grignardova činidla se obvykle nespojují s chlorovanými areny. Tato nízká reaktivita je základem pro chemoselektivní pro vložení niklu do C-Br vazby bromochlorobenzenu použití Nicl 2 na bázi katalyzátoru.
Aplikace
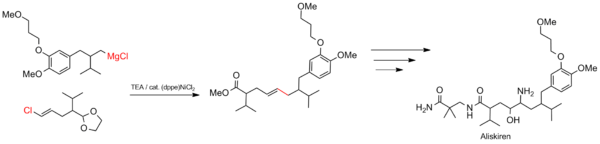
Syntéza aliskirenu
Spojka Kumada je vhodná pro velké průmyslové procesy, jako je syntéza léčiv. Reakce se používá ke konstrukci uhlíkové kostry aliskirenu (obchodní název Tekturna), který je léčbou hypertenze .
Syntéza polythiofenů
Kumadova vazba také ukazuje slib při syntéze konjugovaných polymerů , polymerů, jako jsou polyalkylthiofeny (PAT), které mají různé potenciální aplikace v organických solárních článcích a diodách emitujících světlo . V roce 1992 vyvinuli McCollough a Lowe první syntézu regioregulárních polyalkylthiofenů s využitím Kumadova vazebného schématu zobrazeného níže, které vyžaduje teploty pod bodem mrazu.
Od této počáteční přípravy byla syntéza vylepšena, aby se získaly vyšší výtěžky a fungovala při teplotě místnosti.
Viz také
- Heck reakce
- Hiyama spojka
- Suzukiho reakce
- Spojka Negishi
- Petasis reakce
- Stilleho reakce
- Sonogashira spojka