Maltase - Maltase
| Alfa-glukosidáza | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| Identifikátory | |||||||||
| Č. ES | 3.2.1.20 | ||||||||
| Č. CAS | 9001-42-7 | ||||||||
| Databáze | |||||||||
| IntEnz | Pohled IntEnz | ||||||||
| BRENDA | BRENDA vstup | ||||||||
| EXPAS | Pohled NiceZyme | ||||||||
| KEGG | KEGG vstup | ||||||||
| MetaCyc | metabolická cesta | ||||||||
| PRIAM | profil | ||||||||
| PDB struktury | Součet RCSB PDB PDBe PDB | ||||||||
| |||||||||
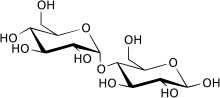
Maltáza ( EC 3.2.1.20 , alfa-glukosidasa , glukovertvertasa , glukosidosukasa , maltase-glukoamylasa , alfa-glukopyranosidasa , glukosidoinvertasa , alfa-D-glukosidasa , alfa-glukosidhydrolasa , alfa-1,4-glukosidasa , alfa-D-glukosid gluko ) je jeden typ alfa-glukosidázových enzymů umístěných v okraji štětce tenkého střeva. Tento enzym katalyzuje hydrolýzu disacharidové maltózy na dva jednoduché cukry glukózy. Maltáza se nachází v rostlinách, bakteriích, kvasinkách, lidech a dalších obratlovcích. Předpokládá se, že je syntetizován buňkami sliznice lemující střevní stěnu.
Trávení škrobu vyžaduje šest střevních enzymů. Dva z těchto enzymů jsou luminální endo-glukosidázy pojmenované alfa-amylázy. Další čtyři enzymy byly identifikovány jako různé maltázy, exo-glukosidázy vázané na luminální povrch enterocytů. Dvě z těchto aktivit maltázy byly spojeny se sacharázou-izomaltázou (maltáza Ib, maltáza Ia). Další dvě maltázy bez rozlišovacích charakteristik byly pojmenovány maltase-glukoamyláza (maltázy II a III). Aktivity těchto čtyř maltáz jsou také popsány jako alfa-glukosidáza, protože všechny štěpí lineární škrobové oligosacharidy na glukózu.
Ve většině případů je ekvivalentní alfa-glukosidáze , ale termín „maltáza“ zdůrazňuje disacharidovou povahu substrátu, ze kterého je štěpena glukóza, a „alfa-glukosidáza“ zdůrazňuje vazbu, ať už je substrátem disacharid nebo polysacharid .
Upíří netopýři jsou jedinými obratlovci, o nichž je známo, že nevykazují aktivitu střevní maltázy.
Struktura
Maltáza je součástí skupiny střevních enzymů nazývaných FamilyGH13 ( rodina glykosidhydrolázy 13 ), které jsou zodpovědné za rozpad a-glukosidázových vazeb komplexních sacharidů na snadno použitelné molekuly glukózy. Molekuly glukózy by pak byly použity jako druh "potravy" pro buňky k výrobě energie ( adenosintrifosfát ) během buněčného dýchání . Následují geny, které mohou kódovat maltázu:
- Kyselá alfa-glukosidáza, která je kódována v genu GAA, je nezbytná pro štěpení komplexních cukrů nazývaných glykogen na glukózu.
- Při trávení škrobů hraje roli maltázová glukoamyláza kódovaná genem MGAM. Díky tomuto enzymu u lidí jsou škroby rostlinného původu schopné trávit.
- Sacharasa-izomaltáza kódovaná v genu SI je nezbytná pro trávení sacharidů včetně škrobu, sacharózy a isomaltózy.
- Alfa-amyláza 1, kódovaná na genu AMY1A, je zodpovědná za štěpení vazeb a-glukosidázy v oligosacharidech a polysacharidech za účelem výroby škrobů a glykogenu, které mohou katalyzovat předchozí enzymy. Bylo prokázáno, že vyšší množství tohoto genu v mozku snižuje riziko Alzheimerovy choroby .
Mechanismus
Mechanismem všech enzymů FamilyGH13 je přerušení vazby a-glukosidázy hydrolyzováním. Maltáza se zaměřuje na rozbití maltózy, disacharidu, který je spojnicí mezi 2 jednotkami glukózy, na vazbě α- (1-> 4). Rychlost hydrolýzy je řízena velikostí substrátu (velikost sacharidů).
Průmyslové aplikace
Alfa-amyláza má důležitou funkci při degradaci škrobů, proto se extrémně běžně používá v pekárenském průmyslu. Většinou se používá jako prostředek zlepšující chuť ke zlepšení kvality chleba. Bez alfa-amylázy by kvasinky nemohly kvasit.
Maltóza-glukoamyláza se běžně používá jako zdroj kvašení, protože je schopna rozřezat škrob na maltózu, která se pak používá k vaření piva a saké.
Kromě vaření piva byla maltózová glukoamyláza studována zavedením specifických inhibitorů k zastavení hydrolýzy vazeb a-glukosidázy. Inhibicí štěpení vazeb vědci doufají, že navrhnou lék, který by byl účinnější a méně toxický pro léčbu diabetu.
Dějiny
Historie objevu maltázy začala, když Napoleon Bonaparte vyhlásil ve svém „berlínském dekretu“ v roce 1806 kontinentální blokádu. To zahájilo hledání alternativních zdrojů cukru. V roce 1833 francouzští chemici Anselm Payen a Jean-Francois Persoz objevili sladový extrakt, který přeměňoval škrob na glukózu, kterou v té době nazývali diastáza. V roce 1880 objevil HT Brown aktivitu slizniční maltázy a odlišil ji od diastázy, nyní nazývané amyláza. V 60. letech 20. století pokroky v proteinové chemii umožnily Arne Dahlqvistovi a Giorgio Semenza frakcionovat a charakterizovat aktivity maltázy tenkého střeva. Obě skupiny ukázaly, že existují čtyři hlavní frakce aktivity maltázy, které byly vlastní dvěma různým peptidovým strukturám, sacharáze-izomaltáze a maltase-glukoamyláze. O padesát let později vstupující do genomového věku, klonování a sekvenování hydrolázy slizničního škrobu potvrdily nálezy Dahlqvista a Semenzy.
Nedostatek maltázy
Nedostatek kyselé maltázy (AMD), známý také jako Pompeho choroba, byl poprvé popsán nizozemským patologem JC Pompeem v roce 1932. AMD je autosomálně recesivní stav nesouvisející s pohlavím, ve kterém se nadměrná akumulace glykogenu hromadí v lyzozomálních vakuolách téměř ve všech typech buněk po celém těle. tělo. Je to jedna z vážnějších chorob ukládání glykogenu postihujících svalovou tkáň.
AMD je rozdělena do tří samostatných typů podle věku nástupu symptomů u postiženého jedince. Infantilní (typ a), dětství (typ b) a dospělost (typ c). Typ AMD je určen typem genové mutace lokalizované na 17q23. Typ mutace určí úroveň produkce kyselé maltázy. AMD je extrémně fatální. Typ obecně zemřít na srdeční selhání před věkem jeden. Typ b zemře na respirační selhání ve věku od tří do dvaceti čtyř let. Typ c zemře na respirační selhání 10-20 let od nástupu symptomů.
Viz také
Reference
externí odkazy
- Maltázy v USA Národní lékařská knihovna Lékařské předměty (MeSH)
- Struktura a vývoj savčí maltázy-glukoamylázy a sacharázy-izomaltázy