Fenylalaninhydroxyláza - Phenylalanine hydroxylase
Fenylalaninhydroxyláza ( PAH ) ( EC 1.14.16.1 ) je enzym, který katalyzuje hydroxylaci aromatického postranního řetězce fenylalaninu za vzniku tyrosinu . PAH je jedním ze tří členů hydroxyláz aromatických aminokyselin závislých na biopterinu , třídy monooxygenázy, která pro katalýzu používá tetrahydrobiopterin (BH 4 , pteridinový kofaktor) a nehemové železo. Během reakce je molekulární kyslík heterolyticky štěpen sekvenčním začleněním jednoho atomu kyslíku do BH 4 a fenylalaninového substrátu. U lidí mohou mutace v jeho kódujícím genu PAH vést k metabolické poruše fenylketonurie .
Enzymový mechanismus
Předpokládá se, že reakce probíhá v následujících krocích:
- vytvoření můstku Fe (II) -OO-BH 4 .
- heterolytické štěpení vazby OO za vzniku ferryl oxo hydroxylačního meziproduktu Fe (IV) = O
- útok na Fe (IV) = O na hydroxylaci substrátu fenylalaninu na tyrosin.
Vznik a štěpení železo-peroxypterinového můstku. Ačkoli důkazy silně podporují Fe (IV) = O jako hydroxylační meziprodukt, mechanistické detaily, které jsou základem vzniku můstku Fe (II) -OO-BH 4 před heterolytickým štěpením, zůstávají kontroverzní. Byly navrženy dvě cesty založené na modelech, které se liší blízkostí železa k pterinovému kofaktoru a počtem molekul vody, o nichž se předpokládá, že jsou během katalýzy koordinovány železem. Podle jednoho modelu se nejprve vytvoří komplex dioxygenu železa a stabilizuje se jako rezonanční hybrid Fe 2+ O 2 a Fe 3+ O 2 - . Aktivovaný O 2 pak útočí na BH 4 , tvořící přechodový stav charakterizovaný separací náboje mezi elektronovým pterinovým prstencem a elektronově bohatým druhem dioxygenu. Následně je vytvořen můstek Fe (II) -OO-BH 4 . Na druhé straně byla tvorba tohoto mostu modelována za předpokladu, že BH4 se nachází v první koordinační skořápce železa a že železo není koordinováno s žádnými molekulami vody. Tento model předpovídá jiný mechanismus zahrnující pterinový radikál a superoxid jako kritické meziprodukty. Jakmile je vytvořen, Fe (II), -OO-BH 4 most je proražen heterolytic štěpením OO vazbou na Fe (IV) = O a 4a-hydroxytetrahydrobiopterin; molekulární kyslík je tedy zdrojem obou atomů kyslíku použitých k hydroxylaci pterinového kruhu a fenylalaninu.
Hydroxylace fenylalaninu ferryl oxo meziproduktem. Protože mechanismus zahrnuje Fe (IV) = O (na rozdíl od peroxypterin) hydroxylace meziprodukt oxidace BH 4 kofaktoru a hydroxylace fenylalaninu mohou být odděleny, což vede k neproduktivním spotřeby BH4 a tvorbou H2O2. Když je produktivní, je meziprodukt Fe (IV) = O přidán k fenylalaninu v elektrofilní aromatické substituční reakci, která redukuje železo z ferrylu do stavu železa. Ačkoli byl původně navržen arenoxid nebo radikálový meziprodukt, analýzy příbuzných tryptofanů a tyrosinhydroxyláz naznačují, že reakce místo toho probíhá přes kationtový meziprodukt, který vyžaduje, aby Fe (IV) = O byla koordinována s vodním ligandem spíše než s hydroxoskupinou . Tento kationtový meziprodukt následně podstoupí 1,2-hydridový NIH posun, čímž se získá dienonový meziprodukt, který se poté tautomerizuje za vzniku tyrosinového produktu. Pterinu kofaktor se regeneruje hydratace karbinolamin produktu PAH do quinonoid dihydrobiopterin (qBH 2 ), který se pak redukuje na BH 4 .
Regulace enzymů
PAH se navrhuje použít morfeeinový model alosterické regulace .
Savčí PAH existuje v rovnováze sestávající z tetramerů dvou odlišných architektur, s jednou nebo více dimerními formami jako součástí rovnováhy. Toto chování je v souladu s disociativním alosterickým mechanismem.
Mnoho studií naznačuje, že savčí PAH vykazuje chování srovnatelné s porfobilinogen syntázou (PBGS), přičemž se uvádí, že různé faktory, jako je pH a vazba ligandu, ovlivňují aktivitu enzymu a stabilitu proteinu.
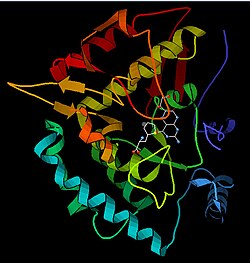
Struktura
Monomer PAH (51,9 kDa) se skládá ze tří odlišných domén: regulační N-koncová doména (zbytky 1–117), která obsahuje subdoménu ACT vázající Phe, katalytickou doménu (zbytky 118–427) a C-koncovou doménu (zbytky 428–453) zodpovědné za oligomerizaci identických monomerů. Byla provedena rozsáhlá krystalografická analýza, zejména na katalytické doméně koordinované pterinem a železem, aby se prozkoumalo aktivní místo. Byla také stanovena struktura N-koncové regulační domény a společně s vyřešenou strukturou C-koncové tetramerizační domény homologní tyrosinhydroxylázy byl navržen strukturní model tetramerního PAH. Pomocí rentgenové krystalografie byla experimentálně stanovena struktura krysí PAH v plné délce a ukázala autoinhibovanou nebo klidovou formu enzymu. Forma klidového stavu (RS-PAH) je architektonicky odlišná od aktivované formy (A-PAH). Struktura A-PAH v plné délce v současné době chybí, ale bylo stanoveno rozhraní ACT-ACT stabilizované Phe, které je charakteristické pro A-PAH, a byl navržen strukturní model A-PAH na základě analýzy SAXS.
Katalytická doména
Vyřešené krystalické struktury katalytické domény naznačují, že aktivní místo se skládá z otevřené a prostorné kapsy lemované primárně hydrofobními zbytky, ačkoli jsou přítomny také tři zbytky kyseliny glutamové, dva histidiny a tyrosin a vážou železo. Existují protichůdné důkazy o koordinačním stavu atomu železa a jeho blízkosti k BH4 v aktivním místě. Podle krystalografické analýzy je Fe (II) koordinován vodou, His285, His290 a Glu330 (uspořádání tváře triády 2-his-1-karboxylátu) s oktaedrickou geometrií. Zahrnutí analogu Phe do krystalické struktury mění železo ze šesti na pět koordinovaný stav zahrnující jedinou molekulu vody a bidentátní koordinaci na Glu330 a otevírá místo pro navázání kyslíku. BH4 je souběžně posunut směrem k atomu železa, i když pterinový kofaktor zůstává v druhé koordinační sféře. Na druhé straně konkurenční model založený na analýzách NMR a molekulárního modelování naznačuje, že všechny koordinované molekuly vody jsou během katalytického cyklu vytlačeny z aktivního místa, zatímco BH4 se stává přímo koordinovaným se železem. Jak je uvedeno výše, vyřešení této nesrovnalosti bude důležité pro stanovení přesného mechanismu katalýzy PAH.
N-koncová regulační doména
Regulační povaha N-koncové domény (zbytky 1–117) je dána její strukturální flexibilitou. Analýza výměny vodík/deuterium naznačuje, že alosterická vazba Phe globálně mění konformaci PAH tak, že aktivní místo je méně uzavřené, protože rozhraní mezi regulační a katalytickou doménou je stále více vystaveno rozpouštědlu. Toto pozorování je v souladu s kinetickými studiemi, které ukazují zpočátku nízkou rychlost tvorby tyrosinu pro PAH plné délky. Tato doba zpoždění však není pozorována u zkráceného PAH postrádajícího N-koncovou doménu nebo pokud je enzym plné délky preinkubován s Phe. Vymazání N-koncové domény také eliminuje zpoždění a současně zvyšuje afinitu k Phe téměř dvojnásobně; není pozorován žádný rozdíl v V max nebo K m pro tetrahydrobiopterin kofaktoru. Další regulaci zajišťuje Ser16; fosforylace tohoto zbytku nemění konformaci enzymu, ale snižuje koncentraci Phe potřebnou pro alosterickou aktivaci. Tato N-koncová regulační doména není pozorována u bakteriálních PAH, ale vykazuje značnou strukturní homologii s regulační doménou fosfogylcerát dehydrogenázy, enzymu v serinové biosyntetické dráze.
Tetramerizační doména
Prokaryotický PAH je monomerní, zatímco eukaryotický PAH existuje v rovnováze mezi homotetramerními a homodimerními formami. Rozhraní dimerizace se skládá ze smyček souvisejících se symetrií, které spojují identické monomery, zatímco překrývající se C-koncová tetramerizační doména zprostředkovává asociaci konformačně odlišných dimerů, které se vyznačují odlišnou relativní orientací katalytické a tetramerizační domény (Flatmark, Erlandsen). Výsledné zkreslení symetrie tetramerů je evidentní v diferenciální povrchové ploše rozhraní dimerizace a odlišuje PAH od tetramericky symetrické tyrosinhydroxylázy. Byl navržen mechanismus výměny domény, který zprostředkovává tvorbu tetrameru z dimerů, ve kterých C-koncové alfa-šroubovice vzájemně mění svou konformaci kolem flexibilní C-koncové pantové oblasti s pěti zbytky za vzniku struktury stočené cívky, která posouvá rovnováhu směrem k tetramerické formě. Ačkoli jsou homodimerní i homotetramerní formy PAH katalyticky aktivní, vykazují tyto dvě diferenciální kinetiku a regulaci. Kromě snížené katalytické účinnosti dimer nevykazuje pozitivní kooperativitu vůči L-Phe (který při vysokých koncentracích aktivuje enzym), což naznačuje, že L-Phe alostericky reguluje PAH ovlivňováním interakce dimer-dimer.
Biologická funkce
PAH je kritickým enzymem v metabolismu fenylalaninu a katalyzuje rychlost omezující krok v jeho úplném katabolismu na oxid uhličitý a vodu. Regulace toku cestami spojenými s fenylalaninem je kritická v metabolismu savců, o čemž svědčí toxicita vysokých plazmatických hladin této aminokyseliny pozorovaná u fenylketonurie (viz níže). Hlavním zdrojem fenylalaninu jsou požité proteiny, ale na syntézu proteinů se používá relativně málo tohoto poolu. Místo toho je většina požitého fenylalaninu katabolizována prostřednictvím PAH za vzniku tyrosinu ; přidání hydroxylové skupiny umožňuje rozbití benzenového kruhu v následujících katabolických krocích. Transaminace na fenylpyruvát , jehož metabolity se vylučují močí, představuje další cestu obratu fenylalaninu, ale převažuje katabolismus prostřednictvím PAH.
U lidí je tento enzym exprimován jak v játrech, tak v ledvinách, a existují určité náznaky, že může být v těchto tkáních odlišně regulován. PAH je mezi hydroxylasami aromatických aminokyselin neobvyklý pro svou účast v katabolismu; tyrosin a tryptofan hydroxylázy , na druhé straně, jsou primárně exprimovány v centrálním nervovém systému a katalyzují kroky omezující rychlost v biosyntéze neurotransmiter/hormon.
Relevance nemoci
Nedostatek aktivity PAH způsobený mutacemi v PAH způsobuje hyperfenylalaninémii (HPA), a když se hladina fenylalaninu v krvi zvýší nad 20násobek normální koncentrace, dojde k metabolickému onemocnění fenylketonurie (PKU). PKU je jak genotypicky, tak fenotypicky heterogenní: Bylo identifikováno více než 300 různých patogenních variant, z nichž většina odpovídá mutacím missense, které se mapují na katalytickou doménu. Když byla kohorta identifikovaných PAH mutantů exprimována v rekombinantních systémech, vykazovaly enzymy změněné kinetické chování a/nebo sníženou stabilitu v souladu se strukturálním mapováním těchto mutací jak na katalytickou, tak na tetramerizační doménu enzymu. BH4 4 byl podáván jako farmakologická léčba a bylo prokázáno, že snižuje hladiny fenylalaninu v krvi pro segment pacientů s PKU, jejichž genotypy vedou k určité reziduální aktivitě PAH, ale nemají žádný defekt v syntéze nebo regeneraci BH4 4 . Následné studie naznačují, že v případě určitých mutantů PAH působí přebytek BH4 4 jako farmakologický chaperon ke stabilizaci mutantních enzymů s narušenou sestavou tetrameru a zvýšenou citlivostí na proteolytické štěpení a agregaci. Mutace, které byly identifikovány v lokusu PAH, jsou dokumentovány na znalostní databázi Locus Phenylalanine Hydroxylase Locus (PAHdb, https://web.archive.org/web/20130718162051/http://www.pahdb.mcgill.ca/ ).
Vzhledem k tomu, že fenylketonurie může způsobit nevratné poškození, je nezbytné, aby byly nedostatky ve fenylalaninhydroxyláze stanoveny již na počátku vývoje. Původně to bylo provedeno pomocí testu inhibice bakterií známého jako Guthrieho test . Nyní je PKU součástí screeningu novorozenců v mnoha zemích a zvýšené hladiny fenylalaninu jsou identifikovány krátce po narození měřením pomocí tandemové hmotnostní spektrometrie . Umístění jedince na dietu s nízkým obsahem fenylalaninu a vysokým obsahem tyrosinu může pomoci zabránit jakémukoli dlouhodobému poškození jejich vývoje.
Související enzymy
Fenylalaninhydroxyláza je v těsném spojení s dalšími dvěma enzymy:
- tryptofanhydroxyláza (EC číslo 1.14.16.4), která kontroluje hladiny serotoninu v mozku a gastrointestinálním traktu
- tyrosinhydroxyláza (EC číslo 1.14.16.2), která kontroluje hladiny dopaminu , epinefrinu a norepinefrinu v mozku a dřeně nadledvin.
Tyto tři enzymy jsou homologní, to znamená, že se předpokládá, že se vyvinuly ze stejné starodávné hydroxylázy.
Reference
Další čtení
- Eisensmith RC, Woo SL (1993). „Molekulární základ fenylketonurie a souvisejících hyperfenylalaninemií: mutace a polymorfismy v genu lidské fenylalaninhydroxylázy“. Lidská mutace . 1 (1): 13–23. doi : 10,1002/humu.1380010104 . PMID 1301187 . S2CID 19476605 .
- Konecki DS, Lichter-Konecki U (srpen 1991). „Lokus fenylketonurie: současné znalosti o alelách a mutacích genu fenylalaninhydroxylázy v různých populacích“. Lidská genetika . 87 (4): 377–88. doi : 10,1007/BF00197152 . PMID 1679029 . S2CID 25627287 .
- Cotton RG (1991). „Heterogenita fenylketonurie na klinické, proteinové a DNA úrovni“. Journal of Inherited Metabolic Disease . 13 (5): 739–50. doi : 10,1007/BF01799577 . PMID 2246858 . S2CID 21931016 .
- Erlandsen H, Fusetti F, Martinez A, Hough E, Flatmark T, Stevens RC (prosinec 1997). „Krystalová struktura katalytické domény lidské fenylalaninhydroxylázy odhaluje strukturální základ fenylketonurie“. Přírodní strukturální biologie . 4 (12): 995–1000. doi : 10,1038/nsb1297-995 . PMID 9406548 . S2CID 6293946 .
- Waters PJ, Parniak MA, Nowacki P, Scriver CR (1998). „Analýza exprese mutací in vitro ve fenylalaninhydroxyláze: propojení genotypu s fenotypem a struktura s fungováním“. Lidská mutace . 11 (1): 4–17. doi : 10,1002/(SICI) 1098-1004 (1998) 11: 1 <4 :: AID-HUMU2> 3,0.CO; 2-L . PMID 9450897 .
- Waters PJ (duben 2003). „Jak mutace genu PAH způsobují hyperfenylalaninémii a proč na mechanismu záleží: poznatky z exprese in vitro“ . Lidská mutace . 21 (4): 357–69. doi : 10,1002/humu.10197 . PMID 12655545 . S2CID 23769500 .
externí odkazy
- Záznam GeneReviews/NCBI/NIH/UW na nedostatek fenylalaninhydroxylázy
- Lokálně specifická databáze variant genů lidské fenylalaninhydroxylázy
- Molekula měsíce: fenylalaninhydroxyláza
- Přehled všech strukturálních informací dostupných v PDB pro UniProt : P00439 (lidská fenylalaninhydroxyláza) na PDBe-KB .