Allotropy uhlíku - Allotropes of carbon

| Část série článků o |
| Nanomateriály |
|---|
 |
| Uhlíkové nanotrubičky |
| Fullereny |
| Jiné nanočástice |
| Nanostrukturované materiály |
Uhlík je díky své valenci schopen vytvořit mnoho alotropů (strukturně odlišných forem stejného prvku) . Mezi dobře známé formy uhlíku patří diamant a grafit . V posledních desetiletích bylo objeveno a zkoumáno mnoho dalších alotropů, včetně tvarů koulí, jako je buckminsterfullerene a listů, jako je grafen . Ve větším měřítku struktury uhlíku zahrnují nanotrubic , nanobuds a nanoribbons . Jiné neobvyklé formy uhlíku existují při velmi vysokých teplotách nebo extrémních tlacích. Podle Samara Carbon Allotrope Database (SACADA) je v současné době známo přibližně 500 hypotetických 3 -periodických alotropů uhlíku.
diamant
Diamant je známý allotrop uhlíku. Díky tvrdosti a vysokému rozptylu světla diamantu je vhodný jak pro průmyslové aplikace, tak pro šperky. Diamant je nejtvrdší známý přírodní minerál . Díky tomu je vynikajícím brusivem a velmi dobře drží lesk a lesk. Žádná známá přirozeně se vyskytující látka nemůže řezat (nebo dokonce poškrábat) diamant, kromě jiného diamantu. Je to také jeden z nejnákladnějších prvků na světě.
Trh s průmyslovými diamanty funguje velmi odlišně od svého protějšku na úrovni drahokamů. Průmyslové diamanty jsou oceňovány především pro svou tvrdost a tepelnou vodivost, takže mnohé z gemologických charakteristik diamantu, včetně jejich čistoty a barvy, jsou většinou irelevantní. To pomáhá vysvětlit, proč 80% vytěžených diamantů (což odpovídá asi 100 milionům karátů nebo 20 tun ročně) není vhodných pro použití jako drahokamy a je známo jako bort , je určeno pro průmyslové použití. Kromě těžených diamantů našli průmyslové aplikace téměř okamžitě po svém vynálezu v 50. letech 20. století syntetické diamanty ; dalších 400 milionů karátů (80 tun) syntetických diamantů se ročně vyrobí pro průmyslové použití, což je téměř čtyřnásobek hmotnosti přírodních diamantů těžených ve stejném období.
Dominantním průmyslovým využitím diamantu je řezání , vrtání ( vrtáky ), broušení (frézy s diamantovými hranami) a leštění. Většina použití diamantů v těchto technologiích nevyžaduje velké diamanty; ve skutečnosti většina diamantů, které nemají kvalitu drahokamů, může najít průmyslové využití. Diamanty jsou zapuštěny do špiček vrtáků nebo pilových kotoučů, nebo jsou rozemlety na prášek pro použití při broušení a leštění (díky své mimořádné tvrdosti). Specializované aplikace zahrnují použití v laboratořích jako kontejnment pro vysokotlaké experimenty (viz diamantová kovadlina ), vysoce výkonná ložiska a omezené použití ve specializovaných oknech technických zařízení.
S pokračujícím pokrokem ve výrobě syntetických diamantů začínají být budoucí aplikace proveditelné. Velkým vzrušením je možné použití diamantu jako polovodiče vhodného k výrobě mikročipů nebo použití diamantu jako chladiče v elektronice . V Japonsku , Evropě a Spojených státech probíhá značné výzkumné úsilí o využití potenciálu, který nabízejí jedinečné materiálové vlastnosti diamantu, v kombinaci se zvýšenou kvalitou a množstvím dodávek, které začínají být dostupné od výrobců syntetických diamantů.
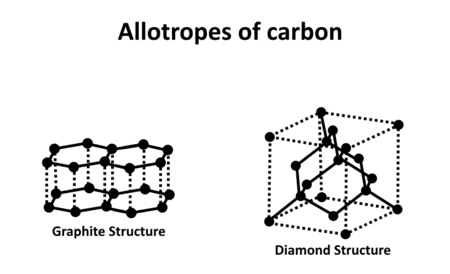
Diamant je krychlový krystal zaměřený na obličej s osmi atomy na jednotku buňky. Každý atom uhlíku v diamantu je kovalentně vázán na čtyři další uhlíky v čtyřstěnu . Tyto čtyřstěny dohromady tvoří 3-dimenzionální síť šestičlenných uhlíkových kruhů (podobných cyklohexanu ), v konformaci křesla , což umožňuje deformaci úhlu nulové vazby . Tato stabilní síť kovalentních vazeb a šestihranných prstenů je důvodem, proč je diamant tak silný. Diamant je při tlacích níže termodynamicky méně stabilní než grafit1,7 GPa .
Grafit
Grafit , pojmenovaný Abrahamem Gottlobem Wernerem v roce 1789, z řeckého γράφειν ( graphein , „to draw/write“, for its use in pencils) je jednou z nejběžnějších allotropes uhlíku. Na rozdíl od diamantu je grafit elektrický vodič. Lze jej tedy použít například v elektrodách elektrických obloukových lamp. Podobně za standardních podmínek je grafit nejstabilnější formou uhlíku. Proto se používá v termochemii jako standardní stav pro definování tepla z tvorby sloučenin uhlíku.
Grafit vede elektřinu , v důsledku delokalizace z pí vazba elektronů nad a pod rovinami atomů uhlíku. Tyto elektrony se mohou volně pohybovat, takže jsou schopné vést elektrický proud. Elektřina je však vedena pouze po rovině vrstev. V diamantu jsou všechny čtyři vnější elektrony každého atomu uhlíku 'lokalizovány' mezi atomy v kovalentní vazbě. Pohyb elektronů je omezen a diamant nevede elektrický proud. V grafitu každý atom uhlíku používá pouze 3 ze svých 4 elektronů na vnější energetické úrovni kovalentně navázaných na tři další atomy uhlíku v rovině. Každý atom uhlíku přispívá jedním elektronem do delokalizovaného systému elektronů, který je také součástí chemické vazby. Delokalizované elektrony se mohou volně pohybovat po celé rovině. Z tohoto důvodu grafit vede elektřinu po rovinách atomů uhlíku, ale nevede elektřinu ve směru kolmém k rovině.
Jako suché mazivo se používá grafitový prášek . Ačkoli by se dalo předpokládat, že tato průmyslově důležitá vlastnost je zcela dána volnou mezilamelární vazbou mezi listy ve struktuře, ve skutečnosti ve vakuovém prostředí (například v technologiích pro použití ve vesmíru ), bylo zjištěno, že grafit je velmi špatné mazivo . Tato skutečnost vedla k objevu, že mazivost grafitu je způsobena adsorbovaným vzduchem a vodou mezi vrstvami, na rozdíl od jiných vrstvených suchých maziv, jako je disulfid molybdenu . Nedávné studie naznačují, že za tento účinek může také účinek zvaný superlubricita .
Když velké množství krystalografických defektů (fyzických) spojí tyto roviny dohromady, grafit ztratí své mazací vlastnosti a stane se pyrolytickým uhlíkem , užitečným materiálem v implantátech kontaktujících krev, jako jsou protetické srdeční chlopně .
Grafit je nejstabilnější allotrop uhlíku. Na rozdíl od všeobecného přesvědčení, vysoce čistý grafit nehoří snadno, a to ani při zvýšených teplotách. Z tohoto důvodu se používá v jaderných reaktorech a pro vysokoteplotní kelímky pro tavení kovů. Při velmi vysokých teplotách a tlacích (zhruba 2 000 ° C a 5 GPa) jej lze přeměnit na diamant.
Přírodní a krystalické grafity se často nepoužívají v čisté formě jako konstrukční materiály kvůli jejich smykovým rovinám, křehkosti a nekonzistentním mechanickým vlastnostem.
Ve své čisté skelné (izotropní) syntetické formě jsou pyrolytický grafit a grafit z uhlíkových vláken extrémně silné, tepelně odolné materiály (do 3 000 ° C), používané v ochranných štítech pro raketové nosní kužele, pevné raketové motory, vysokoteplotní reaktory , brzdové čelisti a kartáče elektrického motoru .
V protipožárních ucpávkách se používají intumescentní nebo expandovatelné grafity, které jsou umístěny po obvodu protipožárních dveří. Během požáru grafit intumesces (expanduje a chars), aby odolal proniknutí ohně a zabránit šíření výparů. Typická počáteční teplota expanze (SET) je mezi 150 a 300 ° C.
Hustota: Specifická hmotnost grafitu je 2,3, díky čemuž je lehčí než diamant.
Chemická aktivita: je o něco reaktivnější než diamant. Reaktanty jsou totiž schopné proniknout mezi hexagonální vrstvy atomů uhlíku v grafitu. Není ovlivněn běžnými rozpouštědly, zředěnými kyselinami nebo tavenými alkáliemi. Kyselina chromová ji však oxiduje na oxid uhličitý.
Grafen
Jediná vrstva grafitu se nazývá grafen a má mimořádné elektrické, tepelné a fyzikální vlastnosti. Může být vyroben epitaxií na izolačním nebo vodivém substrátu nebo mechanickým odlupováním (opakovaným odlupováním) z grafitu. Jeho aplikace mohou zahrnovat výměnu křemíku ve vysoce výkonných elektronických zařízeních. Se dvěma vrstvami na sobě skládají výsledky dvouvrstvý grafen s různými vlastnostmi.
Grafenylen
Graphenylene je jednovrstvý uhlíkový materiál s bifenylenovými podjednotkami jako základem v jeho hexagonální mřížkové struktuře. Je také známý jako bifenylen-uhlík.
AA'-grafit
AA'-grafit je allotrop uhlíku podobný grafitu, ale kde jsou vrstvy umístěny navzájem odlišně ve srovnání s pořadím v grafitu.
Diamane
Diamane je 2D forma diamantu. Může být vyroben vysokými tlaky, ale bez tohoto tlaku se materiál vrátí na grafen. Další technikou je přidání atomů vodíku, ale tyto vazby jsou slabé. Použití fluoru (xenon-difluorid) místo toho přibližuje vrstvy k sobě a posiluje vazby. Tomu se říká f-diamane.
Amorfní uhlík
Amorfní uhlík je název používaný pro uhlík, který nemá žádnou krystalickou strukturu. Stejně jako u všech sklovitých materiálů lze pozorovat určité pořadí krátkého dosahu, ale neexistuje atomový postoj s dlouhým dosahem. I když lze vyrobit zcela amorfní uhlík, většina amorfního uhlíku ve skutečnosti obsahuje mikroskopické krystaly uhlíku podobného grafitu nebo dokonce diamantu .
Uhlí a saze nebo saze se neformálně nazývají amorfní uhlík. Jsou to však produkty pyrolýzy (proces rozkladu látky působením tepla), která za normálních podmínek neprodukuje pravý amorfní uhlík.
Nanokarbony
Buckminsterfullerenes
| Část série článků o |
| Nanomateriály |
|---|
 |
| Uhlíkové nanotrubičky |
| Fullereny |
| Jiné nanočástice |
| Nanostrukturované materiály |
Tyto buckminsterfullerenes , nebo se zde obvykle jen fullereny nebo buckyballs pro krátkodobé, byly objeveny v roce 1985 tým vědců z Rice University a University of Sussex, z nichž tři byly uděleny roku 1996 Nobelovu cenu za chemii. Jsou pojmenovány podle podobnosti s geodetickými strukturami, které vytvořil Richard Buckminster „Bucky“ Fuller . Fullereny jsou pozitivně zakřivené molekuly různých velikostí složené výhradně z uhlíku, které mají formu duté koule, elipsoidu nebo trubice.
Na počátku jednadvacátého století jsou chemické a fyzikální vlastnosti fullerenů stále podrobně studovány, a to v laboratořích čistého i aplikovaného výzkumu. V dubnu 2003 byly fullereny studovány pro potenciální lékařské použití - vazba specifických antibiotik na strukturu zaměřená na rezistentní bakterie a dokonce zaměřená na určité rakovinné buňky, jako je melanom.
Uhlíkové nanotrubičky
Uhlíkové nanotrubice, nazývané také buckytubes, jsou válcovité molekuly uhlíku s novými vlastnostmi, díky nimž jsou potenciálně užitečné v celé řadě aplikací (např . Nanoelektronika , optika , materiálové aplikace atd.). Vykazují mimořádnou pevnost, jedinečné elektrické vlastnosti a jsou účinnými vodiči tepla . Byly také syntetizovány anorganické nanotrubičky . Nanotrubice je členem strukturní rodiny fullerenů , která také obsahuje buckyballs . Zatímco buckyballs mají sférický tvar, nanotrubice je válcová , s alespoň jedním koncem typicky zakončeným polokoulí buckyball struktury. Jejich název je odvozen od jejich velikosti, protože průměr nanotrubice je řádově několik nanometrů (přibližně 50 000krát menší než šířka lidského vlasu), přičemž mohou mít délku až několik centimetrů. Existují dva hlavní typy nanotubes: jeden-nanotrubice (SWNTs) a multi nanotrubice (MWNT).
Uhlíkové nanobudy
Uhlíkové nanobudy jsou nově objeveným allotropem uhlíku, ve kterém jsou k vnějším bočním stěnám uhlíkových nanotrubic kovalentně připojeny fullereny jako „pupeny“ . Tento hybridní materiál má užitečné vlastnosti jak fullerenů, tak uhlíkových nanotrubic. Například bylo zjištěno, že jsou mimořádně dobrými vysílači polí .
Schwarzites
Schwarzity jsou negativně zakřivené uhlíkové povrchy původně navržené zdobením trojnásobně periodických minimálních povrchů atomy uhlíku. Geometrické topologie struktury je určena přítomností kruhu defektů, jako jsou heptagons a osmiúhelníky, aby grafenu s hexagonální mřížky. (Negativní zakřivení ohýbá povrchy ven jako sedlo, spíše než se ohýbá dovnitř jako koule.)
Nedávná práce navrhla, aby uhlíky se templáty zeolitu (ZTC) mohly být schwarzity. Název ZTC pochází z jejich původu uvnitř pórů zeolitů , krystalických minerálů oxidu křemičitého . Pára molekul obsahujících uhlík je vstřikována do zeolitu, kde se uhlík shromažďuje na stěnách pórů a vytváří negativní křivku. Rozpuštění zeolitu zanechává uhlík. Tým vytvořil struktury zdobením pórů zeolitu uhlíkem metodou Monte Carlo . Některé z výsledných modelů připomínají struktury podobné schwarzitům.
Skelný uhlík
Skelný nebo skelný uhlík je třída negrafitizujícího uhlíku široce používaného jako elektrodový materiál v elektrochemii , jakož i pro vysokoteplotní kelímky a jako součást některých protetických pomůcek.
Poprvé jej vyrobil Bernard Redfern v polovině 50. let v laboratořích The Carborundum Company, Manchester, UK. Vydal se vyvinout polymerní matrici, která by zrcadlila diamantovou strukturu, a objevil rezolovou (fenolickou) pryskyřici, která by se speciální přípravou tvrdla bez katalyzátoru. Pomocí této pryskyřice byl vyroben první skelný uhlík.
Příprava skelného uhlí zahrnuje vystavení organických prekurzorů sérii tepelných úprav při teplotách až 3000 ° C. Na rozdíl od mnoha negrafitizujících uhlíků jsou nepropustné pro plyny a jsou chemicky extrémně inertní, zejména ty připravované při velmi vysokých teplotách. Bylo prokázáno, že rychlosti oxidace některých sklovitých uhlíků v kyslíku, oxidu uhličitém nebo vodní páře jsou nižší než u jakéhokoli jiného uhlíku. Jsou také vysoce odolné vůči napadení kyselinami. I když je tedy normální grafit při pokojové teplotě redukován na prášek směsí koncentrované kyseliny sírové a dusičné, skelný uhlík není tímto zpracováním ovlivněn, a to ani po několika měsících.
Atomový a diatomický uhlík
Za určitých podmínek lze uhlík nalézt v jeho atomové formě. Může být vytvořen odpařováním grafitu, procházením velkých elektrických proudů za vzniku uhlíkového oblouku za velmi nízkých tlaků. Je extrémně reaktivní, ale je to meziprodukt používaný při výrobě karbenů .
Diatomický uhlík lze také nalézt za určitých podmínek. Často je detekován pomocí spektroskopie v mimozemských tělech, včetně komet a určitých hvězd .
Uhlíková nanopěna
Uhlíková nanopěna je pátým známým allotropem uhlíku, objeveným v roce 1997 Andrejem V. Rodeem a spolupracovníky na Australské národní univerzitě v Canbeře . Skládá se z nízkohustotního seskupení atomů uhlíku navlečených dohromady ve volné trojrozměrné síti.
Každý shluk je široký asi 6 nanometrů a skládá se z asi 4000 atomů uhlíku spojených v grafitových listech, kterým je dáno negativní zakřivení zahrnutím heptagonů mezi pravidelný šestiúhelníkový obrazec. To je opak toho, co se děje v případě buckminsterfullerenů , ve kterých jsou uhlíkové vrstvy kladně zakřiveny zahrnutím pětiúhelníků .
Rozsáhlá struktura uhlíkové nano pěny je podobná struktuře aerogelu , ale s 1% hustoty dříve vyráběných uhlíkových aerogelů -jen několikrát hustota vzduchu na úrovni hladiny moře . Na rozdíl od uhlíkových aerogelů je uhlíková nanopěna špatným elektrickým vodičem .
Uhlík odvozený z karbidu
Karbidový uhlík (CDC) je skupina uhlíkových materiálů s různou povrchovou geometrií a uspořádáním uhlíku, které se vyrábějí selektivním odstraňováním kovů z prekurzorů karbidů kovů, jako jsou TiC, SiC, Ti
3AlC
2, Mo
2C atd. Tato syntéza se provádí za použití úpravy chlórem, hydrotermální syntézy nebo vysokoteplotní selektivní desorpce kovu ve vakuu. V závislosti na metodě syntézy, karbidovém prekurzoru a reakčních parametrech lze dosáhnout více alotropů uhlíku, včetně endohedrálních částic složených převážně z amorfního uhlíku, uhlíkových nanotrubic, epitaxiálního grafenu, nanokrystalického diamantu, cibulovitého uhlíku a grafitických stuh, sudů a rohy. Tyto struktury vykazují vysokou pórovitost a specifické povrchové plochy s vysoce laditelnými průměry pórů, což z nich činí slibné materiály pro skladování energie na bázi superkapacitorů, vodní filtraci a kapacitní odsolování, podporu katalyzátoru a odstraňování cytokinů.
Lonsdaleite (šestihranný diamant)
Lonsdaleit je allotrop, někdy nazývaný „ šestihranný diamant“, vytvořený z grafitu přítomného v meteoritech při jejich dopadu na Zemi. Velké teplo a tlak nárazu transformuje grafit do hustší podoby podobné diamantu, ale zachovává hexagonální krystalovou mřížku grafitu . „Šestihranný diamant“ byl také syntetizován v laboratoři, lisováním a zahříváním grafitu buď ve statickém lisu, nebo pomocí výbušnin. Může být také vyroben tepelným rozkladem polymeru, poly (hydridokarbynu) , za atmosférického tlaku, v atmosféře inertního plynu (např. Argon, dusík), počínaje teplotou 110 ° C (230 ° F).
Lineární acetylenický uhlík
Jednorozměrný uhlíkový polymer se strukturou-(C≡C) n- .
Cyklokarbony
Cyklo [18] uhlík (C 18 ) byl syntetizován v roce 2019.
Jiné možné formy
- D-uhlík : D-uhlík navrhli teoretici v roce 2018. D-uhlík je ortorombický alotrop uhlíku sp 3 (6 atomů na buňku). Výpočty Celková energií ukazují, že D-uhlík je energeticky výhodnější než dříve navrhované T 6 strukturou (s 6 atomy na buňku), stejně jako mnoho dalších.
- Chaoite je minerál, o kterém se věří, že se vytvořil při nárazech meteoritů. Byl popsán jako mírně tvrdší než grafit s odrazovou barvou od šedé do bílé. Existence karbynových fází je však sporná - podrobnosti viz článek o chaoite .
- Kovový uhlík : Teoretické studie ukázaly, že ve fázovém diagramu existují oblasti při extrémně vysokých tlacích, kde uhlík má kovový charakter. Experimenty a teorie laserového šoku naznačují, že nad 600 GPa je tekutý uhlík kovový.
- bcc-uhlík : Při ultravysokých tlacích nad 1000 GPa se předpokládá, že se diamant transformuje do krychlové struktury zaměřené na tělo . Tato fáze má význam v astrofyzice a hlubokých nitrech planet jako Uran a Neptun . Byly navrženy různé struktury. Superhustý a supertvrdý materiál připomínající tuto fázi byl syntetizován a publikován v roce 1979 a údajně měl vesmírnou skupinu Im 3 s osmi atomy na primitivní jednotkovou buňku (16 atomů na konvenční jednotkovou buňku). Byla vznesena tvrzení, že byla syntetizována takzvaná struktura C 8 , mající osm uhlíkových kostek podobných kubanu v prostorové skupině Im 3 m, s osmi atomy na primitivní jednotkovou buňku nebo 16 atomy na konvenční jednotkovou buňku (také nazývanou superkuban (viz obrázek vpravo). Ale papír z roku 1988 tvrdil, že lepší teorií bylo, že struktura byla stejná jako struktura alotropu křemíku zvaného Si-III nebo γ-křemík, takzvaná struktura BC8 s prostorovou skupinou Ia 3 a 8 atomy na primitivní jednotku buňka (16 atomů na konvenční jednotkovou buňku). V roce 2008 bylo oznámeno, že byla identifikována kubánská struktura. Článek z roku 2012 uvažoval o čtyřech navrhovaných strukturách, nadkubanové struktuře, struktuře BC8, struktuře se shluky čtyř atomů uhlíku v čtyřstěnech ve vesmírné skupině I 4 3m, která má čtyři atomy na primitivní jednotkovou buňku (osm na konvenční jednotkovou buňku) a strukturu, kterou autoři nazvali „uhlíkový sodalit “. Zjistili, že pro toto uhlíkové struktury sodalit, s vypočtenou hustotu 2.927 g / cm 3 , je znázorněno v levé horní části obrázku pod abstrakt. Tato struktura má jen šest atomů na primitivní jednotkovou buňku (dvanáct na konvenční jednotkovou buňku). Atomy uhlíku jsou na stejných místech jako atomy křemíku a hliníku minerálního sodalitu. Prostorová skupina, I 4 3 m, je stejná jako plně expandovaná forma sodalitu, pokud by sodalit měl jen křemík nebo jen hliník.
- bct-carbon : Tetragonální uhlík zaměřený na tělo navrhli teoretici v roce 2010.
- M-uhlík : Monoklinický uhlík se středem C se předpokládá, že byl poprvé vytvořen v roce 1963 stlačením grafitu při pokojové teplotě. Jeho struktura byla teoretizována v roce 2006, poté v roce 2009 souvisela s těmito experimentálními pozorováními. Mnoho strukturálních kandidátů, včetně bct-uhlíku, bylo navrženo, aby byly stejně kompatibilní s experimentálními údaji dostupnými v té době, dokud v roce 2012 nebylo teoreticky ukázáno, že tato struktura je kineticky nejpravděpodobnější z grafitu. Krátce poté se objevila data s vysokým rozlišením, která ukazují, že ze všech kandidátů na strukturu je s experimentem kompatibilní pouze M-uhlík.
- Q-uhlík : Feromagnetický uhlík byl objeven v roce 2015.
- T-uhlík : Každý atom uhlíku v diamantu je nahrazen uhlíkovým čtyřstěnem (odtud 'T-uhlík'). To navrhli teoretici v roce 1985.
- Existují důkazy, že hvězdy bílého trpaslíka mají jádro krystalizovaných jader uhlíku a kyslíku. Doposud největší z nich nalezený ve vesmíru, BPM 37093 , se nachází 50 světelných let (4,7 × 10 14 km) daleko v souhvězdí Kentaura . Tisková zpráva z Harvard-Smithsonian Center for Astrophysics popsala hvězdné jádro široké 2 500 mil (4 000 km) jako diamant a bylo pojmenováno jako Lucy , podle písně Beatles „Lucy in the Sky With Diamonds“; nicméně je to spíše exotická forma uhlíku.
- Prismane C 8 je teoreticky předpokládá metastabilní oxid allotrope obsahující atomové seskupení osmi uhlíkových atomů, s tvaru podlouhlého trojúhelníkový dvoujehlanový -a šest atom trojúhelníkový hranol s další dva atomy nad a pod jeho základny.
- Lavesova graf nebo K 4 krystal je teoreticky předpovídaným trojrozměrná krystalická metastabilní uhlíková struktura, ve které je každý atom uhlíku navázaný na tři další, při 120 ° úhlu (jako grafit), ale kde letadla vazba sousedních vrstev leží při úhel 70,5 °, spíše než se shodovat.
- Penta-grafen je predikovaný uhlíkový alotrop, který využívá káhirský pětiboký obklad.
- Haeckeliti : Objednané uspořádání pětiúhelníků, šestiúhelníků a sedmiúhelníků, které mohou být ploché nebo trubkovité.
- Phagraphene : Allotrop podobný grafenu se zkreslenými Diracovými kužely.
- Novamene : Kombinace hexagonálních diamantů a sp 2 hexagonů jako v grafenu.
- Protomene : Hexagonální krystalová struktura s plně uvolněnou primitivní buňkou obsahující 48 atomů. Z nich 12 atomy mají potenciál přepínat hybridizace mezi sp 2 a sp 3 , které tvoří dimery.
- Zayedene : Kombinace lineárních sp uhlíkových řetězců a sp3 sypkého uhlíku. Struktura těchto krystalických uhlíkových allotropů se skládá ze sp řetězců vložených do válcových dutin periodicky uspořádaných v hexagonálním diamantu (lonsdaleite).
- Předpokládá se, že U uhlí bude sestávat z vlnitých vrstev obložených šesti nebo 12 atomovými kruhy spojených kovalentními vazbami. Zejména může být tvrdší než ocel , vodivá jako nerezová ocel, vysoce reflexní a feromagnetická , která se chová jako permanentní magnet při teplotách až 125 ° C.
Variabilita uhlíku
Systém uhlíkových alotropů pokrývá ohromující škálu extrémů, když uvážíme, že všechny jsou pouze strukturálními formacemi stejného prvku.
Mezi diamantem a grafitem:
- Diamant krystalizuje v kubické soustavě, ale grafit krystalizuje v hexagonální soustavě .
- Diamant je čistý a průhledný, ale grafit je černý a neprůhledný.
- Diamant je nejtvrdším známým minerálem (10 na Mohsově stupnici ), ale grafit je jedním z nejměkčích (1–2 na Mohsově stupnici ).
- Diamant je konečné brusivo, ale grafit je měkký a je velmi dobrým mazivem.
- Diamond je vynikající elektrický izolátor, ale grafit je vynikající vodič.
- Diamant je vynikající tepelný vodič, ale pro tepelnou izolaci se používají některé formy grafitu (například tepelné štíty a protipožární štíty).
- Při standardní teplotě a tlaku je grafit termodynamicky stabilní formou. Diamanty tedy neexistují navždy. Přeměna z diamantu na grafit má však velmi vysokou aktivační energii, a proto je extrémně pomalá.
Navzdory tvrdosti diamantů jsou chemické vazby, které drží atomy uhlíku v diamantech pohromadě, ve skutečnosti slabší než ty, které drží pohromadě grafit. Rozdíl je v tom, že v diamantu svazky tvoří nepružnou trojrozměrnou mřížku. V grafitu jsou atomy pevně spojeny do listů, ale listy se mohou po sobě snadno klouzat, čímž je grafit měkký.
Viz také
Reference
externí odkazy
- "SACADA: Samara Carbon Allotrope Database" . sctms.ru .
- Falcao, Eduardo HL; Wudl, Fred (2007). „Uhlíkové allotropy: Za grafitem a diamantem“. Journal of Chemical Technology & Biotechnology . 82 (6): 524–531. doi : 10,1002/jctb.1693 . ISSN 0268-2575 .
- „Tajemné Allotropes of Carbon“ . dendritici.com .