Brugia malayi - Brugia malayi
| Brugia malayi | |
|---|---|
|
|
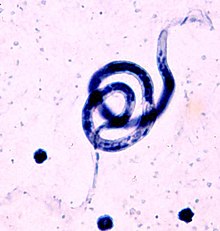
| B. malayi , krevní nátěr, Giemsova skvrna | |
|
Vědecká klasifikace |
|
| Království: | Animalia |
| Kmen: | Nematoda |
| Třída: | Chromadorea |
| Objednat: | Rhabditida |
| Rodina: | Onchocercidae |
| Rod: | Brugia |
| Druh: |
B. malayi
|
| Binomické jméno | |
|
Brugia malayi SL Brug, 1927
|
|
Brugia malayi je filariální ( členovec ) hlístice (škrkavka), jeden ze tří původců lymfatické filariózy u lidí. Lymfatická filariáza, známá také jako elefantiáza , je stav charakterizovaný otokem dolních končetin. Další dvě příčiny vláken lymfatické filariózy jsou Wuchereria bancrofti a Brugia timori , které se od B. malayi liší morfologicky, symptomaticky a v geografickém rozsahu.
B. malayi je přenášen komáry Mansonia a je omezen na jižní a jihovýchodní Asii. Je to jedna z tropických nemocí, jejichž odstranění do roku 2020 by měla odstranit Světová zdravotnická organizace , která podnítila vývoj vakcín a léků a také nové metody kontroly vektorů.
Příznaky a symptomy
| Brugia malayi | |
|---|---|
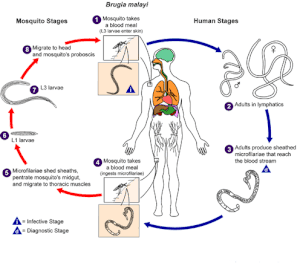 | |
| Životní cyklus z Brugia malayi . | |
| Specialita | Infekční nemoc |
B. malayi je jedním z původců lymfatické filariózy , což je stav poznamenaný infekcí a otokem lymfatického systému. Toto onemocnění je primárně způsobeno přítomností červů v lymfatických cévách a výslednou zánětlivou odpovědí hostitele. Známky infekce jsou obvykle v souladu s příznaky pozorovanými u Bancroftianovy filariázy - horečka, lymfadenitida , lymfangitida , lymfedém a sekundární bakteriální infekce - až na několik výjimek.
Lymfadenitida
Lymfadenitida , otok lymfatických uzlin, je běžně uznávaným příznakem mnoha nemocí. Je to časný projev filariózy, obvykle se vyskytuje v tříselné oblasti během infekce B. malayi a může nastat dříve, než červi dospějí.
Lymfangitida
Lymfangitida je zánět lymfatických cév v reakci na infekci. Vyskytuje se brzy v průběhu infekce v reakci na vývoj červů, línání, smrt nebo bakteriální a plísňové infekce. Postižené lymfatické cévy se roztáhnou a ztuhnou a nadložní pokožka se stane erytematózní a horká. Během infekce B. malayi se příležitostně vyskytuje tvorba abscesu a ulcerace postižené lymfatické uzliny , častěji než u Bancroftianovy filariózy. Zbytky dospělých červů lze někdy najít v drenáži vředu.
Lymfedém
Nejviditelnějším znakem infekce, elefantiázou, je zvětšení končetin - obvykle nohou. Pozdní komplikace infekce, elefantiáza je forma lymfedému a je způsobena opakovaným zánětem lymfatických cév. Opakované zánětlivé reakce způsobují dilataci cév a ztluštění postižených lymfatických cév, což může narušit funkci. Lymfatický systém normálně funguje tak, aby udržoval rovnováhu tekutin mezi tkáněmi a krví a slouží jako nedílná součást imunitního systému. Blokování těchto cév v důsledku zánětlivě indukované fibrózy, mrtvých červů nebo granulomatózních reakcí může interferovat s normální rovnováhou tekutin, což vede k otokům v končetinách. Elefantiáza způsobená infekcí B. malayi obvykle postihuje distální části končetin. Na rozdíl od Bancroftianovy filariózy B. malayi zřídka postihuje genitálie a nezpůsobuje funikulitidu, orchitidu, epididymitidu, hydrokélu nebo chylurii, což jsou podmínky častěji pozorované u Bancroftianovy infekce.
Sekundární bakteriální infekce
Sekundární bakteriální infekce je častá u pacientů s filariázou. Snížená imunitní funkce způsobená lymfatickým poškozením, kromě vředů lymfatických uzlin a expozice abscesů a zhoršeného oběhu v důsledku elefantiázy, může způsobit sekundární bakteriální nebo plísňové infekce. Elefantiáza, kromě fyzické zátěže oteklé končetiny, může být při bakteriální infekci vážně oslabujícím stavem. Část „Strategie pro odstranění lymfatické filariózy“ WHO se zaměřuje na programy podpory hygieny s cílem zmírnit utrpení postižených jedinců (viz Strategie prevence).
Klinické projevy infekce jsou však proměnlivé a závisí na několika faktorech, včetně rozdílů v imunitním systému hostitele, infekční dávce a parazitickém kmeni. Většina infekcí vypadá asymptomaticky, přesto se liší od jednotlivce k jednotlivci. U jedinců žijících v endemických oblastech s mikrofilemií se nemusí nikdy objevit zjevné příznaky, zatímco v jiných případech může jen několik červů zhoršit závažnou zánětlivou reakci.
Vývoj nemoci u lidí však není dobře znám. U dospělých se obvykle objeví horší příznaky vzhledem k dlouhé době expozice potřebné k infekci. Infekce se může objevit během dětství, ale zdá se, že onemocnění se projevuje mnoho let. Inkubační doba infekce se pohybuje od 1 měsíce do 2 let a typicky se mikrofilárie objevují před zjevnými příznaky. Lymfedém se může vyvinout během šesti měsíců a vývoj elefantiázy byl hlášen během jednoho roku od infekce u uprchlíků, kteří jsou více imunologicky naivní. Muži mají tendenci vyvíjet horší příznaky než ženy.
Způsobit
Životní cyklus
K vývoji a replikaci B. malayi dochází ve dvou samostatných fázích: ve vektoru komárů a v člověku. Obě fáze jsou nezbytné pro životní cyklus parazita.
Komár: Komár slouží jako biologický vektor a mezihostitel - je nezbytný pro vývojový cyklus a přenos B. malayi .
4. Komár vezme lidskou krevní moučku a požije mikrofilárie (vajíčka podobná červům), která cirkulují v lidském krevním řečišti.
5-7 U komárů mikrofilárie vylučují pochvy, pronikají do středního střeva a migrují do hrudních svalů, pokud se mikrofilárie zvětšily, zformovaly a vyvinuly se v infekční larvy (L1 a L3) po dobu 7–21 dnů. U komára nedochází k množení ani k pohlavnímu rozmnožování mikrofilárií.
8-1 Infekční larvy (L3) migrují do slinných žláz, vstupují do chobotu a unikají na lidskou kůži, když si komár vezme další krevní moučku.
Člověk: B. malayi prochází dalším vývojem v lidské i pohlavní reprodukci a produkci vajec.
1-2 Infekční larvy (L3) aktivně pronikají kůží skrz skus a během 6 měsíců se z nich vyvinou dospělí v lymfatickém systému. Dospělí červi mohou přežít v lymfatickém systému po dobu 5–15 let.
3. Dospělí červi samců a samic se páří a samice denně produkují průměrně 10 000 obalených vajíček (mikrofilárie). Mikrofilárie vstupují do krevního oběhu a vykazují noční periodicitu a subperiodicitu.
4. Další komár si vezme krevní moučku a požije mikrofilárie. Infekce závisí na tom, jak si komár vezme krevní jídlo během periodické epizody - když jsou v krvi přítomny mikrofilárie.
Morfologie
Dospělý
Dospělí červi připomínají typické hlístice škrkavky. B. malayi a další hlístice, dlouhé a podobné vláknům, mají pouze podélné svaly a pohybují se pohybem ve tvaru S. Dospělí jsou obvykle menší než dospělí W. bancrofti , ačkoli několik dospělých bylo izolováno. Dospělí červi (50 mm) jsou větší než červi (25 mm).
Mikrofilárie
B. malayi microfilariae jsou dlouhé 200–275 µm a mají kulatý přední konec a špičatý zadní konec. Mikrofilarie jsou opláštěné, což silně obarví Giemsou. Pouzdro je ve skutečnosti skořápka, tenká vrstva, která obklopuje skořápku, když mikrofilárie cirkulují v krvi. Mikrofilarie si zachovávají obal, dokud nejsou tráveny ve středním střevě komárů.
Mikrofilárie B. malayi se podobají mikrofiláriím W. bancrofti a Loa loa s malými rozdíly, které mohou pomoci při laboratorní diagnostice. B. malayi microfilariae lze rozlišit podle kontinuální řady jader nalezené ve špičce ocasu. Existují dvě koncová jádra, která jsou zřetelně oddělena od ostatních jader v ocasu, zatímco ocas W. bancrofti neobsahuje žádná jádra a jádra Loa loa microfilariae tvoří souvislou řadu v ocasu. B. malayi microfilariae mají také charakteristický poměr cefalického prostoru 2: 1.
Šíření
B. malayi je přenášen vektorem komárů. Mezi hlavní vektory komárů patří komáři Mansonia , Anopheles a Aedes . Geografické rozšíření nemoci tedy závisí na vhodném prostředí pro rozmnožování komárů.
- Noční periodická forma je přenášena Mansonií a některými anophelinovými komáry v otevřených bažinách a oblastech pěstování rýže. Tito komáři mají tendenci v noci kousat a zdá se, že infikují pouze lidi. Přirozené infekce zvířat jsou vzácné a experimentální zvířata si infekci neuchovávají.
- Noční subperiodickou formu přenáší Mansonia v lesních bažinách, kde kdykoli ve stínu kousají komáři. Přírodní zoonotické infekce jsou běžné. Kočky, psi, opice, outloni, cibetkové kočky a křečci byli úspěšně experimentálně infikováni B. malayi od člověka a mohou sloužit jako důležité nádrže.
K prokázání infekce je zapotřebí hromadění mnoha infekčních kousnutí komáry - několik stovek až tisíců. Je to proto, že kompetentní komár obvykle přenáší pouze několik infekčních larev L3 (viz životní cyklus ) a méně než 10% těchto larev postupuje všemi nezbytnými kroky línání a vyvinou se v dospělé červy, které se mohou pářit. Osoby s největším rizikem infekce jsou tedy jedinci žijící v endemických oblastech - je nepravděpodobné, že by u krátkodobých turistů došlo k rozvoji lymfatické filariózy.
Diagnóza
Něžné nebo zvětšené tříselné lymfatické uzliny nebo otoky v končetinách mohou varovat lékaře nebo úředníky veřejného zdraví před infekcí.
Při vhodném laboratorním vybavení může mikroskopické vyšetření diferenciálních morfologických rysů mikrofilárií ve zbarvených krevních filmech pomoci diagnostikovat - zejména vyšetření ocasní části, přítomnost pochvy a velikost mozkového prostoru. Barvení Giemsou jedinečně obarví pouzdro B. malayi růžové. Nalezení mikrofilárií na krevních filmech však může být obtížné kvůli noční periodicitě některých forem B. malayi .
Testy založené na PCR jsou vysoce citlivé a lze je použít ke sledování infekcí jak u lidí, tak u komárů. Testy PCR jsou však časově náročné, pracné a vyžadují laboratorní vybavení. Lymfatická filariáza postihuje hlavně chudé, kteří žijí v oblastech bez těchto zdrojů.
Test karty antigenu ICT je široce používán v diagnostice W. bancrofti , ale komerční antigeny B. malayi nebyly široce dostupné. Nový vývoj v oblasti výzkumu však identifikoval rekombinantní antigen (BmR1), který je jak specifický, tak citlivý při detekci protilátek IgG4 proti B. malayi a B. timori v testu s enzymem spojeným imunosorbentem a imunochromatografickém testu s rychlou měrkou (Brugia Rapid). . Ukazuje se však, že imunoreaktivita s tímto antigenem je u jedinců infikovaných jinými vláknitými hlísticemi proměnlivá. Tento výzkum vedl k vývoji dvou nových rychlých imunochromatografických kazetových testů IgG4 - WB rapid a panLF rapid - které detekují Bancroftianovu filariózu a všechny tři druhy lymfatické filariózy s vysokou citlivostí a selektivitou.
Prevence
Vakcíny
V současné době neexistuje žádná licencovaná vakcína k prevenci lymfatické filariózy. Nedávný výzkum však přinesl kandidáty na vakcíny s dobrými výsledky u experimentálních zvířat. Glutathion-S-transferáza, detoxikační enzym u parazitů izolovaných z Setaria cervi , hovězího filariálního parazita, snížila zátěž dospělých parazitů B. malayi o více než 82% po dobu 90 dnů po léčbě.
Vektorové ovládání
Vektorové řízení bylo účinné v prakticky eliminaci lymfatické filariózy v některých oblastech, ale vektorové řízení v kombinaci s chemoterapií přináší nejlepší výsledky. Předpokládá se, že 11 až 12 let účinné vektorové kontroly může eliminovat lymfatickou filariózu. Mezi úspěšné metody vektorové kontroly B. malayi patří reziduální postřik pomocí DDT a insekticidem ošetřených postelí. Larvy Mansonia připojují své dýchací trubice k podvodním kořenům a rostlinám, aby přežily. Zatímco chemické larvicidy poskytují pouze částečnou kontrolu, odstranění rostlin by mohlo zabránit vývoji vektorů, ale také potenciálním nepříznivým účinkům na vodní prostředí. Kontrola vektoru lymfatické filariózy je opomíjena ve srovnání s mnohem zavedenějším úsilím o kontrolu vektorů malárie a dengue. V oblastech, kde je stejný druh komárů odpovědný za přenos více patogenů, by měly být použity metody integrované vektorové kontroly.
Řízení
Globální alianci pro eliminaci lymfatické filariózy zahájila Světová zdravotnická organizace v roce 2000 se dvěma hlavními cíli: 1) přerušit přenos a 2) zmírnit utrpení postižených jedinců. Programy masové léčby drogové závislosti jsou hlavní strategií pro přerušení přenosu parazitů a zvládání chorobnosti, zaměřené na hygienu, zlepšuje kvalitu života infikovaných jedinců.
Drogy
Cílem komunitního úsilí je eliminovat mikrofilárie z krve infikovaných jedinců, aby se zabránilo přenosu na komáry. Toho je primárně dosaženo použitím drog. Léčba infekce B. malayi je stejná jako u Bancroftianovy filariózy. Diethylkarbamazin byl používán v programech hromadné léčby jako účinný mikrofilricidní lék na několika místech, včetně Indie. I když má diethylkarbamazin sklon k nežádoucím reakcím, jako je okamžitá horečka a slabost, není známo, že by způsoboval dlouhodobé nepříznivé účinky léku. Bylo prokázáno, že zabíjí jak dospělé červy, tak mikrofilárie. V Malajsii dávky diethylkarbamazinu (6 mg / kg týdně po dobu 6 týdnů; 6 mg / kg denně po dobu 9 dnů) snížily mikrofilárie o 80% po dobu 18–24 měsíců po léčbě bez kontroly komárů. Počty mikrofilárií se pomalu vracejí mnoho měsíců po léčbě, což vyžaduje několik dávek léku v průběhu času, aby bylo možné dosáhnout dlouhodobé kontroly. Není však známo, kolik let hromadného podávání léků je zapotřebí k eliminaci přenosu. od roku 2007 byly potvrzeny případy rezistence na diethylkarbamazin.
Ukázalo se, že jednotlivé dávky dvou léčivých přípravků (albendazol-diethylkarbamazin a albendazol-ivermektin) odstraňují 99% mikrofilárií rok po léčbě a pomáhají zlepšit elefantiázu v časných stádiích onemocnění. Nezdá se, že by Ivermectin zabíjel dospělé červy, ale slouží jako méně toxický mikrofilaricid.
Od objevu významu bakterií Wolbachia v životním cyklu B. malayi a dalších hlístic se nové snahy o léky zaměřily na endobakterie. Tetracykliny, rifampicin a chloramfenikol byly účinné in vitro tím, že interferovaly s rozmnožováním larev a vývojem mikrofilárií. Ukázalo se, že tetracykliny způsobují u dospělých červů reprodukční a embryogenetické abnormality, což vede ke sterilitě červů. Klinické studie prokázaly úspěšnou redukci Wolbachie a mikrofilárií u pacientů infikovaných onchocerciasis a W. bancrofti . Tato antibiotika, i když působí mírně nepřímější cestou, jsou slibnými antifilariálními léky.
Hygiena
U lymfatické filariózy je často pozorována sekundární bakteriální infekce. Přísné hygienické postupy, včetně každodenního mytí vodou a mýdlem a dezinfekce ran, mohou pomoci uzdravit infikované povrchy a zpomalit a potenciálně zvrátit stávající poškození tkání. Podpora hygieny je u pacientů s lymfatickou filariázou nezbytná vzhledem k oslabenému imunitnímu a poškozenému lymfatickému systému a může pomoci předcházet utrpení a invaliditě.
Epidemiologie
B. malayi infikuje 13 milionů lidí v jižní a jihovýchodní Asii a je zodpovědný za téměř 10% z celkového počtu případů lymfatické filariózy na světě. Infekce B. malayi je endemická nebo potenciálně endemická v 16 zemích, kde je nejběžnější v jižní Číně a Indii, ale vyskytuje se také v Indonésii, Thajsku, Vietnamu, Malajsii, na Filipínách a v Jižní Koreji. Distribuce B. malayi se v těchto oblastech překrývá s W. bancrofti , ale s B. timori koexistuje . Regionální ohniska endemicity jsou částečně určována vektory komárů
Dějiny
Výrazný parazit
B. malayi byla objevena v roce 1927 nizozemským parazitologem Steffenem Lambertem Brugem (1879–1946) (který je ve vědecké literatuře běžně známý jako SL Brug) při práci v Indonésii. Bylo to podobné jako u jiného vláknitého škrkavka Wuchereria bancrofti (tehdy nazývaného Filaria (Microfilaria) bancrofti ). Ale nový druh lidské filarie na severní Sumatře byl fyziologicky i morfologicky odlišný od mikrofilárií W. bancrofti, které se běžně vyskytují v Jakartě. Na základě jejich podobnosti a rozdílů byl nový druh pojmenován Filaria malayi . Navzdory epidemiologickým studiím identifikujícím Filaria malayi v Indii, na Srí Lance, v Číně, v Severním Vietnamu a v Malajsii ve 30. letech byla hypotéza Lichtensteina a Bruga přijata až ve 40. letech 20. století, kdy Rao a Mapelstone identifikovali dva dospělé červy v Indii.
Na základě podobnosti s W. bancrofti navrhli Rao a Mapelstone zavolat parazita Wuchereria malayi. Po objevení nových druhů, jako je W. pahangi (nyní B. pahangi ) v roce 1956, a W. patei (nyní B. patei ) v roce 1958, byla vědecká klasifikace přehodnocena v roce 1960. Buckley navrhl rozdělit starý rod Wuchereria , do dvou rodů, Wuchereria a představil novou Brugii po původním objeviteli. Pak Wuchereria obsahuje pouze W. bancrofti , u kterého bylo dosud zjištěno, že infikuje pouze člověka, a rod Brugia obsahuje B. malayi , který infikuje lidi a zvířata, stejně jako další zoonotické druhy.
Různé kmeny
V roce 1957 Turner a Edeson v Malajsii objevili dva poddruhy člověka infikujícího B. malayi na základě pozorování různých vzorců periodicity mikrofilárií. Periodicita označuje výrazný vrchol počtu mikrofilárií během 24hodinového intervalu, kdy jsou mikrofilárie přítomné a zjistitelné v cirkulující krvi. Základ tohoto jevu zůstává do značné míry neznámý.
- Noční periodicita: mikrofilárie nejsou v krvi detekovatelné po většinu dne, ale mikrofilární hustota vrcholí mezi půlnocí a 2 hodinou v noci.
- Noční subperiodicita: mikrofilárie jsou v krvi přítomny po celou dobu, ale největší hustoty se objevují mezi polednem a 20:00.
Výzkum
V roce 2007 vědci sekvenují na genom z Brugia malayi . Identifikace genů tohoto organismu může vést k vývoji nových léků a vakcín .
K dešifrování genomu bylo provedeno „Sekvenování brokovnic celým genomem“. Bylo zjištěno, že genom má velikost přibližně 90-95 megabází. Výsledky sekvenování byly poté porovnány s výsledky referenčního hlístice Caenorhabditis elegans spolu s jeho prototypem Caenorhabditis briggsae . Tyto dva volně žijící hlístice byly zahrnuty do studie a byly důležité z několika důvodů:
- srovnání genomů pomocí C. elegans umožnilo identifikaci podobných vazeb v genech
- vědci našli genomovou konzervaci s absencí konzervace na lokálnější genové úrovni
- to prokázalo, že mezi C. elegans a B. malayi v průběhu času došlo k přeskupení a umožnilo vědcům identifikovat geny nebo proteiny, které byly specifické pro B. malayi
- tyto jedinečné geny byly významné, protože mohly vést k parazitismu pozorovanému u B. malayi , a proto jsou potenciálními cíli pro budoucí studie
- vědci našli genomovou konzervaci s absencí konzervace na lokálnější genové úrovni
- genové vazby nabízejí vhled do evolučního trendu parazitických genů, které by mohly poskytnout vodítka pro další vysvětlení jejich jedinečné schopnosti úspěšně přežít u lidí po mnoho let
Nové léky
Sekvenční srovnání mezi těmito dvěma genomy umožňuje mapování ortologů C. elegans na geny B. malayi . Použitím orthology mapování (mezi C. elegans a B.malayi ) a začlenění rozsáhlé genomové a funkční genomové data, včetně celého genomu obrazovek RNAi, které již existují C. elegans , potenciálně esenciální geny B. malayi mohou být identifikovány. Vědci doufají, že budou schopni zacílit tyto geny jako potenciální nové cíle pro léčbu drogami. Životnost tohoto parazita komplikuje léčbu, protože většina existujících léků cílí na larvy, a proto nezabíjejí dospělé červy. Léky musí být často užívány pravidelně po celá léta a červi mohou způsobit masivní imunitní reakci, když zemřou a uvolní cizí molekuly v těle. Léková léčba filariózy se za posledních 20 let významně nezměnila a vzhledem k rostoucímu riziku rezistence je naléhavě nutné vyvinout nové antifilariální lékové terapie. Ze sekvence genomu bylo identifikováno několik metabolických drah obsahujících desítky genových produktů, které mohou být užitečné při objevování cílenějších a účinnějších lékových terapií.
- možné nové cíle v oblasti drog zahrnují:
- línání
- jaderné receptory
- kolageny a zpracování kolagenu
- neuronální signalizace
- B. malayi kinome
- spoléhání se na metabolismus hostitele ( B. malayi ) a endosymbiont ( Wolbachia )
Tyto potenciální nové cíle pro léky nebo vakcíny mohou poskytnout nové příležitosti pro porozumění, léčbu a prevenci elefantiázy.
Vztah s Wolbachií
Vztah mezi bakteriemi Wolbachia a B. malayi není zcela objasněn. Při extrapolaci z výzkumu provedeného s Wuchereria bancrofti , dalším hlístem , které způsobuje filariózu, může Wolbachia pomáhat při embryogenezi červa, být zodpovědná za silné zánětlivé reakce makrofágů a onemocnění vláken a může souviset s nástupem lyfedému a slepoty někdy spojené s B. malajské infekce. Ve studii provedené na univerzitě v Bonnu v Ghaně doxycyklin účinně vyčerpal Wolbachii z W. bancrofti . Je pravděpodobné, že mechanismus doxycyklinu je podobný mechanismu u jiných druhů vláken, tj. Převažující blokáda embryogeneze, vedoucí k poklesu mikrofilárií podle jejich poločasu. To by mohlo učinit z léčby doxycyklinem další nástroj pro léčbu chorob souvisejících s mikrofiláriemi u Bancroftianovy filariózy spolu s B. malayi fiariasis. Průběh léčby doxycyklinem by mohl být mnohem kratší, protože by dospělého červa sterilizoval v jednom záběru, než aby se opakovaně musel zaměřovat na doplněné larvy, které současná léčba zabíjí, a pro infikovaného jedince by bylo méně vedlejších účinků.
Transplantační výzkum
Další nadějné využití výzkumu je v oblasti transplantačního výzkumu. Vzhledem k tomu, že genom B. malayi je prvním parazitickým genomem, který byl sekvenován, je důležité pochopit důsledky pro mechanismus parazitismu u lidí. Podle Alana L. Scotta, Ph.D., spolupracovníka na univerzitě Johns Hopkins University, pochopení toho, jak se konkrétní parazit, jako je B. malayi , dokáže přizpůsobit člověku, může přinést zdravotní výhody daleko za rámec léčby elefantiázy. Podle autora: „Tento červ může v hostiteli pobývat roky a nemusí nutně způsobovat nemoci, ve skutečnosti čím méně onemocnění jedinec má, tím více červů je v oběhu. Nyní, když víme, že tyto geny u lidí neexistují můžeme je zaměřit na kontrolu nemocí. “ Některé z předpokládaných proteinů pro tyto nové geny vypadají podobně jako známé imunomodulátorové proteiny, regulátory imunitního systému, což naznačuje, že se podílejí na deaktivaci imunitního systému hostitele, aby zajistily, že parazit zůstane nezjištěný. Znalosti o těchto dosud neznámých potlačujících imunitu by mohly být užitečné také při transplantacích orgánů a při léčbě autoimunitních onemocnění.
Podle projektu Filarial Genome, který provádí Zvláštní program pro výzkum a výcvik v oblasti tropických nemocí, je gen MIF Brugia malayi exprimován ve všech fázích životního cyklu parazita a výsledky naznačují, že MIF B. malayi může interagovat s člověkem imunitní systém v průběhu infekce změnou funkce makrofágů u infikovaného jedince. Studie v současné době testují hypotézu, že MIF může být zapojen do snižování imunitní odpovědi hostitele na mikrofilárie. Pochopení toho, jak se tento konkrétní parazit přizpůsobil člověku, může vědcům po transplantaci orgánů pomoci tím, že přijde na to, jak zabránit imunitnímu systému v útoku na transplantovanou tkáň.
Viz také
Reference
- Článek je založen na veřejné doméně (web vlády USA), odboru zdravotnictví a sociálních služeb USA / Centrum pro kontrolu nemocí: filarióza.
externí odkazy
| Klasifikace |
|---|
- Brugia_life_cycle_and_adults_in_lymphatics video R. Rao
- Brugia malayi ve společnosti UMich
- Zvláštní program pro výzkum a výcvik v oblasti tropických nemocí (TDR). "Funkční analýza genů Brugia malayi". 2004
- University of Pittsburgh. „Vědci odhalují genetická tajemství ničivého lidského parazita“. 20. září 2007.
- Hoerauf, Achim. „Cílení na wolbachii, doxycyklin snižuje patologii lymfatické filariózy“. 18. září 2006.
- Globální program Světové zdravotnické organizace na odstranění lymfatické filariózy
- Globální aliance pro eliminaci lymfatické filariózy
- Infekční nemoci Gideon online
- Parasite Image Library, Centers for Disease Control
