Kalorimetrie - Calorimetry
Kalorimetrie je věda nebo akt měření změn stavových proměnných těla za účelem odvození přenosu tepla souvisejícího se změnami jeho stavu v důsledku například chemických reakcí , fyzikálních změn nebo fázových přechodů za určitých omezení. Kalorimetrie se provádí pomocí kalorimetru . Slovo kalorimetrie je odvozeno z latinského slova calor , což znamená teplo, a řeckého slova μέτρον ( metron ), což znamená míra. Skotský lékař a vědec Joseph Black , který jako první rozpoznal rozdíl mezi teplem a teplotou , je považován za zakladatele vědy o kalorimetrii.
Nepřímá kalorimetrie počítá teplo, které živé organismy produkují, měřením jejich produkce oxidu uhličitého a dusíkatého odpadu (často amoniaku ve vodních organismech nebo močoviny v suchozemských) nebo z jejich spotřeby kyslíku . Lavoisier poznamenal v roce 1780, že lze takto předpovědět produkci tepla ze spotřeby kyslíku pomocí vícenásobné regrese . Energie rozpočet dynamické teorie vysvětluje, proč tento postup je správný. Teplo generované živými organismy lze měřit také přímou kalorimetrií , při které je celý organismus umístěn pro měření v kalorimetru.
Široce používaným moderním nástrojem je diferenciální skenovací kalorimetr , zařízení, které umožňuje získávat tepelná data na malém množství materiálu. Zahrnuje zahřívání vzorku regulovanou rychlostí a zaznamenávání toku tepla buď do nebo ze vzorku.
Klasický kalorimetrický výpočet tepla
Případy s diferencovatelnou stavovou rovnicí pro jednosložkové tělo
Základní klasický výpočet s ohledem na objem
Kalorimetrie vyžaduje, aby referenční materiál, který mění teplotu, měl známé určité tepelné konstitutivní vlastnosti. Klasickým pravidlem, které uznávají Clausius a Kelvin , je, že tlak vyvíjený kalorimetrickým materiálem je plně a rychle určen pouze jeho teplotou a objemem; toto pravidlo platí pro změny, které nezahrnují fázové změny, jako je tání ledu. Existuje mnoho materiálů, které tomuto pravidlu nevyhovují, a současný vzorec klasické kalorimetrie pro ně neposkytuje dostatečný přehled. Zde se předpokládá, že pro používané kalorimetrické materiály platí klasické pravidlo a propozice jsou napsány matematicky:
Tepelná odezva kalorimetrického materiálu je plně popsána jeho tlakem jako hodnotou jeho konstitutivní funkce pouze objemu a teploty . Všechny přírůstky zde musí být velmi malé. Tento výpočet se týká domény objemu a teploty těla, ve které nedochází ke fázové změně a je přítomna pouze jedna fáze. Důležitým předpokladem je zde kontinuita majetkových vztahů. Pro fázovou změnu je nutná jiná analýza
Když kalorimetrické těleso získá malý přírůstek tepla, s malými přírůstky svého objemu a jeho teploty, přírůstek tepla získaný tělesem kalorimetrického materiálu je dán vztahem
kde
- označuje latentní teplo vzhledem k objemu kalorimetrického materiálu při konstantní regulované teplotě . Tlak okolí na materiál je instrumentálně upraven tak, aby zavedl zvolenou změnu objemu s počátečním objemem . K určení tohoto latentního tepla je změna objemu účinně nezávisle instrumentálně proměnnou veličinou. Toto latentní teplo nepatří mezi široce používané, ale má teoretický nebo koncepční význam.
- označuje tepelnou kapacitu kalorimetrického materiálu při stálém stálém objemu , zatímco tlak materiálu se může volně měnit s počáteční teplotou . Teplota je nucena měnit vystavením vhodné tepelné lázni. Je zvykem psát jednoduše tak , nebo ještě stručněji jako . Toto latentní teplo je jedním ze dvou široce používaných.
Latentní teplo vzhledem k objemu je teplo potřebné k jednotkovému zvýšení objemu při konstantní teplotě. Dá se říci, že je ‚měřeno podél izotermy ', a tlak, který materiál vyvíjí, se může volně měnit, podle jeho ústavního zákona . Pro daný materiál může mít kladné nebo záporné znaménko nebo výjimečně může být nulový, což může záviset na teplotě, jako je tomu u vody kolem 4 ° C. Koncept latentního tepla s ohledem na objem byl možná poprvé rozpoznán od Joseph Black v roce 1762. Pojem ‚latentní tepelné expanze‘ se také používá. Latentní teplo vzhledem k objemu lze také nazvat „latentní energií vzhledem k objemu“. Pro všechna tato použití „latentního tepla“ používá systematičtější terminologie „kapacitu latentního tepla“.
Tepelná kapacita při konstantním objemu je teplo potřebné pro zvýšení teploty jednotky při konstantním objemu. Lze říci, že se „měří podél izochoru“, a opět se může volně měnit tlak, který materiál vyvíjí. Vždy to má kladné znamení. To znamená, že pro zvýšení teploty těla bez změny jeho objemu musí být do něj dodáváno teplo. To je v souladu s běžnou zkušeností.
Veličiny jako se někdy nazývají „diferenciály křivek“, protože se měří podél křivek na povrchu.
Klasická teorie pro konstantní objemovou (izochorickou) kalorimetrii
Kalorimetrie konstantního objemu je kalorimetrie prováděná při konstantním objemu . To zahrnuje použití kalorimetru s konstantním objemem . Teplo se stále měří výše uvedeným principem kalorimetrie.
To znamená, že ve vhodně konstruovaného kalorimetru, nazývané Kalorimetr bomby, přírůstek objemu může být zmizet, . Pro kalorimetrii konstantního objemu:
kde
- označuje přírůstek teploty a
- označuje tepelnou kapacitu při stálém objemu.
Klasický výpočet tepla s ohledem na tlak
Z výše uvedeného pravidla výpočtu tepla s ohledem na objem vyplývá jedno s ohledem na tlak.
V procesu malých přírůstků, jeho tlaku a teploty, je přírůstek tepla získaný tělesem kalorimetrického materiálu dán vztahem
kde
- označuje latentní teplo z hlediska tlaku kalorimetrického materiálu při konstantní teplotě, zatímco objem a tlak těla se mohou volně měnit, při tlaku a teplotě ;
- označuje tepelnou kapacitu kalorimetrického materiálu při konstantním tlaku, zatímco teplota a objem těla se mohou volně měnit při tlaku a teplotě . Je zvykem psát jednoduše tak , nebo ještě stručněji jako .
Nová množství zde souvisí s předchozími:
kde
- označuje parciální derivace a s ohledem na hodnoceny
a
- označuje částečnou derivaci s ohledem na hodnocené pro .
Latentní ohřívá a je vždy opačného znaménka.
Je běžné označovat poměr konkrétních ohřevů jako
- často jen psáno jako .
Kalorimetrie fázovou změnou, stavová rovnice ukazuje diskontinuitu jednoho skoku
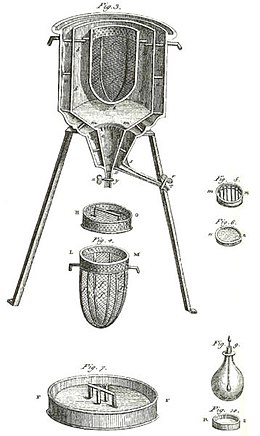
Časný kalorimetr používali Laplace a Lavoisier , jak je znázorněno na obrázku výše. Fungovalo to při konstantní teplotě a při atmosférickém tlaku. Zapojené latentní teplo pak nebylo latentním teplem s ohledem na objem nebo s ohledem na tlak, jak je uvedeno výše pro kalorimetrii bez fázové změny. Latentní teplo obsažené v tomto kalorimetru bylo s ohledem na fázovou změnu, přirozeně se vyskytující při konstantní teplotě. Tento druh kalorimetru pracoval měřením hmotnosti vody produkované tavením ledu, což je fázová změna .
Kumulace vytápění
Pro časově závislé procesu ohřevu kalorimetrického materiálu, definované společně průběžně progrese z a , začínající v čase a končí v čase , je možno vypočítat kumulovaný množství tepla dodávaného, . Tento výpočet se provádí matematickou integrací podél postupu s ohledem na čas. Důvodem je, že přírůstky tepla jsou „aditivní“; ale to neznamená, že teplo je konzervativní veličina. Myšlenku, že teplo je konzervativní množství, vynalezl Lavoisier a nazývá se „ kalorická teorie “; v polovině devatenáctého století to bylo uznáno jako mylné. Napsané symbolem není množství omezeno na přírůstek s velmi malými hodnotami; to je v rozporu s .
Dá se psát
- .
Tento výraz používá veličiny, jako jsou ty, které jsou definovány v níže uvedené části s názvem „Matematické aspekty výše uvedených pravidel“.
Matematické aspekty výše uvedených pravidel
Použití „velmi malých“ množství, jako například, souvisí s fyzickým požadavkem, aby množství bylo „rychle určeno“ pomocí a ; takové „rychlé určení“ se týká fyzického procesu. Tato „velmi malá“ množství se používají v Leibnizově přístupu k nekonečně malému počtu . Newton přístup používá namísto ‚ Fluxions ‘, jako je , což je více zřejmé, že musí být ‚rychle určí‘.
Pokud jde o fluxions, lze napsat první výše uvedené pravidlo výpočtu
kde
- označuje čas
- označuje časovou rychlost ohřevu kalorimetrického materiálu v čase
- označuje časovou rychlost změny objemu kalorimetrického materiálu v čase
- označuje časovou rychlost změny teploty kalorimetrického materiálu.
Přírůstek a tok se získají pro konkrétní čas, který určuje hodnoty veličin na pravé straně výše uvedených pravidel. To však není důvod očekávat, že by měla existovat matematická funkce . Z tohoto důvodu se říká , že přírůstek je „nedokonalý rozdíl“ nebo „ nepřesný rozdíl “. Některé knihy to označují psaním místo . V některých knihách je také použita notace đQ . Nedbalost ohledně toho může vést k chybě.
Množství je správně řekl, aby byl funkční kontinuálního společného postupu z a , ale v matematické definice funkce , není funkce . I když je proudění je zde definována jako funkce času , symboly a příslušně samostatně stojící zde nejsou definovány.
Fyzický rozsah výše uvedených pravidel kalorimetrie
Výše uvedená pravidla se vztahují pouze na vhodné kalorimetrické materiály. Výrazy „rychle“ a „velmi malé“ vyžadují empirickou fyzickou kontrolu oblasti platnosti výše uvedených pravidel.
Výše uvedená pravidla pro výpočet tepla patří k čisté kalorimetrii. Neodkazují na termodynamiku a byly většinou pochopeny před příchodem termodynamiky. Jsou základem „termo“ příspěvku k termodynamice. Příspěvek „dynamiky“ je založen na myšlence práce , která se ve výše uvedených pravidlech výpočtu nepoužívá.
Experimentálně pohodlně měřené koeficienty
Empiricky je vhodné měřit vlastnosti kalorimetrických materiálů za experimentálně kontrolovaných podmínek.
Zvýšení tlaku při konstantním objemu
Pro měření při experimentálně řízeném objemu lze použít výše uvedený předpoklad, že tlak tělesa kalorimetrického materiálu lze vyjádřit jako funkci jeho objemu a teploty.
Pro měření při konstantním experimentálně regulovaném objemu je isochorický koeficient nárůstu tlaku s teplotou definován symbolem
- .
Expanze při konstantním tlaku
Pro měření při experimentálně řízeném tlaku se předpokládá, že objem tělesa kalorimetrického materiálu lze vyjádřit jako funkci jeho teploty a tlaku . Tento předpoklad souvisí, ale není stejný jako výše uvedený předpoklad, že tlak tělesa kalorimetrického materiálu je znám jako funkce jeho objemu a teploty; anomální chování materiálů může tento vztah ovlivnit.
Množství, které se pohodlně měří při konstantním experimentálně řízeném tlaku, koeficientu objemové expanze isobaru, je definováno pomocí
- .
Stlačitelnost při konstantní teplotě
U měření při experimentálně řízené teplotě se opět předpokládá, že objem tělesa kalorimetrického materiálu lze vyjádřit jako funkci jeho teploty a tlaku , za stejných podmínek, jaké jsou uvedeny výše.
Množství, které se pohodlně měří při konstantní experimentálně řízené teplotě, izotermické stlačitelnosti, je definováno jako
- .
Vztah mezi klasickými kalorimetrickými veličinami
Za předpokladu, že je pravidlo známé, lze odvodit jeho funkci, která se používá výše při klasickém výpočtu tepla s ohledem na tlak. Tuto funkci lze najít experimentálně z koeficientů a prostřednictvím matematicky odvoditelného vztahu
- .
Souvislost mezi kalorimetrií a termodynamikou
Termodynamika se postupně vyvíjela během první poloviny devatenáctého století a stavěla na výše uvedené teorii kalorimetrie, která byla vypracována před ní, a na dalších objevech. Podle Gislasona a Craiga (2005): „Většina termodynamických údajů pochází z kalorimetrie ...“ Podle Kondepudiho (2008): „Kalorimetrie je v dnešních laboratořích široce používána.“
Z hlediska termodynamiky je vnitřní energie z kalorimetrického materiálu lze považovat za hodnotu funkce z , s parciálních derivací a .
Pak lze ukázat, že lze napsat termodynamickou verzi výše uvedených kalorimetrických pravidel:
s
a
- .
Opět platí, že se dále z hlediska termodynamiky je vnitřní energie z kalorimetrického materiálu může někdy, v závislosti na kalorimetrické materiál považuje za hodnotu funkce z , s částečným deriváty a , a s je exprimovatelná jako hodnota funkce z , s částečnými deriváty a .
Pak podle Adkinsa (1975) lze ukázat, že lze napsat další termodynamickou verzi výše uvedených kalorimetrických pravidel:
s
a
- .
Kromě výše uvedeného kalorimetrického faktu, že latentní ohřívá a jsou vždy opačného znaménka, lze pomocí termodynamického konceptu práce ukázat, že
Speciální zájem o termodynamiku v kalorimetrii: izotermické segmenty Carnotova cyklu
Kalorimetrie má zvláštní výhodu pro termodynamiku. Vypráví o teple absorbovaném nebo emitovaném v izotermickém segmentu Carnotova cyklu .
Carnotův cyklus je speciální druh cyklického procesu ovlivňujícího tělo složené z materiálu vhodného pro použití v tepelném motoru. Takový materiál je toho druhu, o kterém se uvažuje při kalorimetrii, jak je uvedeno výše, který vyvíjí tlak, který je velmi rychle určen pouze teplotou a objemem. Říká se, že takové tělo se mění reverzibilně. Carnotův cyklus se skládá ze čtyř po sobě jdoucích fází nebo segmentů:
(1) změna objemu z objemu na objem při konstantní teplotě tak, aby došlo k proudění tepla do těla (známé jako izotermická změna)
(2) změna objemu z na objem při proměnné teplotě jen tak, aby nevznikl žádný tok tepla (známý jako adiabatická změna)
(3) další izotermická změna objemu od do objemu při konstantní teplotě , jako je proudění nebo teplo z těla a jen tak, aby se přesně připravila na následující změnu
(4) další adiabatická změna objemu zezadu na jen takovou, aby se tělo vrátilo na počáteční teplotu .
V izotermickém segmentu (1) je teplo, které proudí do těla, dáno
a v izotermickém segmentu (3) je teplo, které proudí z těla, dáno
- .
Vzhledem k tomu, že segmenty (2) a (4) jsou adiabaty, během nich neproudí žádné teplo do těla ani z něj, a následně je čisté teplo dodávané tělu během cyklu dáno
- .
Toto množství je používáno termodynamikou a zvláštním způsobem souvisí s čistou prací vykonanou tělem během Carnotova cyklu. Čistá změna vnitřní energie těla během Carnotova cyklu se rovná nule, protože materiál pracovního těla má výše uvedené speciální vlastnosti.
Zvláštní zájem o kalorimetrii v termodynamice: vztahy mezi klasickými kalorimetrickými veličinami
Vztah latentního tepla s ohledem na objem a stavová rovnice
Množství , latentní teplo vzhledem k objemu, patří ke klasické kalorimetrii. Zahrnuje výskyt přenosu energie prací v procesu, ve kterém se také přenáší teplo; množství však bylo zvažováno před objasněním vztahu mezi přenosem tepla a prací vynálezem termodynamiky. Ve světle termodynamiky se ukazuje, že klasická kalorimetrická veličina je úzce spojena se stavovou rovnicí kalorimetrického materiálu . Pokud se teplota měří v termodynamickém absolutním měřítku, vztah je vyjádřen ve vzorci
- .
Rozdíl konkrétních jízd
Vztah poskytuje pokročilá termodynamika
- .
Z toho další matematické a termodynamické uvažování vede k dalšímu vztahu mezi klasickými kalorimetrickými veličinami. Rozdíl konkrétních ohřevů je dán vztahem
- .
Praktická kalorimetrie s konstantním objemem (bombová kalorimetrie) pro termodynamické studie
Kalorimetrie konstantního objemu je kalorimetrie prováděná při konstantním objemu . To zahrnuje použití kalorimetru s konstantním objemem .
V kalorimetrii s konstantním objemem se neprovádí žádná práce, takže měřené teplo se rovná změně vnitřní energie systému. Předpokládá se, že tepelná kapacita při stálém objemu je nezávislá na teplotě.
Teplo se měří principem kalorimetrie.
kde
- Δ U je změna vnitřní energie ,
- Δ T je změna teploty a
- C V je tepelná kapacita při stálém objemu.
V kalorimetrii s konstantním objemem není tlak udržován konstantní. Pokud existuje rozdíl tlaků mezi počátečním a konečným stavem, je třeba změřit teplo, aby se zajistila změna entalpie . Jeden pak má
kde
- Δ H je změna entalpie a
- V je neměnný objem komory pro vzorky.
Viz také
- Izotermická mikrokalorimetrie (IMC)
- Izotermická titrační kalorimetrie
- Sorpční kalorimetrie
- Reakční kalorimetr
Reference
Knihy
- Adkins, CJ (1975). Rovnovážná termodynamika , druhé vydání, McGraw-Hill, Londýn, ISBN 0-07-084057-1 .
- Bailyn, M. (1994). Průzkum termodynamiky , Americký fyzikální institut, New York, ISBN 0-88318-797-3 .
- Bryan, GH (1907). Termodynamika. Úvodní pojednání zabývající se hlavně First Principles and their Direct Applications , BG Tuebner, Leipzig.
- Callen, HB (1960/1985). Termodynamika a úvod do termostatiky , druhé vydání, Wiley, New York, ISBN 981-253-185-8 .
- Crawford, FH (1963). Teplo, termodynamika a statistická fyzika , Rupert Hart-Davis, Londýn, Harcourt, Brace a svět.
- Guggenheim, EA (1949/1967). Termodynamika. Pokročilá léčba pro chemiky a fyziky , North-Holland, Amsterdam.
- Iribarne, JV, Godson, WL (1973/1981), Atmosférická termodynamika , druhé vydání, D. Reidel, Kluwer Academic Publishers, Dordrecht, ISBN 90-277-1296-4 .
- Kondepudi, D. (2008). Úvod do moderní termodynamiky , Wiley, Chichester, ISBN 978-0-470-01598-8 .
- Landsberg, PT (1978). Termodynamika a statistická mechanika , Oxford University Press, Oxford, ISBN 0-19-851142-6 .
- Lewis, GN, Randall, M. (1923/1961). Termodynamika , druhé vydání revidováno KS Pitzer, L. Brewer, McGraw-Hill, New York.
- Maxwell, JC (1872). Theory of Heat , třetí vydání, Longmans, Green and Co., London.
- Partington, JR (1949). Pokročilé pojednání o fyzikální chemii , svazek 1, Základní principy. Vlastnosti plynů , Longmans, Green a Co., Londýn.
- Planck, M. (1923/1926). Pojednání o termodynamice , třetí anglické vydání přeložené A. Oggem ze sedmého německého vydání, Longmans, Green & Co., London.
- Truesdell, C., Bharatha, S. (1977). Koncepty a logika klasické termodynamiky jako teorie tepelných motorů, důsledně postavené na základech , které položili S. Carnot a F. Reech , Springer, New York, ISBN 0-387-07971-8 .































































![\ delta Q \ = \ left [p (V, T) \, + \, \ left. \ frac {\ částečné U} {\ částečné V} \ pravé | _ {(V, T)} \ pravé] \, \ delta V \, + \, \ left. \ frac {\ částečné U} {\ částečné T} \ pravé | _ {(V, T)} \, \ delta T](https://wikimedia.org/api/rest_v1/media/math/render/svg/f84955a4832939c4d1337fcfadae0affc3a945bc)








![\ delta Q \ = \ left [\ left. \ frac {\ částečné U} {\ částečné p} \ pravé | _ {(p, T)} \, + \, p \ levé. \ frac {\ částečné V} {\ částečné p} \ pravé | _ {( p, T)} \ right] \ delta p \, + \, \ left [\ left. \ frac {\ částečné U} {\ částečné T} \ pravé | _ {(p, T)} \, + \, p \ vlevo. \ frac {\ částečné V} {\ částečné T} \ pravé | _ {(p, T)} \ pravé] \ delta T](https://wikimedia.org/api/rest_v1/media/math/render/svg/c80e88197ed385fd3debc25941f418cec98cd244)















![C_p (p, T) -C_V (V, T) = \ left [p (V, T) \, + \, \ left. \ Frac {\ částečné U} {\ částečné V} \ pravé | _ {(V , T)} \ vpravo] \, \ vlevo. \ Frac {\ částečné V} {\ částečné T} \ pravé | _ {(p, T)}](https://wikimedia.org/api/rest_v1/media/math/render/svg/0e5046f626f9dccc1569d9c418d77d6cd6c0a06b)


