Hydronium - Hydronium
|
|
|||
|
|
|||
| Jména | |||
|---|---|---|---|
|
Název IUPAC
oxonium
|
|||
| Ostatní jména
hydroniový ion
|
|||
| Identifikátory | |||
|
3D model ( JSmol )
|
|||
| ČEBI | |||
| ChemSpider | |||
|
PubChem CID
|
|||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Vlastnosti | |||
|
H 3Ó+ |
|||
| Molární hmotnost | 19,02 g/mol | ||
| Kyselost (p K a ) | -1,74 nebo 0 (nejednoznačné, viz text) | ||
| Konjugovaná základna | Voda | ||
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Reference na infobox | |||
V chemii je hydronium (hydroxonium v tradiční britské angličtině) běžným názvem vodného kationtu H
3Ó+
, Typ oxoniové iontu produkován protonací z vody . Často je vnímán jako kladný iont přítomný, když je kyselina Arrhenius rozpuštěna ve vodě, protože molekuly kyseliny Arrhenius v roztoku se vzdávají protonu (pozitivní iont vodíku , H+
) na okolní molekuly vody ( H.
2O ). Ve skutečnosti musí být kyseliny obklopeny více než jednou molekulou vody, aby mohly ionizovat, čímž se získá vodná H+ a konjugovaná báze. Experimentální podporu získaly tři hlavní struktury vodného protonu: kation Eigen, což je tetrahydrát, H3O+(H2O) 3; Zundelův kation, což je symetrický dihydrát, H+(H2O) 2; a Stoyanovův kation, rozšířený Zundelův kation, což je hexahydrát: H+(H2O) 2 (H2O) 4. Spektroskopické důkazy z přesně definovaných IR spekter drtivě podporují Stoyanovův kation jako převládající formu. Z tohoto důvodu bylo navrženo, že pokud je to možné, měl by být místo hydroniového iontu použit symbol H+(aq).
Stanovení pH
Koncentrace iontů H+ určuje pH roztoku . Koncentrace hydroxidových iontů určuje pOH roztoku . Molekuly v čisté vodě se automaticky disociují na vodné protony a hydroxidové ionty v následující rovnováze:
- H
2O ⇌ OH-
+ H+
V čisté vodě je stejný počet hydroxidů a iontů H+, jde tedy o neutrální roztok. Při 25 ° C (77 ° F) má voda pH 7 a pOH 7 (to se mění, když se teplota mění: viz autoionizace vody ). Hodnota pH nižší než 7 znamená kyselý roztok a hodnota pH vyšší než 7 označuje zásaditý roztok.
Nomenklatura
Podle nomenklatury organické chemie IUPAC by měl být hydroniový ion označován jako oxonium . Hydroxonium může být také použito jednoznačně k jeho identifikaci. Návrh návrhu IUPAC také doporučuje použití oxonia a oxidanu v kontextu organické a anorganické chemie.
Oxoniové ion je jakýkoliv iont s trojmocným kationtem kyslíku. Například protonovanou hydroxylovou skupinou je oxoniový iont, nikoli však hydroniový iont.
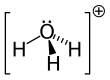
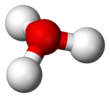
Struktura
Od O+
a N mají stejný počet elektronů, H
3Ó+
je izoelektronický s amoniakem . Jak je vidět na obrázcích výše, H
3Ó+
má trigonální pyramidovou molekulární geometrii s atomem kyslíku na svém vrcholu. H-O-H úhel vazba je přibližně 113 °, a že střed hmoty je velmi blízko k atomu kyslíku. Protože základna pyramidy je tvořena třemi identickými atomy vodíku, H
3Ó+
symetrická vrchní konfigurace molekuly je taková, že patří do C.
3v bodová skupina . Kvůli této symetrii a skutečnosti, že má dipólový moment, jsou pravidla pro výběr otáčení Δ J = ± 1 a Δ K = 0. Přechodový dipól leží podél c -osy a protože negativní náboj je lokalizován poblíž kyslíku atom, dipólový moment ukazuje na vrchol, kolmý na základní rovinu.
Kyseliny a kyselost
Hydratovaný proton je velmi kyselý: při teplotě 25 ° C, jeho p K je přibližně 0. Na druhé straně, Silverstein ukázal, že Ballinger a dlouhá je experimentální výsledky podpořila pKa 0,0 ve vodné protonu.
Vodný proton je nejkyselejším druhem, který může ve vodě existovat (za předpokladu dostatečného množství vody k rozpuštění): jakákoli silnější kyselina ionizuje a poskytne hydratovaný proton. Kyselost H+(aq) je implicitní standard používaný k posouzení síly kyseliny ve vodě: silné kyseliny musí být lepšími donory protonů než H+(aq), protože jinak bude značná část kyseliny existovat v neionizovaném stavu (tj .: slabá kyselina). Na rozdíl od H+(aq) v neutrálních roztocích, které jsou výsledkem autodisociace vody, v kyselých roztocích je H+(aq) dlouhotrvající a koncentrovaný, úměrně síle rozpuštěné kyseliny.
pH bylo původně koncipováno jako míra koncentrace vodíkových iontů ve vodném roztoku. Prakticky všechny takové volné protony jsou rychle hydratovány; kyselost vodného roztoku je proto přesněji charakterizována jeho koncentrací H+(aq). V organických syntézách, jako jsou kyselinou katalyzované reakce, hydroniový iont ( H.
3Ó+
) se používá zaměnitelně s H+
ion; volba jednoho nad druhým nemá žádný významný vliv na mechanismus reakce.
Řešení
Výzkumníci dosud plně charakterizovali solvataci hydroniových iontů ve vodě, částečně proto, že existuje mnoho různých významů solvatace. Studie deprese s bodem mrazu stanovila, že průměrný hydratační ion ve studené vodě je přibližně H
3Ó+
(H.
2Ó)
6: v průměru je každý hydroniový ion solvatován 6 molekulami vody, které nejsou schopné solvatovat jiné molekuly solutu.
Některé hydratační struktury jsou poměrně velké: H
3Ó+
(H.
2Ó)
20Struktura magického iontového čísla (nazývaná magické číslo kvůli jeho zvýšené stabilitě s ohledem na hydratační struktury zahrnující srovnatelný počet molekul vody - to je podobné použití termínu magické číslo jako v jaderné fyzice ) může umístit hydronium do dodekahedrální klece. Novější simulace molekulární dynamiky metody ab initio ukázaly, že v průměru hydratovaný proton sídlí na povrchu H
3Ó+
(H.
2Ó)
20klastr. Dále několik nesourodých vlastností těchto simulací souhlasí s jejich experimentálními protějšky, které navrhují alternativní interpretaci experimentálních výsledků.
Dvě další známé struktury jsou Zundelův kation a Eigenův kation . Solvatační struktura Eigen má hydroniový ion ve středu H
9Ó+
4komplex, ve kterém je hydronium silně vodíkově vázáno na tři sousední molekuly vody. V Zundeli H
5Ó+
2komplex protonu sdílejí rovnoměrně dvě molekuly vody v symetrické vodíkové vazbě . Nedávná práce naznačuje, že oba tyto komplexy představují ideální struktury v obecnějším defektu sítě vodíkových vazeb.
Izolace monomeru hydroniového iontu v kapalné fázi byla dosažena v nevodném superkyselém roztoku s nízkou nukleofilitou ( HF - SbF
5TAK
2). Iont se vyznačoval vysokým rozlišením17
O nukleární magnetická rezonance .
Výpočet entalpií a volných energií různých vodíkových vazeb kolem hydroniového kationtu v kapalné protonované vodě při pokojové teplotě z roku 2007 a studie mechanismu přeskakování protonů pomocí molekulární dynamiky ukázala, že vodíkové vazby kolem hydroniového iontu (vytvořeného s tři vodní ligandy v prvním solvatačním obalu hydronia) jsou ve srovnání s hromadnou vodou poměrně silné.
Stoyanov navrhl nový model na základě infračervené spektroskopie, ve které proton existuje jako H
13Ó+
6ion. Kladný náboj je tak delokalizován přes 6 molekul vody.
Pevné hydroniové soli
U mnoha silných kyselin je možné vytvořit krystaly jejich hydroniové soli, které jsou relativně stabilní. Tyto soli se někdy nazývají kyselé monohydráty . Je pravidlem, že jakákoliv kyselina s ionizační konstantou 10 9 nebo vyšší, může to provést. Kyseliny, jejichž ionizační konstanty jsou nižší než 109, obecně nemohou vytvářet stabilní H
3Ó+
soli. Například kyselina dusičná má ionizační konstantu 10 1,4 a směsi s vodou ve všech poměrech jsou při pokojové teplotě kapalné. Nicméně, kyselina chloristá má ionizační konstantu 10 10 , a je-li kapalina bezvodá kyselina chloristá a voda se spojí v molárním poměru 1: 1, které reagují za vzniku pevného hydronium chloristan ( H
3Ó+
· ClO-
4).
Hydroniový iont také tvoří stabilní sloučeniny s karboranovou superkyselinou H (CB
11H (CH
3)
5Br
6) . Rentgenová krystalografie ukazuje C
3v symetrie pro hydroniový iont s každým protonem interagujícím s atomem bromu, každý ze tří karboranových aniontů v průměru 320 pm od sebe. [N
3O] [H (CB
11HCl
11)] sůl je také rozpustná v benzenu . V krystalech pěstovaných z benzenového roztoku rozpouštědlo kokrystalizuje a H
3O · (C.
6H
6)
3kation je zcela oddělen od aniontu. V kationtu obklopují tři molekuly benzenu hydronium vytvářející interakce pi -atomů s atomy vodíku. Nejbližší (nevazující) přístup aniontu v chloru ke kationtu v kyslíku je 348 pm.
Existuje také mnoho příkladů hydratovaných hydroniových iontů, jako je například H.
5Ó+
2iont v HCl · 2H 2 O , H
7Ó+
3a H.
9Ó+
4ionty jak nalézt v HBr · 4H 2 O .
Mezihvězdná H
3Ó+
Hydronium je hojný molekulární ion v mezihvězdném médiu a nachází se v difuzních a hustých molekulárních mračnech, stejně jako v plazmových ohonech komet. Mezihvězdné zdroje pozorování hydronia obsahují oblasti Střelce B2, Orion OMC-1, Orion BN – IRc2, Orion KL a kometu Hale – Bopp.
Mezihvězdné hydronium je tvořeno řetězcem reakcí zahájených ionizací H
2do H.+
2kosmickým zářením. H
3Ó+
může produkovat buď OH - nebo H
2O prostřednictvím disociativních rekombinačních reakcí, které probíhají velmi rychle i při nízkých (≥10 K) teplotách hustých mraků. To vede k tomu, že hydronium hraje velmi důležitou roli v mezihvězdné iontově neutrální chemii.
Astronomové se zejména zajímají o stanovení množství vody v různých mezihvězdných klimatech kvůli její klíčové roli při chlazení hustých molekulárních plynů radiačními procesy. Nicméně, H
2O nemá mnoho příznivých přechodů pro pozemská pozorování. Ačkoli pozorování HDO ( deuterovaná verze vody ) by mohla být potenciálně použita pro odhad H
2O hojnosti, poměr HDO k H
2O není známo příliš přesně.
Hydronium má na druhé straně několik přechodů, díky nimž je vynikajícím kandidátem pro detekci a identifikaci v různých situacích. Tyto informace byly použity ve spojení s laboratorními měřeními poměrů větvení různých H
3Ó+
disociativní rekombinační reakce za účelem poskytnutí relativně přesných OH - a H
2O hojnosti bez nutnosti přímého pozorování těchto druhů.
Mezihvězdná chemie
Jak již bylo zmíněno dříve, H.
3Ó+
se nachází v difuzních i hustých molekulárních mracích. Aplikací konstant reakční rychlosti ( α , β a γ ) odpovídajících všem aktuálně dostupným charakterizovaným reakcím zahrnujícím H
3Ó+
, je možné vypočítat k ( T ) pro každou z těchto reakcí. Vynásobením těchto k ( T ) relativním množstvím produktů lze určit relativní rychlosti (v cm 3 /s) pro každou reakci při dané teplotě. Tyto relativní sazby lze provést v absolutních sazbách jejich vynásobením [H
2]2
. Za předpokladu, že T = 10 K pro hustý mrak a T = 50 K pro difúzní mrak, výsledky naznačují, že většina dominantních mechanismů tvorby a destrukce byla v obou případech stejná. Je třeba uvést, že relativní abundance použité v těchto výpočtech odpovídají TMC-1, husté molekulární mrak, a že vypočtené relativní míry se proto očekává, že bude přesnější při T = 10 K . Tři nejrychlejší mechanismy vzniku a destrukce jsou uvedeny v tabulce níže spolu s jejich relativní rychlostí. Rychlost těchto šesti reakcí je taková, že za těchto podmínek tvoří přibližně 99% chemických interakcí hydroniových iontů. Všechny tři destrukční mechanismy v níže uvedené tabulce jsou klasifikovány jako disociativní rekombinační reakce.
| Reakce | Typ | Relativní rychlost (cm 3 /s) | |
|---|---|---|---|
| při 10 K. | při 50 K. | ||
|
H 2 + H 2Ó+ → H 3Ó+ + H |
Formace | 2,97 × 10 - 22 | 2,97 × 10 - 22 |
|
H 2O + HCO+ → CO + H 3Ó+ |
Formace | 4,52 x 10 - 23 | 4,52 x 10 - 23 |
|
H+ 3 + H 2O → H 3Ó+ + H 2 |
Formace | 3,75 × 10 - 23 | 3,75 × 10 - 23 |
|
H 3Ó+ + e - → OH + H + H |
Zničení | 2,27 × 10 - 22 | 1,02 × 10 - 22 |
|
H 3Ó+ + e - → H 2O + H |
Zničení | 9,52 × 10 - 23 | 4,26 × 10 - 23 |
|
H 3Ó+ + e - → OH + H 2 |
Zničení | 5,31 x 10 - 23 | 2,37 × 10 - 23 |
Rovněž stojí za zmínku, že relativní rychlosti reakcí tvorby v tabulce výše jsou pro danou reakci při obou teplotách stejné. To je dáno reakčními rychlostními konstantami pro tyto reakce, které mají β a γ konstanty 0, což má za následek k = α, které je nezávislé na teplotě.
Protože všechny tři tyto reakce produkují buď H
2O nebo OH, tyto výsledky posilují silné spojení mezi jejich relativním výskytem a H
3Ó+
. Rychlost těchto šesti reakcí je taková, že za těchto podmínek tvoří přibližně 99% chemických interakcí hydroniových iontů.
Astronomické detekce
Již v roce 1973 a před první mezihvězdnou detekcí předpovídaly chemické modely mezihvězdného média (první odpovídající hustému oblaku), že hydronium je hojný molekulární ion a že hraje důležitou roli v iontově neutrální chemii. Než však mohlo začít astronomické hledání, stále ještě šlo o stanovení spektroskopických znaků hydronia v plynné fázi, které v tomto okamžiku nebyly známy. První studie těchto charakteristik přišly v roce 1977, po kterém následovaly další experimenty se spektroskopií s vyšším rozlišením. Jakmile bylo v laboratoři identifikováno několik linií, byla první mezihvězdná detekce H 3 O + provedena dvěma skupinami téměř současně v roce 1986. První, publikovaná v červnu 1986, hlásila pozorování Jvt
K = 1-
1 - 2+
1 přechod v 307 192 0,41 MHz v OMC-1 a Sgr B2. Druhá, publikovaná v srpnu, hlásila pozorování stejného přechodu směrem k mlhovině Orion-KL.
Tyto první detekce byly následovány pozorováním řady dalších H
3Ó+
přechody. První pozorování každé následné detekce přechodu jsou uvedena níže v chronologickém pořadí:
V roce 1991, 3+
2 - 2-
2 přechod v V OMC-1 a Sgr B2 bylo pozorováno 364 797, 427 MHz . O rok později, 3+
0 - 2-
0 přechod v V několika oblastech bylo pozorováno 396 272, 412 MHz , z nichž nejjasnější byl mrak W3 IRS 5.
První far-IR 4-
3 - 3+
3přechod na 69,524 µm (4,3121 THz) byl proveden v roce 1996 poblíž Orion BN-IRc2. V roce 2001 tři další přechody H
3Ó+
in byly pozorovány v daleko infračerveném spektru ve Sgr B2; 2-
1 - 1+
1 přechod na 100,577 µm (2,98073 THz), 1-
1 - 1+
1 při 181,054 µm (1,65582 THz) a 2-
0 - 1+
0 při 100,869 µm (2,9721 THz).
Viz také
- Hydron (vodíkový kation)
- Hydrid
- Vodíkový aniont
- Vodíkový ion
- Grotthusův mechanismus
- Trifluorooxonium
- Zákon ředění