Metaboritan sodný - Sodium metaborate
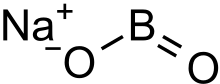
|
|
| Identifikátory | |
|---|---|
|
3D model ( JSmol )
|
|
| Informační karta ECHA |
100,028,992 |
| Číslo ES | |
|
PubChem CID
|
|
| Číslo RTECS | |
|
Řídicí panel CompTox ( EPA )
|
|
|
|
|
|
| Vlastnosti | |
| NaBO 2 | |
| Molární hmotnost | 65,80 g / mol |
| Vzhled | bezbarvé krystaly |
| Zápach | bez zápachu |
| Hustota | 2,464 g / ml (bezvodý) |
| Bod tání | 966 ° C (1771 ° F; 1239 K) |
| Bod varu | 1434 ° C (2613 ° F; 1707 K) |
| 16,4 g / 100 ml (0 ° C) 28,2 g / 100 ml (25 ° C) 125,2 g / 100 ml (100 ° C) |
|
| Rozpustnost | nerozpustný v etheru , ethanolu |
| Struktura | |
| trigonální | |
| Termochemie | |
|
Tepelná kapacita ( C )
|
65,94 J / mol K. |
|
Standardní molární
entropie ( S |
73,39 J / mol K. |
|
Std entalpie
formace (Δ f H ⦵ 298 ) |
-1059 kJ / mol |
| Nebezpečí | |
| Smrtelná dávka nebo koncentrace (LD, LC): | |
|
LD 50 ( střední dávka )
|
2330 mg / kg (potkan, orální) |
|
Není-li uvedeno jinak, jsou uvedeny údaje o materiálech v jejich standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|
| Reference Infoboxu | |
Metaboritan sodný je bezbarvá pevná látka chemická sloučenina ze sodíku , boru a kyslíku s vzorce Nabo
2. Vzorec lze zapsat také jako Na
2O · B
2Ó
3zdůraznit vztah k hlavním oxidům sodíku a boru.
Struktura
Pevný bezvodý metaboritan sodný krystalizuje v hexagonální prostorové skupině. Ve skutečnosti obsahuje trimerní anion [B
3Ó
6]3−
. Šest atomů kyslíku je rovnoměrně rozděleno do dvou odlišných strukturních míst s různými délkami vazeb B – O (přibližně 128 , respektive 143 pm ).
Hydráty a rozpustnost
Následující hydráty krystalizují z roztoků správného složení v různých teplotních rozsazích:
- tetrahydrát NaBO
2· 4 hodiny
2O od -6 do 53,6 ° C - dihydrát NaBO
2· 2 hodiny
2O od 53,6 ° C do 105 ° C - hemihydrát NaBO
2· 0,5 hodiny
2O od 105 ° C do bodu varu.
První zprávy o monohydrátu NaBO
2· H
2O nebyly potvrzeny.
Bezvodá sůl může být připravena z tetraborátu zahřátím na 270 ° C ve vakuu.
Příprava
Metaboritan sodný se připravuje fúzí uhličitanu sodného a oxidu boritého B
2Ó
3nebo borax Na
2B
4Ó
7. Dalším způsobem, jak vytvořit sloučeninu, je fúze boraxu s hydroxidem sodným při 700 ° C:
-
B
2Ó
3+ 2 NaOH → 2 NaBO
2+ H
2Ó
Teplota varu metaboritanu sodného (1434 ° C) je nižší než teplota varu oxidu boritého (1860 ° C) a boraxu (1575 ° C). Ve skutečnosti, zatímco metaboritan vaří beze změny složení, borax vydává páru metaboritanu sodného s malým přebytkem oxidu sodného Na
2O .
Reakce
Elektrochemická přeměna na borax
Elektrolýza koncentrovaného roztoku 20% NaBO
2· 4 hodiny
2O s aniontoměničovou membránou a inertní anodou (jako je zlato , palladium nebo diamant dotovaný bórem ) převádí metaborátový anion na tetraborát B
4Ó2-
7a sodná sůl pozdějšího ( boraxu ) se vysráží jako bílý prášek.
-
BO2-
2+ 2 HODINY-
→ B
4Ó2-
7+ H
2O + 4 e -
Redukce na borohydrid sodný
Metaboritan sodný je také vedlejším produktem hydrolýzy borohydridu sodného NaBH
4, Navrhovaná vodíku úložný materiál pro vodíkem poháněných vozidel , která je bezpečnější (stabilní v suchém vzduchu) a účinnější na hmotnostním základě, než většina jiných alternativ. Reakce je
-
NaBH
4+ 2 H
2O → NaBO
2+ 4 hodiny
2
a vyžaduje katalyzátor .
Aby byl ekonomický, vyžadoval by tento přístup levný a efektivní způsob recyklace metaboritanu na borohydrid. Bylo studováno několik metod, například reakce s různými redukčními činidly při vysokých teplotách a tlaku nebo s hydridem hořečnatým MgH
2které v kulovém mlýnu při teplotě místnosti, a následně extrakcí NaBH
4s isopropylaminem .
-
NaBO
2+ 2 MgH
2→ NaBH
4 + 2 MgO
Další alternativou, která byla zvažována, je elektrolytická redukce koncentrovaného roztoku metaboritanu sodného, a to
-
BO2-
2+ 6 hodin
2O + 8 e - → BH-
4+ 8 HOD-
Tato metoda však není účinná, protože soutěží s redukcí hydroxidu , 4 H O-
→ 2 H
2O + O
2+ 4 e -
Konverze na alkoxidy sodné
Bezvodý metaboritan sodný pod zpětným chladičem s methanolem poskytne odpovídající methoxyborát sodný :
-
Na+
[BO
2]-
+ 4 CH
3OH → Na+
[B (OCH
3)
4]-
+ 2 H
2Ó
Analogickou reakcí s ethanolem se získá ethoxyborát .
Použití
Metaboritan sodný se používá při výrobě borosilikátových skel . Je také součástí herbicidů a nemrznoucích produktů.

