Acetylaceton - Acetylacetone
|
|||
|
|
|||
|
|
|||
| Jména | |||
|---|---|---|---|
|
Preferovaný název IUPAC
Pentan-2,4-dion |
|||
Ostatní jména
|
|||
| Identifikátory | |||
|
3D model ( JSmol )
|
|||
| 741937 | |||
| ČEBI | |||
| CHEMBL | |||
| ChemSpider | |||
| Informační karta ECHA |
100,004,214 |
||
| Číslo ES | |||
| 2537 | |||
| KEGG | |||
|
PubChem CID
|
|||
| Číslo RTECS | |||
| UNII | |||
| UN číslo | 2310 | ||
|
CompTox Dashboard ( EPA )
|
|||
|
|||
|
|||
| Vlastnosti | |||
| C 5 H 8 O 2 | |||
| Molární hmotnost | 100,117 g · mol −1 | ||
| Hustota | 0,975 g/ml | ||
| Bod tání | -23 ° C (-9 ° F, 250 K) | ||
| Bod varu | 140 ° C (284 ° F; 413 K) | ||
| 16 g/100 ml | |||
| -54,88 · 10 −6 cm 3 /mol | |||
| Nebezpečí | |||
| Piktogramy GHS |
   
|
||
| Signální slovo GHS | Nebezpečí | ||
| H226 , H302 , H311 , H320 , H331 , H335 , H341 , H370 , H402 , H412 | |||
| P201 , P202 , P210 , P233 , P240 , P241 , P242 , P243 , P260 , P261 , P264 , P270 , P271 , P273 , P280 , P281 , P301+312 , P302+352 , P303+361+353 , P304+340 , P305+351+338 , P307+311 , P308+313 , P311 , P312 | |||
| NFPA 704 (ohnivý diamant) | |||
| Bod vzplanutí | 34 ° C (93 ° F; 307 K) | ||
| 340 ° C (644 ° F; 613 K) | |||
| Výbušné limity | 2,4–11,6% | ||
|
Pokud není uvedeno jinak, jsou údaje uvedeny pro materiály ve standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|||
|
|
|||
| Reference na infobox | |||
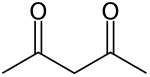
Acetylaceton je organická sloučenina s chemickým vzorcem CH
3COCH
2COCH
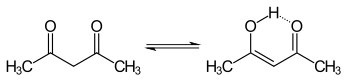
3. Je to bezbarvá kapalina klasifikovaná jako 1,3- diketon . Existuje v rovnováze s tautomerem CH
3C (O) CH = (OH) CH
3. Tyto tautomery se ve většině podmínek mění tak rychle, že jsou ve většině aplikací považovány za jedinou sloučeninu. Je to bezbarvá kapalina, která je předchůdcem acetylacetonátového aniontu (běžně zkráceně acac - ), bidentátního ligandu . Je také stavebním kamenem pro syntézu heterocyklických sloučenin .
Vlastnosti
Tautomerismus
Tyto keto a enol tautomery acetylacetonu koexistují v roztoku. Enol forma má C 2v symetrii , což znamená, že atom vodíku je rovnoměrně rozdělen mezi dva atomy kyslíku. V plynné fázi je rovnovážná konstanta , K keto → enol , 11,7, upřednostňuje enolovou formu. Tyto dvě tautomerní formy lze rozlišit pomocí NMR spektroskopie , IR spektroskopie a dalších metod.
| Solventní | K keto → enol |
|---|---|
| Plynná fáze | 11.7 |
| Cyklohexan | 42 |
| Toluen | 10 |
| THF | 7.2 |
| DMSO | 2 |
| Voda | 0,23 |
Rovnovážná konstanta bývá v nepolárních rozpouštědlech vysoká; keto forma se stává příznivější v polárních rozpouštědlech spojujících vodík, jako je voda. Enol forma je vinylogickým analogem karboxylové kyseliny .
Acidobazické vlastnosti
| solventní | T/° C | p K a |
|---|---|---|
| 40% ethanol /voda | 30 | 9.8 |
| 70% dioxan /voda | 28 | 12.5 |
| 80% DMSO /voda | 25 | 10,16 |
| DMSO | 25 | 13,41 |
Acetylaceton je slabá kyselina :
- C
5H
8Ó
2 ⇌ C.
5H
7Ó-
2 + H+
IUPAC doporučil hodnoty p K a pro tuto rovnováhu ve vodném roztoku při 25 ° C jsou 8,99 ± 0,04 ( I = 0), 8,83 ± 0,02 ( I = 0,1 M NaClO
4) a 9,00 ± 0,03 ( I = 1,0 M NaClO
4; I = iontová síla ). K dispozici jsou hodnoty pro směsná rozpouštědla. Velmi silné báze, jako jsou organolithné sloučeniny, deprotonují acetylaceton dvakrát. Výsledné druhy dilithio pak mohou být alkylovány na C-1.
Příprava
Acetylaceton se průmyslově připravuje tepelným přesmykem isopropenylacetátu .
- CH
2(CH
3) COC (O) Me → MeC (O) CH
2Přijít
Laboratorní cesty k acetylacetonu také začínají acetonem . Aceton a acetanhydrid po přidání fluoridu boritého ( BF
3) katalyzátor:
- (CH
3CO)
2O + CH
3C (O) CH
3 → CH
3C (O) CH
2C (O) CH
3
Druhá syntéza zahrnuje bazicky katalyzovanou kondenzaci acetonu a ethylacetátu , následovanou okyselením:
- NaOEt + EtO
2CCH
3 + CH
3C (O) CH
3 → NaCH
3C (O) CHC (O) CH
3 + 2 EtOH - NaCH
3C (O) CHC (O) CH
3 + HCl → CH
3C (O) CH
2C (O) CH
3 + NaCl
Kvůli snadnosti těchto syntéz je známo mnoho analogů acetylacetonátů. Některé příklady zahrnují C.
6H
5C (O) CH
2C (O) C
6H
5(dbaH) a (CH
3)
3CC (O) CH
2C (O) CC (CH
3)
3. Hexafluoracetylacetonát je také široce používán k vytváření komplexů těkavých kovů.
Reakce
Kondenzace
Acetylaceton je všestranný bifunkční prekurzor heterocyklů, protože obě keto skupiny podléhají kondenzaci . Hydrazin reaguje za vzniku pyrazolů . Močovina dává pyrimidiny . Kondenzací se dvěma aryl- a alkylaminy za vzniku NacNacs , kde jsou atomy kyslíku v acetylacetonu nahrazeny NR (R = aryl, alkyl).
Koordinační chemie

Acetylacetonátový anion , acac - , tvoří komplexy s mnoha ionty přechodných kovů . Obecným způsobem syntézy je zpracování kovové soli acetylacetonem v přítomnosti báze :
- MB
z+ z Hacac ⇌ M (acac)
z+ z BH
Oba atomy kyslíku se vážou na kov a tvoří šestičlenný chelátový kruh. V některých případech je chelátový účinek tak silný, že k vytvoření komplexu není potřeba žádná přidaná báze.
Biodegradace
Enzym acetylaceton dioxygenáza štěpí vazbu uhlík-uhlík acetylacetonu za vzniku acetátu a 2-oxopropanalu . Enzym je závislý na železe (II), ale bylo prokázáno, že se váže i na zinek. Degradace acetylacetonu byla charakterizována u bakterie Acinetobacter johnsonii .
- C
5H
8Ó
2 + O.
2 → C
2H
4Ó
2 + C.
3H
4Ó
2