Azid rubidia - Rubidium azide

|
|
|
|
| Jména | |
|---|---|
|
Název IUPAC
rubidium (1 +); azid
|
|
| Ostatní jména
Azid rubidia
|
|
| Identifikátory | |
|
3D model ( JSmol )
|
|
| ChemSpider | |
|
PubChem CID
|
|
|
Řídicí panel CompTox ( EPA )
|
|
|
|
|
|
| Vlastnosti | |
| RbN 3 | |
| Molární hmotnost | 127,49 g · mol -1 |
| Vzhled | Bezbarvé jehly |
| Hustota | 2,79 g / cm 3 |
| Bod tání | 317–321 ° C (603–610 ° F; 590–594 K) |
| Bod varu | Rozkládá se |
| 107,1 g / 100 g (16 ° C) 114,1 g / 100 g (17 ° C) |
|
| Rozpustnost | 0,182 g / 100 g (16 ° C, ethanol ) |
| Termochemie | |
|
Std entalpie
formace (Δ f H ⦵ 298 ) |
-0,1 kcal · mol −1 |
| Nebezpečí | |
| NFPA 704 (ohnivý diamant) | |
| Související sloučeniny | |
|
Jiné anionty
|
Dusičnan rubidný |
|
Jiné kationty
|
Azid lithný Azid sodný Azid draselný Azid stříbrný Azid amonný |
|
Není-li uvedeno jinak, jsou uvedeny údaje o materiálech v jejich standardním stavu (při 25 ° C [77 ° F], 100 kPa). |
|
| Reference Infoboxu | |
Rubidium azid je anorganická sloučenina se vzorcem Rb N 3 . To je rubidia sůl z azidu iontu ( N -
3 ). Jako většina azidů je výbušný.
Příprava
Azid rubidnatý může být vytvořen reakcí mezi síranem rubidnatým a azidem barnatým, která vede k tvorbě snadno oddělitelného nerozpustného síranu barnatého :
Alespoň v jedné studii byl azid rubidia vyroben reakcí mezi butylnitritem , monohydrátem hydrazinu a hydroxidem rubidia :
Tento vzorec se obvykle používá k syntéze azidu draselného z hydroxidu draselného .
Použití
Azid rubidia byl zkoumán pro možné použití v článcích alkalických par, které jsou složkami atomových hodin , atomových magnetometrů a atomových gyroskopů . Azidy jsou žádoucími výchozími materiály, protože se při vystavení UV záření rozkládají na kov rubidia a plynný dusík . Podle jedné publikace:
Mezi různými technikami používají k vyplnění mikrofabrikovaném buňky alkalických par [sic] , UV rozklad rubidia azid (RBN 3 ) do kovového Rb a dusíku v Al 2 O 3 potažených buněk je velmi slibný přístup pro nízké náklady oplatka úrovni výroby.
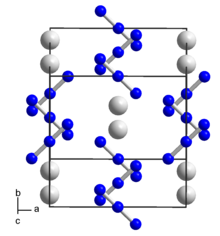
Struktura
Při pokojové teplotě má azid rubidia stejnou strukturu jako fluorovodík draselný ; zkreslená struktura chloridu cesného . Při 315 ° C a 1 atm bude azid rubidia přecházet na normální strukturu chloridu cesného. Teplota přechodu II / I azidu rubidia je do 2 ° C od jeho bodu tání.
Azid rubidia má vysokotlaký strukturní přechod, ke kterému dochází při tlaku přibližně 4,8 kilobarů při teplotě 0 ° C. Hranici přechodu přechodu II / III lze definovat vztahem , kde je tlak v kilobarech a teplota ve stupních Celsia .
Reakce
Stejně jako u všech azidů se rozkládá a uvolňuje plynný dusík, když je zahřátý nebo silně šokován :
Nebezpečí
Při tlaku 4,1 kilobaru a asi 460 ° C se azid rubidia výbušně rozloží. Za normálních okolností exploduje při teplotě 395 ° C. Rozkládá se také při vystavení ultrafialovému světlu .
Azid rubidia je velmi citlivý na mechanické rázy , s citlivostí na nárazy srovnatelnou s citlivostí TNT .
Stejně jako všechny azidy je azid rubidia toxický.
Reference
| HN 3 | On | ||||||||||||||||||
| LiN 3 | Buďte (N 3 ) 2 | B (N 3 ) 3 |
CH 3 N 3 , C (N- 3 ) 4 |
NH 4 N 3 N 3 NO N (N 3 ) 3 , H 2 N-N 3 |
Ó | FN 3 | Ne | ||||||||||||
| NaN 3 | Mg (N 3 ) 2 | Al (N 3 ) 3 | Si (N 3 ), 4 | P | SO 2 (N 3 ) 2 | ClN 3 | Ar | ||||||||||||
| KN 3 | Ca (N 3 ) 2 | Sc (N 3 ) 3 | Ti (N 3 ), 4 | VO (N 3 ) 3 |
Cr (N 3 ) 3 , CrO 2 (N 3 ) 2 |
Mn (N 3 ) 2 |
Fe (N 3 ) 2 , Fe (N 3 ) 3 |
Co (N 3 ) 2 , Co (N 3 ) 3 |
Ni (N 3 ) 2 |
CuN 3 , Cu (N 3 ) 2 |
Zn (N 3 ) 2 | Ga (N 3 ) 3 | Ge | Tak jako | Se (N 3 ) 4 | BrN 3 | Kr | ||
| RbN 3 | Sr (N 3 ) 2 | Y | Zr (N 3 ), 4 | Pozn | Mo | Tc | Ru (N 3 ) 6 3− | Rh (N 3 ) 6 3− | Pd (N 3 ) 2 | AgN 3 | Cd (N 3 ) 2 | v | Sn | Sb | Te | IN 3 | Xe (N 3 ) 2 | ||
| CsN 3 | Ba (N 3 ) 2 | Hf | Ta | Ž | Re | Os | Ir (N 3 ) 6 3− | Pt (N 3 ) 6 2− | Au (N 3 ) 4 - |
Hg 2 (N 3 ) 2 , Hg (N 3 ) 2 |
TlN 3 | Pb (N 3 ) 2 |
Bi (N 3 ) 3 |
Po | Na | Rn | |||
| Fr. | Ra (N 3 ) 2 | Rf | Db | Sg | Bh | Hs | Mt. | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |||
| ↓ | |||||||||||||||||||
| Los Angeles |
Ce (N 3 ) 3 , Ce (N 3 ) 4 |
Pr | Nd | Odpoledne | Sm | Eu | Gd (N 3 ) 3 | Tb | Dy | Ho | Er | Tm | Yb | Lu | |||||
| Ac | Čt | Pa | UO 2 (N 3 ) 2 | Np | Pu | Dopoledne | Cm | Bk | Srov | Es | Fm | Md | Ne | Lr | |||||



![{\ displaystyle {\ ce {C4H9ONO + N2H4 * H2O + RbOH -> [{\ ce {C_2H_5OH}}] RbN3 + C4H9OH + 3H2O}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b58511202f0feb09d210afff08dc3b6bff1bb951)



![{\ displaystyle {\ ce {2RbN3 -> [\ Delta] 2Rb + 3N2}}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/f46a53c26319bb5f2de53fdcc8f256ea03e6e339)