Lymfangioleiomyomatóza - Lymphangioleiomyomatosis
| Lymfangioleiomyomatóza (LAM) | |
|---|---|
| Ostatní jména | lymfangiomyomatóza, LAM |
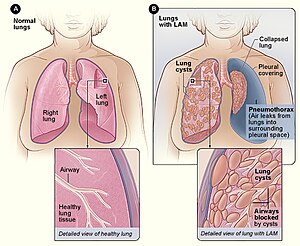 | |
| Obrázek A ukazuje umístění plic a dýchacích cest v těle. Vložený obrázek ukazuje průřez zdravé plíce. Obrázek B ukazuje pohled na plíce s LAM a zhroucenou plící ( pneumotorax ). Vložený obrázek ukazuje řez plic s LAM. | |
| Specialita |
Pulmonologie |
Lymfangioleiomyomatóza ( LAM ) je vzácné, progresivní a systémové onemocnění, které obvykle vede k cystické destrukci plic . Postihuje převážně ženy, zejména v plodném věku. Termín sporadický LAM se používá pro pacienty s LAM, kteří nejsou spojeni s komplexem tuberózní sklerózy (TSC), zatímco TSC-LAM označuje LAM, který je spojen s TSC.
Příznaky a symptomy
Průměrný věk nástupu je od začátku do poloviny 30. let. Exerciální dušnost (dušnost) a spontánní pneumotorax (plicní kolaps) byly hlášeny jako počáteční projev onemocnění u 49%, respektive 46% pacientů.
Diagnóza se obvykle zpožďuje o 5 až 6 let. Tento stav je často chybně diagnostikován jako astma nebo chronická obstrukční plicní nemoc . První pneumotorax neboli kolaps plic předchází diagnostice LAM u 82% pacientů. Konsensuální klinická definice LAM zahrnuje více symptomů:
- Únava
- Kašel
- Vykašlávání krve (zřídka masivní)
- Bolest na hrudi
- Chylové komplikace vyplývající z lymfatické obstrukce, včetně
- Chylothorax
- Chybný ascites
- Chyloperikard
- Chyloptysis
- Chyluria
- Chyle ve vaginálním výtoku
- Chyle ve stolici.
- Angiomyolipomy (mastné nádory ledvin) jsou přítomny asi u 30% pacientů se sporadickou LAM a až u 90% pacientů s TSC-LAM. Angiomyolipomy mohou někdy spontánně krvácet, což způsobuje bolest nebo nízký krevní tlak .
- V retroperitoneu, pánvi nebo mediastinu se mohou objevit cystické lymfangiomy nebo lymfatické uzliny s hypodenzními centry, které napodobují nekrotizující lymfomy, rakoviny vaječníků nebo ledvin nebo jiné malignity.
Destrukce plic u LAM je důsledkem difúzní infiltrace neoplastickými buňkami podobnými hladkým svalům, které napadají všechny plicní struktury včetně lymfatických cest, stěn dýchacích cest, krevních cév a intersticiálních prostor . Mezi důsledky obstrukce cév a dýchacích cest patří akumulace chyózní tekutiny, hemoptýza , obstrukce proudění vzduchu a pneumotorax . Typický průběh onemocnění vykazuje progresivní dušnost při námaze, rozloženou opakujícími se pneumotoraxy a u některých pacientů chyózní pleurální výpotky nebo ascites.
Většina lidí má dušnost při námaze s denními aktivitami do 10 let po nástupu příznaků. Mnoho pacientů vyžaduje v tomto intervalu doplňkový kyslík.
Genetika
LAM se vyskytuje ve dvou prostředích: v komplexu tuberózní sklerózy onemocnění (TSC-LAM) a ve sporadické formě, u žen, které nemají TSC (sporadický LAM). V obou prostředích genetické důkazy naznačují, že LAM je způsobena deaktivací nebo „ztrátou funkce“ mutací v genech TSC1 nebo TSC2, které byly klonovány v letech 1997 a 1993. Gen TSC1 je umístěn na dlouhém rameni chromozomu 9 (9q34) a gen TSC2 je umístěn na krátkém rameni chromozomu 16 (16p13). TSC-LAM se vyskytuje u žen, které mají zárodečné mutace v genu TSC1 nebo TSC2.
Sporadická LAM je primárně spojena se somatickými mutacemi genu TSC2. Zárodečné a somatické mutace v LAM zahrnují mnoho typů mutací rozšířených napříč geny, bez jasných „horkých míst“, včetně změn missense, delecí v rámci a nesmyslných mutací. Kvůli velké velikosti genů (dohromady mají více než 60 exonů) a protože mutace mohou být lokalizovány prakticky kdekoli v genech, detekce mutací je často náročná.
Na buněčné bázi nesou LAM buňky bialelickou inaktivaci genů TSC2, což je v souladu s modelem genu pro supresorový nádor „se dvěma zásahy“. Druhou událostí zásahu do buněk LAM je často ztráta chromozomální oblasti obsahující kopii divokého typu genu TSC2; toto se označuje jako ztráta heterozygotnosti nebo LOH. LOH lze detekovat v mikrodisekovaných LAM buňkách, v angiomyolipomech a lymfatických uzlinách od žen s LAM a v cirkulujících LAM buňkách (buňky v krvi a moči).
Angiomyolipomy a plicní LAM buňky od žen se sporadickou formou LAM nesou identické mutace v TSC2. To spolu se skutečností, že rekurentní LAM po transplantaci plic nese stejné mutace TSC2 jako původní LAM, vedlo k hypotéze „benigních metastáz“, že buňky LAM mohou migrovat nebo metastázovat z jednoho místa na druhé.
Patofyziologie
Variabilní procento buněk v lézi LAM obsahuje mutační inaktivaci nádorových supresorových genů Tuberous Sclerosis Complex (TSC1 nebo TSC2). Mutace TSC1 způsobují méně závažný klinický fenotyp než mutace TSC2. Objev funkce TSC1/2 jako negativního regulátoru savčího cíle rapamycinového komplexu 1 (mTORC1) vedl k úspěšnému použití analogu rapamycinu sirolimu v klinických studiích a schválení sirolimu FDA pro léčbu LAM.
TSC1 a TSC2 tvoří nádorový supresorový komplex, který reguluje savčí cílový signální komplex rapamycinu (mTOR) přímou kontrolou aktivity malé GTPázy Rheb prostřednictvím domény proteinu aktivujícího protein GTPázy (GAP) TSC2. Rheb se váže na Raptor a řídí aktivitu komplexu mTOR 1 (mTORC1), který přímo fosforyluje kinázu p70 S6 (S6K1) a 4E-BP1. mTOR tvoří dva fyzicky a funkčně odlišné multiproteinové komplexy: mTORC1 citlivý na rapamycin a mTORC2 necitlivý na rapamycin. MTORC1 se skládá z pěti proteinů včetně Raptoru, které pozitivně regulují aktivitu mTOR. MTORC2 se skládá ze šesti proteinů včetně mTOR a Rictor , které definují aktivační úroveň mTORC2 a modulují sestavení aktinového cytoskeletu prostřednictvím Rho GTPáz a pro aktivaci mTOR je vyžadován Rac1. V TSC2-nulových a lidských LAM buňkách je aktivita Rho GTPázy vyžadována pro buněčnou adhezi, motilitu, proliferaci a přežití. Ztráta TSC1/TSC2 v LAM indukuje nekontrolovaný růst LAM buněk a zvyšuje životaschopnost LAM buněk. Upregulace STAT1 a STAT3 a autofagie jsou známými mediátory životaschopnosti a přežití LAM buněk.
Buňky LAM se v mnoha ohledech chovají jako metastatické nádorové buňky. Buňky LAM zřejmě pocházejí z mimoplicního zdroje a migrují do plic. Zvýšená migrace a invazivita LAM buněk je zachráněna reexpresí TSC2. Buněčné a molekulární mechanismy neoplastické transformace a destrukce plicního parenchymu buňkami LAM zůstávají neznámé. Remodelace plic může být zprostředkována nerovnováhou mezi matrix degradujícími metaloproteinázami (MMP) a jejich endogenními inhibitory TIMP. Fenotyp invazivních buněk v LAM je spojen s downregulací TIMP-3 a upregulací MMP závislou na TSC2.
Klinické a histopatologické důkazy prokazují lymfatické postižení v LAM. Převládající hypotéza je, že léze LAM vylučují lymfangiogenní faktor VEGF -D, rekrutují lymfatické endoteliální buňky (LEC), které tvoří lymfatické cévy a indukují plicní cysty. Sérové hladiny VEGF-D jsou u LAM zvýšeny ve srovnání s jinými cystickými plicními chorobami, včetně plicní histiocytózy z Langerhansových buněk , emfyzému, Sjögrenova syndromu nebo Birt – Hogg – Dubého syndromu . Hladiny VEGF-D korelují se závažností LAM, hodnocené jako měřítko stupně CT (hojnost chyózních výpotků a lymfatické postižení). VEGF-D je sekretovaný homodimerní glykoprotein a člen rodiny růstových faktorů VEGF. Je známý svou rolí v lymfangiogenezi rakoviny a metastázách . Proteolytické zpracování VEGF-D ovlivňuje příbuznou vazbu na VEGFR3. Histopatologicky jsou léze LAM obklopeny buňkami, které se barví na VEGFR 3, endoteliální receptor 1 hyaluronanu lymfatické cévy (LYVE-1) a podoplanin . VEGF-D se váže na receptorové proteinové tyrosinkinázy VEGFR-2 a VEGFR-349 u lidí a na VEGFR3 u myší. Překvapivě knock-out VEGF-D u myší má malý vliv na vývoj lymfatického systému. Nicméně během tumorigeneze VEGF-D podporuje tvorbu nádorových lymfatických cév a usnadňuje metastatické šíření rakovinných buněk. Málo je však známo o roli abnormálních lymfatických cest a VEGF-D v patogenezi LAM .
Diagnóza
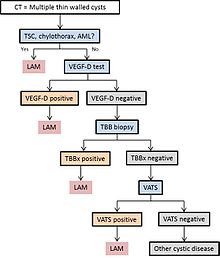
LAM může přijít k lékařské pomoci několika způsoby, z nichž většina spouští CT hrudníku. Tenkostěnnou cystickou změnu v plicích lze mimochodem nalézt na CT vyšetřeních srdce, hrudníku nebo břicha (na řezech, které zahrnují plicní báze) získané pro jiné účely. HRCT pacientů s TSC odhaluje, že asi 20% žen má cystickou změnu do věku 20 let a asi 80% žen má cystické změny po 40. roce věku. LAM je někdy odhalena pomocí CT hrudníku u pacientek, které mají zjevný primární spontánní pneumotorax, ale více často není CT skenování objednáno (ve Spojených státech), dokud nedojde k recidivě. Progresivní dušnost při námaze bez exacerbací a remisí, které jsou charakteristické pro astma nebo CHOPN, někdy vyvolá CT hrudníku. Kontrola CT odborníkem znalým LAM může zvýšit diagnostickou přesnost. Chylothorax může také upozornit na LAM.
V některých případech lze diagnostiku LAM provést s jistotou na klinickém základě (bez biopsie ) u pacientů s typickými cystickými změnami na CT skenování plic s vysokým rozlišením a nálezy tuberózní sklerózy, angiomyolipomu , lymfangioleiomyomu, chylothoraxu nebo sérového VEGF-D> 800 pg/ml.
Pokud není přítomen žádný z těchto klinických příznaků, může být pro stanovení diagnózy nutná biopsie. Video-asistovaná torakoskopická plicní biopsie je nejvíce definitivní technikou, ale transbronchiální biopsie má výtěžek přes 50% a může být také účinná. Bezpečnost posledně uvedeného postupu u pacientů s difúzní cystickou chorobou a hojnost cystických změn, které předpovídají informativní biopsii, však nejsou zcela pochopeny. Diagnostická může být také cytologie chyózních tekutin, odsátých břišních uzlin nebo lymfatických hmot.
Diagram 1 nastiňuje navrhovaný algoritmus pro diagnostiku LAM.
Rentgen hrudníku
Radiologické vyšetření hrudníku se může objevit relativně normální, a to i v pozdní fázi onemocnění, nebo může navrhnout jen hyperinflaci. Jak nemoc postupuje, rentgenový snímek hrudníku často ukazuje difúzní, bilaterální a symetrické retikulonodulární opacity, cysty, bully nebo „voštinový“ (tj. Pseudofibrotický) vzhled. Může být patrný pleurální výpotek a pneumotorax . Zachování plicních objemů za přítomnosti zvýšeného intersticiálního značení je radiografickým znakem LAM, který jej pomáhá odlišit od většiny ostatních intersticiálních plicních onemocnění, u nichž alveolární septální a intersticiální expanze mají tendenci zvyšovat vlastnosti elastického zpětného rázu plic a snižovat plicní objemy.
Počítačová tomografie
S vysokým rozlišením počítačovou tomografii hrudníku skenování (HRCT) je lepší než rentgenovém snímku plic pro detekci cystické parenchymu a je téměř vždy abnormální v době diagnózy, i když radiologické vyšetření hrudníku a plicní hodnocení funkce jsou normální. Typické CT ukazuje difúzní kulaté, dvoustranné, tenkostěnné cysty různých velikostí v průměru od 1 do 45 mm. Počet cyst se u LAM liší od několika po téměř úplnou náhradu normální plicní tkáně. Bohatství cyst bývá u pacientů s TSC-LAM mírnější než S-LAM, což je možná vysvětleno částečně, protože pacienti s TSC-LAM obvykle absolvují dřívější screening. Pleurální výpotky jsou na CT pozorovány u 12% pacientů se S-LAM a 6% pacientů s TSC-LAM. Mezi další CT funkce patří lineární hustota (29%), hilární nebo mediastinální lymfadenopatie (9%), pneumotorax, lymfangiomyom a dilatace hrudního kanálu. Neprůhlednost skelného skla (12%) naznačuje přítomnost intersticiálního edému způsobeného lymfatickou kongescí. U pacientů s TSC může nodulární hustota na HRCT představovat multifokální mikronodulární hyperplazii pneumocytů (MMPH) tvořenou shluky hyperplastických pneumocytů typu II. MMPH může být přítomen u mužů nebo žen s TSC v přítomnosti nebo nepřítomnosti LAM, ale ne u pacientů se S-LAM. MMPH není obvykle spojena s fyziologickými nebo prognostickými důsledky, ale byl hlášen jeden případ respiračního selhání způsobeného MMPH.
Skenování ventilace-perfuze
V jedné studii byly ventilační a perfuzní skeny abnormální u 34 z 35 pacientů s LAM. Nejběžnější abnormalitou byla nespecifická difúzní heterogenita , obvykle hrubě odpovídající. Tito autoři také popsali „neobvyklý“, „skvrnitý vzor“ na perfuzních obrazech u 74% pacientů, který sestával z „malých, často periferních sbírek radioizotopů“.
Pozitronová emisní tomografie
LAM a AML léze typicky nevykazují zvýšené vychytávání 18F-fluorodeoxyglukózy při skenování pomocí pozitronové emisní tomografie (PET). U známých nebo podezřelých případů LAM, u nichž jsou výsledky FDG-PET pozitivní, by proto měly být zváženy jiné neoplazmy (nebo zdroje zánětu).
Zobrazování břicha
Abnormality na břišním zobrazování, jako je renální AML a zvětšené lymfatické struktury, jsou také běžné u LAM. Hustota tuku v ledvinové hmotě je patognomická pro AML. AML jsou častější a častěji bilaterální a velké u pacientů s TSC-LAM než u pacientů s S-LAM. Velikost AML koreluje s prevalencí plicních cyst u pacientů s TSC. Jedna studie CT zobrazila 256 pacientů se S-LAM a 67 s TSC-LAM. Renální AML byly přítomny u 32% pacientů s S-LAM a 93% pacientů s TSC-LAM. Jaterní AML byly přítomny u 2% pacientů s S-LAM a 33% pacientů s TSC-LAM. Ascites byl neobvyklý, pozorovaný u méně než 10% pacientů s LAM. Břišní lymfangiomatóza, často obsahující jak cystické, tak pevné složky, byla pozorována u 29% pacientů se S-LAM a 9% pacientů s TSC-LAM.
Zobrazování centrálního nervového systému
Abnormality centrálního nervového systému, jako jsou kortikální nebo subependymální hlízy a astrocytomy , jsou u pacientů s TSC, včetně pacientů s TSC-LAM, běžné, ale nenacházejí se u žen s S-LAM. Moss a spolupracovníci uvedli, že ženy s S-LAM a TSC-LAM mohou mít zvýšený výskyt meningiomu , ale význam tohoto zjištění byl zpochybněn.
Studie plicních funkcí
Testování plicních funkcí u pacientů s LAM může být normální nebo může odhalit obstrukční, restriktivní nebo smíšené vzorce. Obstrukční fyziologie je nejčastější abnormalitou. Údaje o plicních funkcích kontrolované jakostí byly prospektivně shromážděny registrem NHLBI, pětiletou studií pacientů s LAM v centrech po celých Spojených státech. Spirometrie odhalila obstrukční změny asi u 57% pacientů a normální výsledky u 34%. Omezení, definované jako celková kapacita plic nižší než spodní hranice normálu, bylo pozorováno u 11%. Hyperinflace byla přítomna asi v 6%. Průměrný zbytkový objem byl 125% predikovaného při měření pletyzmografií, ale byl pouze 103% predikovaného stanovení metodami ředění plynem, což naznačuje významné zachycování vzduchu v nekomunikujících vzdušných prostorech. Přibližně 25% pacientů s obstrukční fyziologií může vykazovat bronchodilatační reakci, ale může být méně u závažnější obstrukce. Obstrukční fyziologický defekt u LAM je primárně způsoben obstrukcí proudění vzduchu. Nejčasnější změnou počátečního testování plicních funkcí v různých sériích případů byl abnormální přenos plynu, jak bylo hodnoceno podle difuzní kapacity pro oxid uhelnatý (DLCO), popsaný u 82% až 97% pacientů. Není neobvyklé, že se DLCO sníží v poměru k nucenému exspiračnímu objemu za 1 sekundu (FEV1). Snížení DLCO a zvýšení zbytkového objemu jsou obecně považovány za nejčasnější fyziologické projevy LAM.
Kardiopulmonální cvičební testy u mnohem větší kohorty pacientů s LAM odhalily sníženou maximální spotřebu kyslíku ( VO 2 max ) a anaerobní práh u 217 pacientů. Cvičením vyvolaná hypoxémie byla nalezena i u pacientů, kteří neměli klidové abnormality v FEV1 a DLCO. U většiny pacientů se mělo za to, že cvičení je omezené na ventilaci, kvůli překážce proudění vzduchu a zvýšené ventilaci mrtvého prostoru.
Progrese onemocnění je obvykle doprovázena progresivní obstrukční ventilační vadou. Pokles FEV1 je nejčastěji používaným parametrem pro sledování progrese onemocnění. Přestože se klidová plicní hypertenze zdá být u LAM neobvyklá, plicní arteriální tlak často stoupá s nízkou úrovní cvičení, částečně v souvislosti s hypoxemií. Jedna studie hlásila nárůst intraparenchymových zkratů u dyspneických pacientů s LAM, což může přispět k hypoxémii v klidu a zátěži.
Patologie
Plíce LAM jsou celkově zvětšené a difuzně cystické s rozšířenými vzduchovými prostory o průměru až několik centimetrů. Mikroskopické vyšetření plic odhalí ložiska infiltrace buněk hladkého svalstva plicního parenchymu, dýchacích cest, lymfatických cév a cév spojených s oblastmi tenkostěnné cystické změny. LAM léze často obsahují množství lymfatických kanálů, tvořících anastomozující síť štěrbinovitých prostorů lemovaných endoteliálními buňkami. Buňky LAM obecně rozšiřují intersticiální prostory, aniž by narušovaly tkáňové roviny, ale bylo pozorováno, že napadají dýchací cesty, plicní tepnu, membránu, aortu a retroperitoneální tuk, ničí bronchiální chrupavku a arteriolární stěny a uzavírají lumen plicních arteriol.
V lézi LAM existují dvě hlavní buněčné morfologie: malé vřetenovité buňky a kvádrové epiteloidní buňky. Buňky LAM se pozitivně barví na receptory aktinu hladkého svalstva , vimentinu , desminu a často i estrogenu a progesteronu. Cuboidní buňky v LAM lézích také reagují s monoklonální protilátkou zvanou HMB-45, vyvinutou proti premelanosomálnímu proteinu gp100, enzymu v melanogenetické dráze. Tento imunohistochemický marker je diagnosticky velmi užitečný, protože jiné léze převládající v hladkých svalech v plicích s protilátkou nereagují. Vřetenovité buňky léze LAM jsou častěji proliferující buněčný jaderný antigen pozitivní než kvádrové buňky, což je v souladu s proliferativním fenotypem. Ve srovnání s normálními buňkami hladkého svalstva ve tvaru doutníku obsahují vřetenovité LAM buňky méně hojnou cytoplazmu a jsou méně eozinofilní. Receptory estrogenu a progesteronu jsou také přítomny v lézích LAM, ale ne v sousední normální plicní tkáni. LAM léze exprimují lymfatické markery LYVE-1, PROX1, podoplanin a VEGFR-3. Buňky AML podobné hladkým svalům jsou morfologicky a imunohistochemicky podobné buňkám LAM, včetně reaktivity s protilátkami namířenými proti aktinu, desminu, vimentinu a HMB-45, jakož i estrogenovým a progesteronovým receptorům. Na rozdíl od rozšířených vzdušných prostorů u rozedmy plic mohou být cystické prostory nacházející se v LAM částečně lemovány hyperplastickými buňkami typu II.
Léčba
K stabilizaci poklesu funkce plic je k dispozici lék schválený FDA pro léčbu LAM, inhibitor mTOR sirolimus . Transplantace plic zůstává poslední možností pro pacienty s pokročilým onemocněním.
Pneumotorax
Pneumothorace u pacientů s LAM mají tendenci se opakovat, zejména po konzervativním managementu, jako je pozorování, aspirace nebo jednoduchá torakostomie trubice. U více než 65% pacientů s LAM se v průběhu nemoci vyvinul pneumotorax, v průměru 3,5 pneumotoraxu u těch, kteří mají alespoň jeden pneumotorax. Skupina LAM Foundation Pleural Consensus Group obhajovala použití postupu pleurální symfýzy s prvním pneumotoraxem, vzhledem k větší než 70% pravděpodobnosti recidivy. U pacientů s LAM byla účinná chemická skleróza, mechanická abraze, mastek a pleurektomie, ale mechanická abraze je upřednostňována pro ty, kteří mohou v budoucnu vyžadovat plicní transplantaci. Přibližně polovina pacientů s LAM, kteří podstoupili transplantaci, podstoupila předchozí pleurodézu a více než 75% pacientů mělo předchozí bilaterální pleurodézu . Ačkoli pleurodéza není kontraindikací transplantace, může mít za následek zvýšené perioperační krvácení.
Chylothorax
Chyle obecně nezpůsobuje zánět pleury nebo fibrózu. Malé stabilní chyózní výpotky zřídka vyžadují zásah, jakmile je stanovena diagnóza LAM. Dušnost může vyžadovat opakovanou drenáž. Sirolimus je účinný u chyózních výpotků a většina odborníků se domnívá, že by měl být použit jako první linie terapie. Pro refrakterní výpotky se doporučuje zobrazit zdroj úniku těžkou T2 váženou MRI nebo kontrastní lymfangiografií. Některé úniky jsou přístupné embolizaci prostřednictvím katetrů navlečených z tříselných lymfatických uzlin do hrudního kanálu . Lze uvažovat o ligaci hrudního kanálu, ale protože hrudní výpotky někdy pocházejí z ascitu, který je sifonován do hrudníku měchovým působením hrudníku, je důležité před zvážením této možnosti vyloučit břišní zdroj. Pleurální symfýza může být nutná k prevenci nutričních a lymfocytových nedostatků, které mohou být důsledkem opakovaných odběrů nebo trvalé drenáže. Chemická pleurodéza je obecně účinnou terapií chylothoraxu, stejně jako mechanická abraze a mastek.
Angiomyolipom
Renální angiomyolipomy ( AML ) mohou vyžadovat embolizaci nebo kauterizaci pro kontrolu krvácení, což je komplikace, která je považována za běžnější, když průměr nádoru přesáhne 4 cm. Rozsah aneuryzmatických změn může určovat riziko krvácení. Sériové zobrazení břicha by mělo být provedeno za účelem posouzení velikosti AML v intervalech 6 až 12 měsíců, alespoň dokud nebudou jasné trendy růstu. U velmi velkých nádorů lze uvažovat o částečné resekci šetřící nefron . Nefrektomie je někdy vyžadována u nádorů s intravaskulárním rozšířením nebo z jiných důvodů, ale u AML je zřídka přístupem volby, který lze zvládnout méně invazivními prostředky. Everolimus je schválen americkým Úřadem pro kontrolu potravin a léčiv (FDA) pro léčbu AML.
Lymfangioleiomyom
Lymfangioleiomyomatózy jsou hypodenzní struktury naplněné tekutinou přítomné v retroperitoneálních oblastech břicha a pánve asi u 30% pacientů s LAM. Obecně nevyžadují zásah. Biopsie nebo resekce mohou vést k prodlouženému úniku. Inhibitory mTOR jsou účinné při zmenšování velikosti lymfangioleiomyomatózy a mohou vést k celkovému rozlišení.
Řízení jiné
Léky obsahující estrogen mohou zhoršit LAM a jsou kontraindikovány. Činidla, která antagonizují účinky estrogenu, nebyla prokázána jako účinná pro léčbu, ale nebyly provedeny žádné řádné zkoušky. U pacientů s LAM by měla být zvážena zkouška bronchodilatancií , protože až 17% až 25% má obstrukci průtoku vzduchu reagující na bronchodilatátory . Kyslík by měl být podáván k udržení saturace oxyhemoglobinu na více než 90% odpočinkem, cvičením a spánkem. Kostní denzitometrie by měla být zvážena u všech pacientů, kteří jsou imobilizovaní a/nebo jsou léčeni antiestrogenem, a u pacientů s osteoporózou by měla být zahájena vhodná terapie . Po přirozené nebo indukované menopauze by měla být věnována náležitá pozornost kardiovaskulárnímu zdraví . Očkování proti pneumokokům a chřipce by mělo být aktuální. Zdá se, že plicní rehabilitace je zvláště přínosná u mladých motivovaných pacientů s obstrukčním plicním onemocněním, ale studie hodnotící účinek této intervence na toleranci zátěže, kondici a kvalitu života nebyly provedeny.
Léky
Sirolimus je inhibitor mTOR, který stabilizuje plicní funkce a zlepšuje některá měřítka života u pacientů s LAM. Je schválen FDA pro použití v LAM, na základě výsledků studie Multicenter International LAM Efficiency and Safety of Sirolimus (MILES) Trial. Data MILES podporují použití sirolimu u pacientů s abnormální funkcí plic (tj. FEV1 <70% predikce). Zda přínosy léčby převažují nad riziky u asymptomatických pacientů s LAM s normální funkcí plic, není jasné, ale někteří lékaři zvažují léčbu u klesajících pacientů, kteří se blíží abnormálnímu rozmezí pro FEV1. Sirolimus se také jeví jako účinný při léčbě chyózních výpotků a lymfangioleiomyomatózy. Přínos sirolimu přetrvává pouze po dobu léčby. Bezpečnost dlouhodobé terapie nebyla studována.
Mezi potenciální vedlejší účinky inhibitorů mTOR patří otok kotníků, akné, orální vředy, dyspepsie , průjem, zvýšení hladiny cholesterolu a triglyceridů , hypertenze a bolesti hlavy. Pneumonitida sirolimu a latentní malignita jsou vážnějšími obavami, ale vyskytují se zřídka. Sirolimus brání hojení ran. Je důležité ukončit terapii léčivem na 1–2 týdny před a po volitelných postupech, které vyžadují optimální hojení ran. Musí být přijata opatření, aby se zabránilo dlouhodobému pobytu na slunci kvůli zvýšenému riziku rakoviny kůže .
Léčba dalším inhibitorem mTOR, everolimem , byla hlášena v malé otevřené studii, která byla spojena se zlepšením FEV1 a vzdálenosti šesti minut chůze. Sérové hladiny VEGF-D a kolagenu IV byly sníženy ošetřením. Nežádoucí účinky byly obecně konzistentní s těmi, o nichž je známo, že jsou spojeny s inhibitory mTOR, ačkoli některé byly závažné a zahrnovaly periferní edém , zápal plic, srdeční selhání a infekci Pneumocystis jirovecii . Byly použity eskalační dávky everolimu, až 10 mg denně; vyšší, než se obvykle klinicky používá pro LAM.
Sérová koncentrace VEGF-D je užitečný, prediktivní a prognostický biomarker. Vyšší základní hladiny VEGF-D předpovídají rychlejší progresi onemocnění a robustnější léčebnou odpověď.
Hormonální přístupy k léčbě nebyly nikdy testovány v řádných studiích. Při absenci prokázaného přínosu se terapie progesteronem , agonisty GnRh (např. Leuprorelinem , goserelinem ) a tamoxifenem běžně nedoporučuje. Doxycyklin neměl ve dvojitě zaslepené studii žádný vliv na rychlost poklesu funkce plic.
Sirolimus je často účinný jako léčba první linie chylothoraxu. Pokud i přes léčbu přetrvává chyózní únik nebo akumulace, lze zvážit zobrazování pomocí těžké T2 vážené MRI, MRI lymfangiografie nebo lymfangiografie hrudního kanálu. V refrakterních případech lze zvážit postupy pleurální fúze.
Prognóza
Odhady přežití se liší v závislosti na způsobu prezentace nebo zjišťování a obecně mají tendenci stoupat, pravděpodobně kvůli dřívějšímu rozpoznání prostřednictvím rozšířenějšího používání CT skenování. V nedávném populačním kohortním průzkumu byl medián přežití 29 let. Údaje z dřívějších velkých případů naznačovaly, že 38% až 78% pacientů bylo naživu 8,5 roku od nástupu onemocnění.
U pacientů se obvykle objevuje progresivní obstrukce proudění vzduchu. V kohortě pacientů ve Spojeném království bylo 10 let po nástupu symptomů 55% ze 77 pacientů bez dechu při chůzi po rovné zemi a 10% bylo drženo doma. Průměrná roční míra poklesu FEV1 a DLCO u 275 pacientů studovaných v jediné plicní funkční laboratoři v NHLBI byla 75 ± 9 ml, respektive 0,69 ± 0,07 ml/min/mm Hg. V jiných sériích z Evropy byla míra poklesu FEV1 podstatně vyšší, odhadována přibližně na 100 až 120 ml/rok. Ve studii MILES pacienti ve skupině s placebem ztratili 134 ccm/rok. V těchto studiích existovaly určité důkazy, že rychlost poklesu plicních funkcí koreluje s počátečním DLCO, s menopauzálním stavem a vysokým výchozím VEGF-D.
Odhady mediánu přežití se pohybují od 10 do 30 let v závislosti na tom, zda jsou studovány kohorty založené na hospitalizaci nebo populaci.
Epidemiologie
LAM je téměř úplně omezena na ženy. Zatímco plicní cysty konzistentní s LAM jsou hlášeny u některých mužů s tuberózní sklerózou, jen velmi málo z těchto mužů má příznaky. Prevalence LAM se odhaduje pomocí údajů z registrů a skupin pacientů a pohybuje se mezi 3,4 a 7,8/milion žen. V USA, Velké Británii a Švýcarsku se počet nových případů každý rok pohybuje mezi 0,23 a 0,31/milion žen/rok. Rozdíly mezi zeměmi a mezi sousedními státy v USA naznačují, že značný počet žen s LAM zůstává buď nediagnostikován, nebo jsou jejich příznaky přičítány jiným chorobám. U dospělých žen s tuberózní sklerózou je větší pravděpodobnost vzniku LAM než u žen bez tuberózní sklerózy. Kohorty pacientů s tuberózní sklerózou byly vyšetřeny na LAM pomocí CT skenování. V retrospektivní studii dospělých s tuberózní sklerózou CT prokázalo plicní cysty u 42% z 95 žen a 13% z 91 mužů. Obecně byly plicní cysty větší a četnější u žen než u mužů. V další retrospektivní studii u žen s TSC, které podstoupily CT skenování k detekci LAM, mělo 25% 20letých plicní cysty, zatímco 80% žen ve 40 letech bylo postiženo, což naznačuje, že vývoj LAM je závislý na věku alespoň v LAM související s tuberózní sklerózou. Přestože prevalence tuberózní sklerózy u 1 z 6000 porodů je mnohem větší než u LAM, většina plicních klinik zaznamenává více případů sporadické než tuberózní sklerózy-LAM: pravděpodobně kvůli kombinaci nízkých úrovní screeningu LAM u tuberózní sklerózy a mnoho, absence symptomů.
Jediným známým rizikovým faktorem je ženský sex a tuberózní skleróza. Ačkoli užívání doplňkového estrogenu není spojeno s vývojem LAM, jedna studie naznačila, že užívání antikoncepčních pilulek obsahujících estrogen bylo spojeno s dřívějším nástupem.
Vyskytuje se u více než 30% žen s komplexem tuberózní sklerózy (TSC-LAM), dědičným syndromem, který je spojen se záchvaty , kognitivní poruchou a benigními nádory ve více tkáních. Většina pacientů s LAM, kteří jsou přítomni k lékařskému vyšetření, má sporadickou formu onemocnění (S-LAM), která však není spojena s jinými projevy komplexu tuberózní sklerózy.
Mírné cystické změny konzistentní s LAM byly popsány u 10–15% mužů s TSC, ale symptomatická LAM u mužů je vzácná. Sporadická LAM se vyskytuje výhradně u žen, s jednou dosud publikovanou výjimkou. TSC-LAM i S-LAM jsou spojeny s mutacemi genů tuberózní sklerózy.
Těhotenství
Bylo hlášeno, že těhotenství v některých případech zhoršuje LAM. Riziko však nebylo přísně studováno. V průzkumu 318 pacientek, které uvedly, že měly alespoň jedno těhotenství, reagovalo 163 na druhý průzkum zaměřený na plicní kolaps. Celkem 38 pacientů hlásilo pneumotorax s těhotenstvím, což odpovídá výskytu pneumotoraxu v těhotenství nejméně 10% (38 z 318). U jedné třetiny pacientek vedl pneumotorax během těhotenství k diagnostice LAM. Pneumotoraky byly téměř dvakrát častější vpravo než vlevo a u čtyř žen byl oboustranný spontánní pneumotorax. Většina pneumotorotorů se odehrála během druhého a třetího trimestru. Tato studie a další naznačují, že těhotenství je u pacientek s LAM spojeno s pleurálními komplikacemi. Několik žen se známou diagnózou LAM se rozhodlo otěhotnět a pacientky, u nichž je LAM diagnostikována během těhotenství, mají jen zřídka k dispozici základní testy plicních funkcí, což komplikuje vyřešení této otázky.
Společnost
LAM Foundation byla založena v roce 1995 jako základní organizace, která má poskytovat pacientskou advokacii a financování výzkumu. Dnes nadace LAM poskytuje podporu a vzdělávání ženám s LAM a jejich rodinám, zapojuje lékaře a vědce, aby se i nadále dozvěděli více o této chorobě, a získává finanční prostředky na další studium LAM. Hledá bezpečnou a efektivní léčbu lymfangioleiomyomatózy a nakonec lék. Sídlo společnosti je v Cincinnati, Ohio.
V populární kultuře
V " Lucky Thirteen ", páté epizodě páté sezóny House , byla Spencer (Angela Gots) diagnostikována LAM, ačkoli později bylo zjištěno, že jde o případ Sjögrenova syndromu .
Viz také
Reference
externí odkazy
| Klasifikace | |
|---|---|
| Externí zdroje |