Antagonista receptoru CCR5 - CCR5 receptor antagonist
Antagonisty receptoru CCR5 jsou skupinou malých molekul , které antagonizují na receptor CCR5 . Chemokinů CC motivem receptor CCR5 je zapojen do procesu, ve kterém HIV , virus, který způsobuje AIDS , vstupuje do buněk. Antagonisté tohoto receptoru jsou tedy inhibitory vstupu a mají potenciální terapeutické aplikace při léčbě infekcí HIV.
Životní cyklus HIV představuje potenciální cíle pro lékovou terapii, jedním z nich je cesta vstupu viru. CCR5 a CXCR4 jsou hlavní receptory zapojené do procesu vstupu HIV. Tyto receptory patří do rodiny sedmi transmembránových receptorů spřažených s G-proteiny ( GPCR ) a jsou převážně exprimovány na lidských T-buňkách , dendritických buňkách a makrofágech , Langerhansových buňkách . Hrají důležitou roli jako koreceptory, které HIV typu 1 (HIV-1) používá k připojení k buňkám před virovou fúzí a vstupem do hostitelských buněk. Izoláty HIV lze rozdělit na kmeny R5 a X4. Kmen R5 je, když virus používá koreceptor CCR5 a kmen X4 je, když používá CXCR4. Umístění CCR5 receptorů na buněčném povrchu, velké i malé molekuly, mají potenciál interferovat s CCR5-virovou interakcí a inhibovat virový vstup do lidských buněk.
Dějiny
Od objevení HIV v 80. letech minulého století došlo ve vývoji nových antivirotik k pozoruhodnému pokroku . Spouštěčem objevu antagonistů CCR5 bylo pozorování, že malé procento vysoce rizikových populací vykazovalo buď rezistenci, nebo opožděný vývoj onemocnění. Bylo zjištěno, že tato populace má mutaci (CCR5-Δ32) v genu, který kóduje receptor CCR5, což vede k téměř úplné odolnosti proti infekci HIV-1, a vědci poté objevili klíčovou roli receptorů buněčného povrchu CCR5 a CXCR4 v úspěšném virová fúze a infekce. V roce 1996 bylo prokázáno, že CCR5 slouží jako koreceptor pro nejčastěji přenášené kmeny HIV-1, R5. Tento typ viru převládá v raných stádiích infekce a zůstává dominantní formou u více než 50% pozdních stádií pacientů infikovaných HIV-1, nicméně kmeny R5 se mohou postupem času vyvinout do X4. Tyto informace vedly k vývoji nové třídy léků proti HIV nazývaných antagonisté CCR5.
Mechanismus účinku
HIV vstupuje do hostitelských buněk v krvi připojením se k receptorům na povrchu buňky CD4+ . Virový vstup do buňky CD4+ začíná připojením glykoproteinu R5 HIV-1 120 ( gp120 ) k receptoru CD4+ T-buněk, který produkuje konformační změnu v gp120 a umožňuje mu vázat se na CCR5, čímž spouští glykoprotein 41 ( gp41 ) zprostředkovaná fúze virového obalu s buněčnou membránou a nukleokapsid vstupuje do hostitelské buňky (obrázek 1). Antagonisté CCR5 ko-receptorů zabraňují vstupu HIV-1 do imunitních buněk a jejich infekci blokováním receptoru CCR5 na povrchu buněk. Antagonisté CCR5 s malými molekulami se vážou na hydrofobní kapsu tvořenou transmembránovými šroubovicemi receptoru CCR5. Předpokládá se, že interagují s receptorem alosterickým způsobem, čímž se receptor uzamkne v konformaci, která zakazuje jeho funkci koreceptoru.
Vývoj léčiv
Jak již bylo zmíněno, receptor CCR5 je receptor spojený s G-proteinem (GPCR). Před objevením role CCR5 v infekci HIV mnoho farmaceutických společností již vybudovalo značnou sbírku sloučenin, které se zaměřují na GPCR. Některé z těchto sloučenin by se ukázaly být výchozím bodem pro lékařskou chemii antagonistů CCR5 , ale potřebovaly by optimalizaci pro zlepšení selektivity a účinnosti CCR5 a pro zlepšení farmakokinetických vlastností. Významným problémem byla afinita dostupných screeningových zásahů pro iontový kanál hERG ; inhibice hERG vede k prodloužení QT intervalu , což může zvýšit riziko vzniku fatálních komorových arytmií . Mnoho antagonistů CCR5 bylo studováno farmaceutickými společnostmi, ale jen málo z nich skutečně dosáhlo studií účinnosti u lidí; například AstraZeneca , Novartis , Merck a Takeda použili své sbírky sloučenin zaměřených na GPRC k vývoji silného antagonisty CCR5, ale žádný z nich nedosáhl klinických zkoušek. Tři farmaceutické společnosti soutěžily o to, kdo jako první schválí antagonistu CCR5 s malou molekulou: GlaxoSmithKline (GSK) se sloučeninou aplaviroc , Schering-Plough s vicrivirocem a Pfizer s maravirokem . Všechny sloučeniny prošly klinickými zkouškami na lidech; pouze maravirok byl schválen americkým Úřadem pro kontrolu potravin a léčiv (FDA).
Leronlimab
Leronlimab je humanizovaná monoklonální protilátka zaměřená proti receptoru CCR5 nacházející se na T lymfocytech lidského imunitního systému a mnoha typech rakoviny. Vyšetřuje se jako potenciální terapie při léčbě infekce HIV , reakce štěpu proti hostiteli (NCT02737306) a metastatického rakoviny (NCT03838367). Americký úřad pro kontrolu potravin a léčiv (FDA) určil leronlimab pro zrychlené schválení . V únoru 2008 lék vstoupil do klinických studií fáze 2 a v roce 2015 byla zahájena studie fáze 3. V únoru 2018 společnost CytoDyn Inc oznámila, že primárního cílového parametru bylo dosaženo v pivotní studii kombinované terapie PRO 140 u infekce HIV.
Leronlimab vyvíjí společnost CytoDyn Inc. V květnu 2007 výsledky klinické studie fáze I léku prokázaly „silnou, rychlou, prodlouženou, na dávce závislou, vysoce významnou antivirovou aktivitu“ pro leronlimab. Účastníci ve skupině s nejvyšší dávkou dostávali 5 miligramů na kilogram a vykazovali průměrný pokles virové zátěže o -1,83 log 10 . V průměru byla redukce větší než -1 log 10 na mililitr udržována po dobu dvou až tří týdnů pouze z jediné dávky léčiva. Největší individuální redukce HIV RNA se pohybovala až do -2,5 log 10 u pacientů, kteří dostávali dávky 2 i 5 mg/kg.
Leronlimab je laboratorně vyrobená protilátka, která funguje jako vstupní inhibitor . Leronlimab se váže na receptor CCR5 na buňkách CD4 a interferuje se schopností HIV vstoupit do buňky. Leronlimab, humanizovaná forma protilátky PA14, je monoklonální protilátka CCR5 chemokinového receptoru a může inhibovat CCR5 tropní HIV-1 v koncentracích, které neantagonizují přirozenou aktivitu CCR5 in vitro. Vstup HIV-1 je zprostředkován obalovými glykoproteiny HIV-1 gp120 a gp41. Gp120 bude vázat CD4 a molekulu receptoru CCR5co, a to spustí fúzi virové a buněčné membrány zprostředkovanou gp41. CCR5 je tedy potřebný pro vstup viru a této infekce zdravých buněk. Leronlimab, monoklonální protilátka anti-CCR5, může zabránit vstupu HIV do buňky a zastavit replikaci viru. Zabraňuje vazbě virových buněk na odlišné místo v CCR5 koreceptoru, aniž by zasahovalo do jeho přirozené aktivity. Na rozdíl od jiných vstupních inhibitorů je PRO 140 monoklonální protilátka. Mechanismus inhibice je spíše kompetitivní než alosterický . Jako takový musí být aplikován, aby byl účinný. Jakmile je však PRO 140 v těle, váže se na CCR5 po dobu> 60 dnů, což může umožňovat dávkování tak zřídka jako každý druhý týden. Ve srovnání s vysoce aktivní antiretrovirovou terapií, u které bylo prokázáno, že má u pacientů infikovaných HIV toxicitu související s léčbou, nemá PRO140 žádnou rezistenci ani toxicitu vůči více léčivům.
V únoru 2018 společnost CytoDyn uvedla, že primárního cílového parametru bylo dosaženo v pivotní studii kombinované terapie PRO 140 s infekcí HIV a bude pokračovat dalších 24 týdnů (konec srpna 2018) subkutánními injekcemi PRO 140 týdně a optimalizovaným ART. Zpráva odhaluje, že jedna 350mg subkutánní injekce PRO 140 vedla ke snížení virové zátěže HIV-1 RNA o více než 0,5 logu nebo o 68% během jednoho týdne ve srovnání s těmi, kteří dostali placebo . Výsledky primárního cílového parametru účinnosti byly prezentovány na ASM Microbe 2018. V klíčové studii leronlimabu v kombinaci se standardní antiretrovirovou terapií u pacientů již dříve léčených infekcí HIV dosáhlo 81% pacientů, kteří dokončili studii, potlačení virové zátěže HIV <50 cp /ml. Nedávné schválené léky pro tuto populaci se pohybují od 43% po 24 týdnech do 45% po 48 týdnech s potlačením virové zátěže <50 cp/ml. V březnu 2019 podal CytoDyn u amerického FDA první část BLA pro leronlimab (PRO140) jako kombinovanou terapii s HAART u HIV. V květnu 2020 společnost podala svůj BLA s potenciálním schválením FDA ve 4Q'20. CytoDyn provádí vyšetřovací monoterapeutickou studii leronlimabu (PRO140) na HIV. Pokud by byl úspěšný, jednou týdně podávaný leronlimab by představoval posun paradigmatu v léčbě HIV.
CytoDyn zkoumá použití leronlimabu u různých solidních nádorů. 18. února 2019 společnost CytoDyn oznámila, že zahájí 8 předklinických studií zaměřených na rakovinu melanomu, pankreatu, prsu, prostaty, tlustého střeva, plic, jater a žaludku. To má potenciál vést k 8 klinickým studiím fáze II s leronlimabem v oblasti rakoviny. 23. listopadu 2018 obdržel CytoDyn souhlas FDA s předložením IND a umožnil zahájit klinickou studii fáze Ib/II u pacientů s metastatickým triple-negativním karcinomem prsu (mTNBC). Dne 20. února 2019 společnost CytoDyn oznámila, že leronlimab dokázal po dobu šesti týdnů s leronlimabem snížit o více než 98% výskyt metastáz lidských nádorů prsu v modelu xenoimplantátu myší pro rakovinu. Časová ekvivalence myší 6týdenní studie může být u lidí až 6 let. V květnu 2019 americký Úřad pro kontrolu potravin a léčiv (FDA) udělil zrychlené označení pro leronlimab pro použití v kombinaci s karboplatinou pro léčbu pacientů s CCR5-pozitivním mTNBC. V červenci 2019 společnost CytoDyn oznámila dávkování prvního pacienta s mTNBC za použití ze soucitu. Současně je aktivní studie fáze Ib/II pro pacienty s mTNBC, kteří dosud nebyli léčeni, a očekává špičková data v roce 2020. V případě úspěchu by data od dříve neléčených pacientů s mTNBC mohla sloužit jako základ pro potenciální hledání urychleného schválení FDA v USA.
Studie prokázala, že leronlimab snižuje počet a velikost nových lidských metastáz rakoviny prsu na myším modelu a zmenšuje velikost zavedených metastáz, čímž prodlužuje přežití.
V květnu 2019 zahájila společnost CytoDyn předklinickou studii leronlimabu k prevenci NASH.
Aplaviroc
Aplaviroc pochází ze třídy derivátů spirodiketopiperazinu. Obrázek 2 ukazuje molekulární strukturu hlavní sloučeniny a konečné sloučeniny aplaviroc. Olověná sloučenina vykazovala dobrou účinnost při blokování CCR5 v řadě kmenů R5 HIV a proti kmenům rezistentním vůči více léčivům. Problémem této sloučeniny nebyla její selektivita vůči CCR5, ale orální biologická dostupnost. To vedlo k dalšímu vývoji molekuly a výsledkem byla sloučenina pojmenovaná aplaviroc. Navzdory slibným preklinickým a časným klinickým výsledkům byla bohužel při léčbě naivních a již dříve léčených pacientů pozorována závažná jaterní toxicita, která vedla k přerušení dalšího vývoje aplaviroku.
Vicriviroc
Schering-Plough během screeningu identifikoval aktivní sloučeninu . Obrázek 3 ukazuje molekulární strukturu hlavní sloučeniny, meziproduktu a finální sloučeniny vicriviroc . Sloučenina olova obsahovala piperazinovou lešení a byl silný muskarinový receptor acetylcholinu (M 2 ) antagonisty s mírným CCR5 aktivitou. Změny, které byly provedeny na levé straně hlavní sloučeniny a přidání methylové skupiny na piperazinovou skupinu (( S ) -methylpiperazin) vedly k meziproduktu, který měl dobrou afinitu k receptorům CCR5, ale velmi malou afinitu k muskarinové aktivita však sloučenina vykazovala afinitu k hERG iontovému kanálu. Další rekonstrukce vedla k vývoji finální sloučeniny vicriviroc, když Schering zjistil, že pyridyl N -oxid na meziproduktu může být nahrazen 4,6 -dimethylpyrimidinkarboxamidem. Vicriviroc měl vynikající selektivitu pro receptory CCR5 oproti muskarinové a afinita hERG byla výrazně snížena. Klinická studie fáze I vicrivirocu poskytla slibné výsledky, proto byla zahájena studie fáze II v léčbě naivních pacientů. Studie fáze II byla ukončena, protože ve skupině s vicrivirocem došlo k průlomu viru ve srovnání s kontrolní skupinou . Tyto výsledky naznačovaly, že vicriviroc nebyl účinný v léčbě dosud neléčených pacientů ve srovnání se současnou léčbou. Další klinická studie fáze II byla provedena u pacientů již dříve léčených. Výsledky byly, že vicriviroc měl silnou antivirovou aktivitu, ale mezi účastníky bylo hlášeno pět případů rakoviny , nicméně studie pokračovala, protože chyběla kauzální asociace malignit a vicrivirocu. Na konci roku 2009 společnost uvedla, že vicriviroc vstoupil do studií fáze II v léčbě naivních pacientů a ze studií fáze III u pacientů již dříve léčených.
Maraviroc
Pfizer se při hledání dobrého výchozího bodu pro antagonistu CCR5 s malou molekulou obrátil na vysoce výkonný screening . Jejich screening vyústil ve sloučeninu, která vykazovala slabou afinitu a žádnou antivirovou aktivitu, ale představovala dobrý výchozí bod pro další optimalizaci. Sloučeniny 1–9 v tabulce 1 ukazují vývoj maraviroku v několika krocích. Chemická struktura výchozí molekuly (UK-107 543) je prezentována jako sloučenina 1 . Jejich prvním cílem bylo minimalizovat aktivitu molekuly CYP2D6 a snížit její lipofilitu . Oni nahradili imidazopyridinu s benzimidazolu a benzhydril skupina byla odloženy na benzamidu . Výsledkem byla sloučenina 2 . Tato sloučenina vykazovala dobrou vazebnou účinnost a začátek antivirové aktivity. Další optimalizace vztahu mezi strukturou a aktivitou (SAR) amidové oblasti a identifikace enantiomerní preference vedly ke struktuře cyklobutylamidu ve sloučenině 3 . Problém s aktivitou sloučeniny CYP2D6 byl však stále nepřijatelný, takže museli provést další optimalizaci SAR, která určila, že aminopiperidinovou skupinu může nahradit [3.2.1] -azabicykloamin ( tropan ). Tato změna chemické struktury vedla ke sloučenině 4 . Sloučenina 4 neměla žádnou aktivitu CYP2D6 při zachování vynikající vazebné afinity a antivirové aktivity. Ačkoli sloučenina 4 vykazovala slibné výsledky, prokázala 99% inhibici na hERG iontovém kanálu. Tato inhibice byla nepřijatelná, protože může vést k prodloužení QTc intervalu . Výzkumný tým poté provedl několik úprav, aby zjistil, která část molekuly hrála roli v afinitě hERG. Sloučenina 5 ukazuje analogii, kterou syntetizovali a která obsahovala kyslíkový předmostí v tropanovém kruhu; tato rekonstrukce však neměla vliv na afinitu hERG. Poté se zaměřili na polární povrch v molekule, aby vytočili afinitu hERG. Výsledkem těchto snah byla sloučenina 6 . Tato sloučenina si zachovala požadovanou antivirovou aktivitu a byla selektivní vůči inhibici hERG, ale problémem byla její biologická dostupnost . Snížení lipofilnosti nahrazením benzimidazolové skupiny substituovanou triazolovou skupinou poskytlo sloučeninu 7 . Sloučenina 7 vykazovala významné snížení lipofilnosti a zachovala si antivirovou aktivitu, ale opět se zavedením cyklobutylové skupiny vykazovala sloučenina inhibici hERG. Změna velikosti kruhu ve sloučenině 7 z cyklobutylové jednotky na cyklopentylovou jednotku ve sloučenině 8 vedla k významnému zvýšení antivirové aktivity a ztrátě afinity hERG. Další vývoj vedl k objevu 4,4'-difluorocyklohexylamidu známého také jako maravirok. Maraviroc si zachoval vynikající antivirovou aktivitu a nevykazoval žádnou významnou vazebnou afinitu k hERG. Předpokládalo se, že nedostatek vazebné afinity k hERG je způsoben velkou velikostí cyklohexylové skupiny a vysokou polaritou fluorových substituentů. V srpnu 2007 schválila FDA prvního antagonistu CCR5, maravirok, objeveného a vyvinutého společností Pfizer.
Farmakofor
Prediktivní model farmakoforu byl vyvinut pro velkou sérii antagonistů CCR5 na bázi piperidinu a piperazinu společností Schering -Plough Research Institute. Jejich hypotéza se skládala převážně z pěti znaků, dvou akceptorů vodíkových vazeb, označených C a D na obrázku 4 a tří hydrofobních skupin, A, B a E na obrázku 4. Část B má obvykle základní dusíkovou skupinu. Model byl validován pomocí různorodé sady šesti antagonistů CCR5 od pěti různých farmaceutických společností. Nejlepší model správně předpověděl, že tyto sloučeniny jsou vysoce aktivní. Model je možné použít jako nástroj při virtuálním screeningu nových malomolekulárních antagonistů CCR5 a také k predikci biologických aktivit sloučenin před jejich nákladnou syntézou.
Vazba
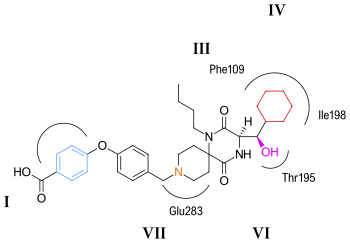
CCR5 je členem receptorů spojených s G proteinem, sedmi transmembránových segmentů. Struktura receptoru obsahuje svazek se sedmi šroubovicemi v transmembránové oblasti, tyto oblasti jsou na obrázcích 5 a 6 označeny I – VII . Předpokládá se, že antagonisté CCR5 se budou vázat na domnělou vazebnou kapsu, která je uložena uvnitř transmembránové domény, uzavřené sedmi transmembránovými helixy. Vázací kapsa je velmi hydrofobní s více aromatickými zbytky lemujícími kapsu. Klíčovými zbytky jsou tryptofan 86 a 248 (Trp86, Trp248), tyrosin 108 a 251 (Tyr108, Tyr251), fenylalanin 109 (Phe109), threonin 195 (Thr195), izoleucin 198 (Ile198), kyselina glutamová 283 (Glu283). Antagonisté CCR5 se velmi liší tvarem a elektrostatickým potenciálem, přestože všichni sdílejí stejnou vazebnou kapsu. Zajímavé na vazbě těchto molekul je, že vykazují výrazně odlišné způsoby vazby, ačkoli všechny vytvářejí rozsáhlou interakční síť s CCR5.
Aplaviroc
Předpokládaný režim vazby pro aplaviroc je znázorněn na obrázku 5 . Předpokládá se, že klíčová interakce mezi solí mostu mezi aplavirocem a Glu283 je ve srovnání s jinými antagonisty CCR5 dosti slabá. Hydroxylová skupina na aplaviroku tvoří silnou vodíkovou vazbu k polárnímu zbytku Thr195. Tato interakce H-vazby je nejsilnější s aplavirocem ve srovnání s jinými antagonisty CCR5. Cyklohexylová skupina v aplavirové struktuře se předpokládá, že bude interagovat s receptorem v hydrofobní kapse tvořené Ile198, Thr195 a Phe109 a předpokládá se, že vykazuje docela silné hydrofobní interakce. Vědci předpovídají, že butylová skupina aplaviroku je pohřbena ve spirálovitém svazku díky silné hydrofobní interakci s více aromatickými zbytky receptoru CCR5. Aplaviroc má jedinečnou vlastnost zachování dvou přírodních ligandů chemokinových proteinů vázajících se na CCR5 a následné aktivace, zatímco maravirok a další antagonisté téměř plně blokují interakce chemokin-CCR5. Tento druh interference je zatím považován za bezpečný a jedinci, kterým přirozeně chybí CCR5, nevykazují žádné zjevné zdravotní problémy. Pro omezení toxicity a vedlejších účinků antagonistů CCR5 by však bylo ideální zachovat funkci chemokinového receptoru. V důsledku toho by mělo být zajímavé navrhnout inhibitory, které specificky narušují vazbu CCR5 – gp120, ale neovlivňují aktivaci chemokinů CCR5.
Maraviroc
Předpokládaný režim vazby pro maravirok je znázorněn na obrázku 6 . Odhaduje se, že nejsilnější interakce je mezi maravirokem a kyselinou glutamovou (Glu283) prostřednictvím silné interakce solného můstku. Interakce mezi tryptofanem (Trp86) a maravirokem zahrnuje stohování π-π ve tvaru T, přičemž se předpokládá, že interakce s fenylalaninem (Phe109) bude hydrofobní. Předpokládá se, že tyrosin (Tyr108) interaguje s fenylovou skupinou na maraviroku prostřednictvím paralelní posunuté interakce. Interakce mezi maravirokem a izoleucinem (Ile198) se předpokládá jako převážně hydrofobní a interakce mezi maravirokem a tyrosinem (Tyr251) je velmi omezená.
Další antagonisté CCR5
Vývoj nových antagonistů CCR5 pokračuje, a to jak pro jejich antivirové účinky, tak pro potenciální využití v různých autoimunitních indikacích. Výzkumníci z Roche Palo Alto objevili novou řadu silných antagonistů CCR5 s malými molekulami. Optimalizace potenciálních zákazníků byla sledována vyvážením protichůdných trendů metabolické stability a účinnosti. Kombinace spiropiperidinového templátu s farmakoforovými prvky jak z aplaviroku, tak Scheringova CCR5 antagonistického programu, vedla k počáteční sloučenině olova v této sérii. Další vývoj této olovnaté sloučeniny vedl k objevu sloučeniny A na obrázku 7 - sloučeniny, která má dobrou selektivitu a farmakokinetické vlastnosti.
Antagonista CCR5 INCB009471 má nanomolární aktivitu proti HIV-1 in vitro . Tato sloučenina vykazovala silnou a prodlouženou antivirovou aktivitu proti R5-tropnímu HIV-1 při podávání dávky 200 mg jednou denně po dobu 14 dnů. Tato zjištění podpořila další klinický vývoj INCB009471 a od té doby pokročila do klinických studií fáze IIb. V roce 2009 je studie této sloučeniny neaktivní a v současné době nejsou plánovány žádné další studie.
Bylo navrženo, aby nejen malé molekuly, ale také proteiny dodávané genovou terapií ablatovaly funkci CCR5, což je přístup, který byl také použit pro jiné cíle HIV.
Viz také
- Cenicriviroc
- CD4
- CCL5
- CCR5
- Podtypy HIV
- HIV tropismus
- Objev a vývoj nenukleosidových inhibitorů reverzní transkriptázy
- Objev a vývoj nukleosidových a nukleotidových inhibitorů reverzní transkriptázy