Claisenova kondenzace - Claisen condensation
| Claisenova kondenzace | |
|---|---|
| Pojmenoval podle | Rainer Ludwig Claisen |
| Typ reakce | Vazební reakce |
| Identifikátory | |
| Portál organické chemie | Claisenova kondenzace |
| RSC ontologické ID | RXNO: 0000043 |
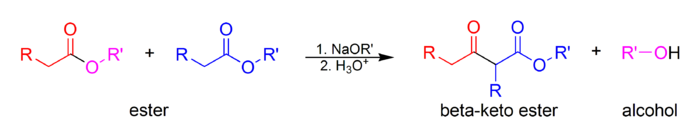
Claisenova kondenzace je vazba uhlík-uhlík tvořící reakce , která probíhá mezi dvěma estery nebo jeden ester a další karbonylovou sloučeninou v přítomnosti silné báze , což vede k β-keto ester nebo p- diketonu . Je pojmenována po Rainerovi Ludwigovi Claisenovi , který poprvé publikoval svou práci o reakci v roce 1887.
Požadavky
Alespoň jedno z činidel musí být enolizovatelné (mít a-proton a být schopné podstoupit deprotonaci za vzniku enolátového aniontu ). Existuje celá řada různých kombinací enolizovatelných a neenolizovatelných karbonylových sloučenin, které tvoří několik různých typů Claisen.
Použitá báze nesmí interferovat s reakcí podstoupením nukleofilní substituce nebo adice karbonylovým uhlíkem. Z tohoto důvodu se často používá konjugovaná báze alkoxidu sodného vzniklého alkoholu (např. Ethoxid sodný, pokud se tvoří ethanol ), protože se alkoxid regeneruje. Ve smíšených Claisenových kondenzacích lze použít nenukleofilní bázi , jako je lithiumdiisopropylamid nebo LDA, protože pouze jedna sloučenina je enolizovatelná. LDA se běžně nepoužívá v klasických kondenzacích Claisen nebo Dieckmann kvůli enolizaci elektrofilního esteru.
Alkoxy část esteru musí být relativně dobrá odstupující skupina . Obvykle se používají methylester a ethylester , který poskytuje methoxid a ethoxid.
Typy
- Klasická Claisenova kondenzace, autokondenzace mezi dvěma molekulami sloučeniny obsahující enolizovatelný ester.
- Smíšená (nebo „zkřížená“) Claisenova kondenzace, při které se použije jeden enolizovatelný ester nebo keton a jeden neenolizovatelný ester.
- Dieckmann kondenzace , kde molekula se dvěma esterovými skupinami reaguje intramolekulárně , tvořící cyklickou β-keto ester. V tomto případě nesmí být vytvořený kruh napnutý , obvykle 5- nebo 6-členný řetěz nebo kruh.
Mechanismus
V prvním kroku mechanismu je α-proton odstraněn silnou bází, což vede k tvorbě enolátového aniontu, který je relativně stabilní delokalizací elektronů. Dále je karbonylový uhlík (druhého) esteru nukleofilně napaden enolátovým aniontem. Alkoxyskupina je poté odstraněna (což vede k (opětovné) tvorbě alkoxidu) a alkoxid odstraní nově vytvořený dvojnásobně a-proton za vzniku nového vysoce rezonančně stabilizovaného enolátového aniontu. V závěrečném kroku se přidá vodná kyselina (např. Kyselina sírová nebo kyselina fosforečná ), aby se neutralizoval enolát a jakákoli ještě přítomná báze. Poté se izoluje nově vytvořený β-ketoester nebo β-diketon. Všimněte si, že reakce vyžaduje stechiometrické množství báze, protože odstranění dvojnásobně a-protonu termodynamicky řídí jinak endergonickou reakci. To znamená, že Claisenova kondenzace nefunguje se substráty, které mají pouze jeden a-vodík, protože v posledním kroku působí hnací síla deprotonace β-ketoesteru.
|
| animace |
Stobbeho kondenzace
Kondenzace Stobbe je modifikací specifická pro diethyl esteru z kyseliny jantarové , vyžadující méně silné báze. Příkladem je jeho reakce s benzofenonem :
Reakční mechanismus , který vysvětluje tvorbu jak esterovou skupinu a karboxylovou skupinu je zaměřena na laktonu meziproduktu ( 5 ):
Stobbeho kondenzace byla použita v prvním kroku Reinharda Sargesova syntézy tametralinu a může být také použita při syntéze dimefadanu .
Viz také
Reference
externí odkazy
- "Claisenova kondenzace" . Portál organické chemie.