Změna čísla kopie - Copy number variation

Variace počtu kopií ( CNV ) je jev, při kterém se úseky genomu opakují a počet opakování v genomu se mezi jednotlivci liší. Variace počtu kopií je typ strukturální variace : konkrétně je to typ události duplikace nebo odstranění, která ovlivňuje značný počet párů bází. Přibližně dvě třetiny celého lidského genomu mohou být složeny z opakování a 4,8–9,5% lidského genomu lze klasifikovat jako variace počtu kopií. U savců hrají variace počtu kopií důležitou roli při vytváření nezbytných variací v populaci i fenotypu onemocnění.
Variace počtu kopií lze obecně rozdělit do dvou hlavních skupin: krátká opakování a dlouhá opakování. Mezi těmito dvěma skupinami však neexistují jasné hranice a klasifikace závisí na povaze zájmových míst . Krátké repetice zahrnují hlavně dinukleotidové repetice (dva opakující se nukleotidy např. ACACAC ...) a trinukleotidové repetice. Dlouhé opakování zahrnuje opakování celých genů. Tato klasifikace založená na velikosti opakování je nejzjevnějším typem klasifikace, protože velikost je důležitým faktorem při zkoumání typů mechanismů, které s největší pravděpodobností způsobily opakování, a tedy pravděpodobné účinky těchto opakování na fenotyp.
Typy a chromozomální přestavby
Jedním z nejznámějších příkladů variací počtu krátkých kopií je trinukleotidové opakování párů bází CAG v genu huntingtin odpovědném za neurologickou poruchu Huntingtonova choroba . V tomto konkrétním případě, jakmile se trinukleotid CAG opakuje více než 36krát v expanzi opakování trinukleotidů , Huntingtonova choroba se pravděpodobně u jednotlivce vyvine a pravděpodobně bude zděděna jeho potomkem. Počet opakování trinukleotidu CAG koreluje s věkem nástupu Huntingtonovy choroby. Tyto typy krátkých opakování jsou často považovány za důsledek chyb v polymerázové aktivitě během replikace, včetně skluzu polymerázy, přepínání šablon a přepínání vidlic, které budou podrobně diskutovány později. Krátká velikost opakování těchto variací počtu kopií se hodí k chybám v polymeráze, protože tyto opakované oblasti jsou náchylné k nesprávnému rozpoznání polymerázou a replikované oblasti mohou být replikovány znovu, což vede k extra kopiím opakování. Kromě toho, pokud jsou tyto trinukleotidové opakování ve stejném čtecím rámci v kódující části genu, může to vést k dlouhému řetězci stejné aminokyseliny , což může v buňce vytvářet agregáty proteinů , a pokud tato krátká opakování spadají do nekódující část genu, může to ovlivnit genovou expresi a regulaci. Na druhé straně je v genomu méně často identifikován variabilní počet opakování celých genů. Jedním příkladem opakování celého genu je gen alfa-amylázy 1 (AMY1), který kóduje alfa-amylázu, která má významnou změnu počtu kopií mezi různými populacemi s různými dietami. Ačkoli specifický mechanismus, který umožňuje genu AMY1 zvýšit nebo snížit počet kopií, je stále předmětem diskuse, některé hypotézy naznačují, že nehomologní spojení konce nebo spojení konce zprostředkované mikrohomologií je pravděpodobně zodpovědné za celá tato genová opakování. Opakování celých genů má okamžité účinky na expresi tohoto konkrétního genu a skutečnost, že variace počtu kopií genu AMY1 souvisí s dietou, je pozoruhodným příkladem nedávné evoluční adaptace člověka. Ačkoli se jedná o obecné skupiny, do kterých jsou seskupeny variace počtu kopií, přesný počet změn počtu kopií párů bází závisí na konkrétních požadovaných lokusech. V současné době je při použití údajů ze všech hlášených variant počtu kopií průměrná velikost varianty počtu kopií přibližně 118 kB a medián přibližně 18 kB.
Pokud jde o strukturální architekturu variací počtu kopií, výzkum navrhl a definoval oblasti hotspotů v genomu, kde jsou variace počtu kopií čtyřikrát více obohaceny. Tyto oblasti hotspotů byly definovány jako oblasti obsahující dlouhé opakování, které jsou 90–100% podobné, známé jako segmentové duplikace buď tandemové nebo proložené, a co je nejdůležitější, tyto oblasti hotspotů mají zvýšenou míru chromozomálního přeskupení . Předpokládalo se, že tyto rozsáhlé chromozomální přesmyky způsobují normální variace a genetická onemocnění , včetně variací počtu kopií. Kromě toho jsou tyto hotspoty s variací počtu kopií konzistentní v mnoha populacích z různých kontinentů, což znamená, že tyto hotspoty byly buď získány nezávisle všemi populacemi a předávány generacemi, nebo byly získány v rané evoluci člověka před rozdělením populací spíše. Nakonec se zdá, že se v genomu nevyskytují prostorové zkreslení místa, kde jsou variace počtu kopií nejhustěji distribuovány. Ačkoli to bylo původně detekováno fluorescenční in situ hybridizací a mikrosatelitní analýzou, že počet kopií opakování je lokalizován do oblastí, které jsou vysoce repetitivní, jako jsou telomery , centromery a heterochromatin , nedávné studie celého genomu dospěly k závěru jinak. Jmenovitě, subtelomeric regiony a pericentromeric regiony jsou místa, kde se nacházejí většina chromozomální přeskupené hotspotů, a neexistuje žádný výrazný nárůst počtu kopií změny v této oblasti. Kromě toho tyto oblasti hotspotů chromozomálního přesmyku nemají snížený počet genů, což opět znamená, že existuje minimální prostorová předpojatost genomického umístění variací počtu kopií.
Detekce a identifikace
Variace počtu kopií se původně předpokládala, že zabírá extrémně malou a zanedbatelnou část genomu prostřednictvím cytogenetických pozorování. Variace počtu kopií byly obecně spojeny pouze s malými tandemovými opakováními nebo specifickými genetickými poruchami, proto byly variace počtu kopií zpočátku zkoumány pouze z hlediska specifických lokusů. Technologický vývoj však vedl ke zvýšení počtu vysoce přesných způsobů identifikace a studia variací počtu kopií. Variace počtu kopií byly původně studovány cytogenetickými technikami, což jsou techniky, které umožňují pozorovat fyzickou strukturu chromozomu. Jednou z těchto technik je fluorescenční in situ hybridizace (FISH), která zahrnuje vložení fluorescenčních sond, které pro vazbu vyžadují vysoký stupeň komplementarity v genomu. Srovnávací genomová hybridizace byla také běžně používána k detekci variací počtu kopií vizualizací fluoroforu a poté porovnáváním délky chromozomů. Jednou hlavní nevýhodou těchto raných technik je, že genomové rozlišení je relativně nízké a lze detekovat pouze velká opakování, jako jsou opakování celých genů.
Nedávné pokroky v genomických technologiích daly vzniknout mnoha důležitým metodám, které mají extrémně vysoké genomové rozlišení, a v důsledku toho byl hlášen rostoucí počet variací počtu kopií v genomu. Zpočátku tyto pokroky zahrnovaly použití pole bakteriálních umělých chromozomů (BAC) s přibližně 1 megabázou intervalů v celém genu, BAC mohou také detekovat variace počtu kopií v hotspotech přeskupení, což umožňuje detekci 119 nových variací počtu kopií. Vysoce výkonné sekvenování genomů přineslo revoluci v oblasti lidské genomiky a in silico byly provedeny studie k detekci variací počtu kopií v genomu. Referenční sekvence byly porovnány s jinými sledovanými sekvencemi pomocí fosmidů přísnou kontrolou fosmidových klonů na 40 kB. Sekvenování koncových čtení by poskytlo adekvátní informace pro zarovnání referenční sekvence s požadovanou sekvencí, a jakékoli nesouososti jsou snadno patrné, takže se dospělo k závěru, že jde o variace počtu kopií v této oblasti klonu. Tento typ detekční techniky nabízí vysoké genomové rozlišení a přesné umístění repetice v genomu a může také detekovat jiné typy strukturálních variací, jako jsou inverze.
Kromě toho je dalším způsobem detekce variace počtu kopií použití jednonukleotidových polymorfismů (SNP). Vzhledem k hojnosti dat o lidském SNP se směr detekce variace počtu kopií změnil k využití těchto SNP. Spoléhání se na skutečnost, že lidská rekombinace je relativně vzácná a že mnoho rekombinačních událostí se vyskytuje ve specifických oblastech genomu známých jako rekombinační hotspoty, lze k identifikaci variací počtu kopií použít vazebnou nerovnováhu . Bylo vyvinuto úsilí při asociaci variací počtu kopií se specifickými haplotypovými SNP analýzou vazebné nerovnováhy, pomocí těchto asociací je člověk schopen rozpoznat variace počtu kopií v genomu pomocí SNP jako markerů. Techniky sekvenování nové generace, včetně sekvenování krátkého a dlouhého čtení, se dnes stále více používají a začaly nahrazovat techniky založené na poli k detekci variací počtu kopií. Na rozdíl od technik založených na poli, detekční metody založené na sekvenování snadno identifikují další třídy strukturálních variací, jako jsou inverze a translokace .
Molekulární mechanismus
Existují dva hlavní typy molekulárních mechanismů pro tvorbu variací počtu kopií: homologní a nehomologické. Ačkoli bylo předloženo mnoho návrhů, většina z těchto teorií jsou spekulace a dohady. Neexistuje žádný přesvědčivý důkaz, který by koreloval změnu konkrétního počtu kopií s konkrétním mechanismem.
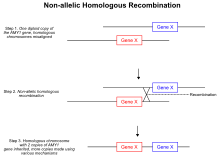
Jednou z nejuznávanějších teorií, které vedou k variacím počtu kopií, stejně jako k delecím a inverzím, jsou neallelické homologní rekombinace . Během meiotické rekombinace se homologní chromozomy spárují a tvoří dva zakončené dvouvláknové zlomy vedoucí k Hollidayovým spojům . V aberantním mechanismu jsou však během tvorby Hollidayových spojů dvojřetězcové zlomy špatně zarovnané a crossover přistává v nealelických polohách na stejném chromozomu. Když je Hollidayovo spojení vyřešeno, nerovné překračování umožňuje přenos genetického materiálu mezi dvěma homologními chromozomy a v důsledku toho se část DNA na obou homologech opakuje. Protože se opakované oblasti již samostatně nerozdělují , je duplikovaná oblast chromozomu zděděna. Jiný typ mechanismu založeného na homologní rekombinaci, který může vést ke kolísání počtu kopií, je známý jako přestávka indukovaná replikace. Když v genomu neočekávaně dojde k dvouvláknovému zlomu, buňka aktivuje dráhy, které zprostředkovávají opravu přerušení. Chyby při opravě zlomu, podobné nealelické homologní rekombinaci, mohou vést ke zvýšení počtu kopií konkrétní oblasti genomu. Během opravy dvouvláknového zlomu může zlomený konec napadnout jeho homologní chromozom, místo aby se znovu připojil k původnímu řetězci. Stejně jako v nealelickém homologním rekombinačním mechanismu je extra kopie konkrétní oblasti přenesena do jiného chromozomu, což vede k duplikaci. Kromě toho se zjistilo , že kohezinové proteiny pomáhají v opravném systému dvojvláknových zlomů sevřením dvou konců v těsné blízkosti, což zabraňuje interchromozomální invazi konců. Pokud je z jakéhokoli důvodu, jako je aktivace ribozomální RNA , ovlivněna aktivita kohezinu, pak může dojít k lokálnímu zvýšení chyb při opravách dvouřetězcových zlomů.
Další třída možných mechanismů, u nichž se předpokládá, že povedou ke změnám počtu kopií, je nehomologní. Aby bylo možné rozlišovat mezi tímto a homologním mechanismem, je třeba porozumět pojmu homologie. Homologní párování chromozomů zahrnující použití řetězců DNA, které jsou si navzájem velmi podobné (~ 97%) a tato vlákna musí být delší než určitá délka, aby se zabránilo krátkým, ale velmi podobným párováním. Nehomologní párování, na druhé straně, závisí pouze na několika párech bází podobnosti mezi dvěma vlákny, proto je možné, aby byly genetické materiály vyměňovány nebo duplikovány v procesu nehomologních dvouřetězcových oprav.
Jedním typem mechanismu založeného na nehomologii je mechanismus spojování nehomologního konce nebo mikrohomologického spojování konce . Tyto mechanismy se také podílejí na opravách dvouvláknových zlomů, ale nevyžadují žádnou homologii ani omezenou mikrohomologii. Když jsou tato vlákna opravena, často se do opraveného vlákna přidají malá delece nebo inzerce. Je možné, že retrotranspozony jsou vloženy do genomu prostřednictvím tohoto opravného systému. Pokud jsou retrotranspozony vloženy do nealelické polohy na chromozomu, meiotická rekombinace může řídit inzerci, která má být rekombinována do stejného řetězce jako již existující kopie stejné oblasti. Dalším mechanismem je cyklus lámání-fúze-můstku, který zahrnuje sesterské chromatidy , které obě ztratily svou telomerickou oblast v důsledku dvouvláknových zlomů. Navrhuje se, aby se tyto sesterské chromatidy spojily a vytvořily jeden dicentrický chromozom a poté se rozdělily do dvou různých jader. Vzhledem k tomu, že odtržení dicentrického chromozomu od sebe způsobí dvouvláknový zlom, mohou se koncové oblasti spojit s dalšími dvouvláknovými zlomy a cyklus opakovat. Fúze dvou sesterských chromatidů může způsobit obrácenou duplikaci a když se tyto události opakují v průběhu cyklu, bude se invertovaná oblast opakovat, což povede ke zvýšení počtu kopií. Posledním mechanismem, který může vést ke změnám počtu kopií, je skluz polymerázy, který je také známý jako přepínání šablon. Během normální replikace DNA je polymeráza na zaostávajícím řetězci povinna kontinuálně uvolňovat a znovu upínat oblast replikace. Pokud již v sekvenci DNA existují opakování v malém měřítku, může být polymeráza „zmatena“, když se znovu upne, aby pokračovala v replikaci, a místo upnutí na správné páry bází může posunout několik párů bází a replikovat část opakovaných region znovu. Všimněte si, že ačkoli to bylo experimentálně pozorováno a je to široce přijímaný mechanismus, molekulární interakce, které vedly k této chybě, zůstávají neznámé. Navíc, protože tento typ mechanismu vyžaduje, aby polymeráza přeskočila kolem řetězce DNA, a je nepravděpodobné, že by se polymeráza mohla znovu upnout na jiném místě vzdáleném několik kilobáz, proto je to vhodnější pro krátké opakování, jako jsou dinukleotidové nebo trinukleotidové opakování.
Gen alfa-amylázy
Amyláza je enzym ve slinách, který je zodpovědný za štěpení škrobu na monosacharidy a jeden typ amylázy je kódován genem alfa-amylázy (AMY1). Lokus AMY1, stejně jako enzym amyláza, je jedním z nejrozsáhleji studovaných a sekvenovaných genů v lidském genomu. Jeho homology se nacházejí také u jiných primátů, a proto je pravděpodobné, že gen AMY1 primáta je předkem lidského genu AMY1 a byl adaptován na počátku evoluce primátů. AMY1 je jedním z nejlépe prozkoumaných genů, který má široký rozsah variabilního počtu kopií v různých lidských populacích. Gen AMY1 je také jedním z mála genů, které byly studovány a které prokázaly přesvědčivé důkazy, které korelují jeho funkci s počtem kopií. Je známo, že počet kopií mění transkripci i úrovně translace konkrétního genu, výzkum však ukázal, že vztah mezi hladinami proteinů a počtem kopií je variabilní. V genech AMY1 evropských Američanů se zjistilo, že koncentrace slinné amylázy úzce souvisí s počtem kopií genu AMY1. V důsledku toho se předpokládalo, že počet kopií genu AMY1 úzce souvisí s jeho proteinovou funkcí, kterou je štěpení škrobu.
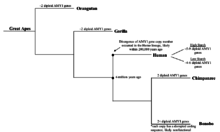
Bylo zjištěno, že počet kopií genu AMY1 koreluje s různými hladinami škrobu ve stravě různých populací. 8 Populace z různých kontinentů byly rozděleny do diet s vysokým obsahem škrobu a s nízkým obsahem škrobu a jejich počet kopií genu AMY1 byl vizualizován pomocí FISH a qPCR s vysokým rozlišením . Bylo zjištěno, že populace s vysokou škrobovou dietou, která se skládá z japonské, hadzské a evropské americké populace, mají výrazně vyšší (2krát vyšší) průměrný počet kopií AMY1 než populace s nízkým obsahem škrobu, včetně populací Biaka, Mbuti, Datog a Yakut. Předpokládalo se, že hladiny škrobu v běžné stravě člověka, substrátu pro AMY1, mohou přímo ovlivnit počet kopií genu AMY1. Protože byl učiněn závěr, že počet kopií AMY1 přímo koreluje se slinnou amylázou, čím více škrobu je přítomno v každodenní stravě populace, tím je evolučně příznivější mít více kopií genu AMY1. Gen AMY1 byl prvním genem, který poskytl silný důkaz evoluce na úrovni molekulární genetiky . Navíc pomocí srovnávací genomové hybridizace byly porovnány variace počtu kopií celých genomů japonské populace s populací Jakutů. Bylo zjištěno, že variace počtu kopií genu AMY1 byla významně odlišná od variace počtu kopií v jiných genech nebo oblastech genomu, což naznačuje, že gen AMY1 byl pod silným selektivním tlakem, který měl malý nebo žádný vliv na druhou kopii početní variace. Nakonec byla variabilita délky 783 mikrosatelitů mezi těmito dvěma populacemi porovnána s variabilitou počtu kopií genu AMY1. Bylo zjištěno, že rozsah počtu kopií genu AMY1 byl větší než u více než 97% zkoumaných mikrosatelitů. To znamená, že přirozený výběr hrál významnou roli při utváření průměrného počtu genů AMY1 v těchto dvou populacích. Jelikož však bylo studováno pouze 6 populací, je důležité vzít v úvahu možnost, že v jejich stravě nebo kultuře mohou existovat další faktory, které ovlivňují počet kopií AMY1 jiný než škrob.
Ačkoli není jasné, kdy se počet kopií genu AMY1 začal zvyšovat, je známo a potvrzeno, že gen AMY1 existoval u raných primátů. U šimpanzů , nejbližších evolučních příbuzných lidí, bylo zjištěno, že mají 2 diploidní kopie genu AMY1, jejichž délka je identická s lidským genem AMY1, což je významně méně než u lidí. Na druhé straně bylo zjištěno , že bonobové , také blízcí příbuzní moderních lidí, mají více než 2 diploidní kopie genu AMY1. Geny bonobo AMY1 byly nicméně sekvenovány a analyzovány a bylo zjištěno, že kódující sekvence genů AMY1 narušují, což může vést k produkci nefunkční slinné amylázy. Z výsledků lze odvodit, že zvýšení počtu kopií bonobo AMY1 pravděpodobně nesouvisí s množstvím škrobu v jejich stravě. Dále se předpokládalo, že nárůst počtu kopií začal nedávno během raného vývoje homininu, protože žádný z lidoopů neměl více než dvě kopie genu AMY1, který produkoval funkční protein. Kromě toho se spekulovalo, že nárůst počtu kopií AMY1 začal přibližně před 20 000 lety, když se lidé přesunuli od životního stylu lovců a sběračů k zemědělským společnostem, což bylo také tehdy, když se lidé ve velké míře spoléhali na kořenovou zeleninu s vysokým obsahem škrobu. Tato hypotéza, i když je logická, postrádá experimentální důkazy kvůli obtížím při shromažďování informací o posunu lidské stravy, zejména o kořenové zelenině s vysokým obsahem škrobu, protože ji nelze přímo pozorovat ani testovat. Nedávné průlomy v sekvenování DNA umožnily výzkumníkům do určité míry přesnosti sekvenovat starší DNA, jako je neandertálci . Sekvenování neandertálské DNA může poskytnout časový ukazatel, kdy se počet kopií genu AMY1 zvýšil, a nabídnout vhled do lidské stravy a evoluce genů.
V současné době není známo, který mechanismus vedl k počáteční duplikaci genu amylázy, a může to znamenat, že vložení retrovirových sekvencí bylo způsobeno nehomologním spojením konce, což způsobilo duplikaci genu AMY1. V současné době však neexistují žádné důkazy, které by tuto teorii podporovaly, a proto tato hypotéza zůstává dohadem. Nedávný původ genu AMY1 s více kopiemi naznačuje, že v závislosti na prostředí se počet kopií genu AMY1 může velmi rychle zvyšovat a snižovat ve srovnání s geny, které s prostředím neinteragují přímo. Gen AMY1 je vynikajícím příkladem toho, jak dávkování genu ovlivňuje přežití organismu v daném prostředí. Vícenásobné kopie genu AMY1 poskytují těm, kteří se více spoléhají na diety s vysokým obsahem škrobu, evoluční výhodu, a proto vysoký počet kopií genů v populaci přetrvává.
Mozkové buňky
Mezi neurony v lidském mozku jsou časté somaticky odvozené změny počtu kopií. Variace počtu kopií vykazují širokou variabilitu (9 až 100% mozkových neuronů v různých studiích). Většina změn je mezi 2 a 10 Mb s delecemi, které daleko převyšují zesílení. Variace počtu kopií se zdají být vyšší v mozkových buňkách než v jiných typech buněk. Pravděpodobným zdrojem změny počtu kopií je nesprávná oprava poškození DNA .
Genomická duplikace a triplikace genu se jeví jako vzácná příčina Parkinsonovy choroby , i když častější než bodové mutace.
Varianty počtu kopií v genu RCL1 jsou spojeny s řadou neuropsychiatrických fenotypů u dětí.
Genové rodiny a přirozený výběr
Nedávno proběhla diskuse spojující variace počtu kopií s rodinami genů . Genové rodiny jsou definovány jako soubor příbuzných genů, které slouží podobným funkcím, ale mají menší časové nebo prostorové rozdíly a tyto geny pravděpodobně pocházejí z jednoho rodového genu. Hlavním důvodem, proč jsou variace počtu kopií spojeny s genovými rodinami, je to, že existuje možnost, že geny v rodině mohou pocházet z jednoho rodového genu, který byl duplikován do různých kopií. Mutace se v genech hromadí v průběhu času a díky přirozenému výběru působícímu na geny některé mutace vedou k výhodám pro životní prostředí, které umožňují dědičnost těchto genů, a nakonec se oddělí jasné genové rodiny. Příkladem genové rodiny, která mohla být vytvořena v důsledku variací počtu kopií, je genová rodina globinu . Globální genová rodina je propracovaná síť genů sestávající z alfa a beta globinových genů, včetně genů, které jsou exprimovány jak v embryích, tak u dospělých, stejně jako v pseudogenech . Tyto globinové geny v rodině globinů jsou dobře konzervovány a liší se pouze malou částí genu, což naznačuje, že byly odvozeny ze společného rodového genu, pravděpodobně kvůli duplikaci původního genu globinu.
Výzkum ukázal, že variace počtu kopií jsou výrazně častější v genech, které kódují proteiny, které přímo interagují s prostředím, než proteiny, které se podílejí na základních buněčných aktivitách. Bylo navrženo, že účinek dávkování genu doprovázející kolísání počtu kopií může vést k škodlivým účinkům, pokud jsou narušeny základní buněčné funkce, proto jsou proteiny zapojené do buněčných drah podrobeny silné purifikační selekci . Proteiny navíc fungují společně a interagují s proteiny jiných cest, proto je důležité sledovat účinky přirozené selekce na bio-molekulární dráhy spíše než na jednotlivé proteiny. S ohledem na to bylo zjištěno, že proteiny na periferii dráhy jsou obohaceny o variace počtu kopií, zatímco proteiny ve středu drah jsou vyčerpány ve variacích počtu kopií. Bylo vysvětleno, že proteiny na periferii dráhy interagují s menším počtem proteinů, a proto změna dávkování proteinů ovlivněná změnou počtu kopií může mít menší vliv na celkový výsledek buněčné dráhy.
V posledních několika letech se zdá, že vědci přesunuli své zaměření z detekce, lokalizace a sekvenování variací počtu kopií na hloubkové analýzy úlohy těchto variací počtu kopií v lidském genomu a v přírodě obecně. Je zapotřebí důkaz k dalšímu ověření vztahu mezi variacemi počtu kopií a rodinami genů, jakož i roli, kterou při utváření těchto vztahů a změn hraje přirozený výběr. Kromě toho se výzkumníci také snaží objasnit molekulární mechanismy zahrnuté ve změnách počtu kopií, protože to může odhalit základní informace týkající se strukturálních variací obecně. O krok zpět se zdá, že oblast strukturálních variací v lidském genomu je rychle rostoucím výzkumným tématem. Tyto údaje z výzkumu mohou nejen poskytnout další důkazy pro evoluci a přirozený výběr, ale mohou být také použity k vývoji léčby široké škály genetických chorob.
Viz také
- Srovnávací genomika
- Analýza počtu kopií
- Lidský genom
- Inparanoidní
- Molekulární evoluce
- Pseudogeny
- Segmentální duplikace
- Duplikace tandemových exonů
- Virtuální karyotyp
Reference
Další čtení
- Pollack JR, Perou CM, Alizadeh AA, Eisen MB, Pergamenschikov A, Williams CF, Jeffrey SS, Botstein D, Brown PO (září 1999). „Analýza celého genomu změn počtu kopií DNA pomocí mikročipů cDNA“. Přírodní genetika . 23 (1): 41–6. doi : 10,1038/12640 . PMID 10471496 . S2CID 997032 .
- „Obrovské genetické variace u zdravých lidí“ . Nový vědec. 7. srpna 2004.
- Carter NP (září 2004). „Tak normální, jak normální může být?“ . Přírodní genetika . 36 (9): 931–2. doi : 10,1038/ng0904-931 . PMID 15340426 .
- Zkontrolujte E (říjen 2005). „Lidský genom: patchwork lidí“ . Příroda . 437 (7062): 1084–6. Bibcode : 2005Natur.437.1084C . doi : 10,1038/4371084a . PMID 16237414 . S2CID 8211641 .
- „Genové duplikace mohou definovat, kdo jste“ . Nový vědec. 22. listopadu 2006.
- „DNA se liší od člověka k člověku, odhalují genetické mapy“ . Národní geografie. 22. listopadu 2006.
- „Nalezení správných čoček“ (PDF) . Přírodní genetika. 1. července 2007.
- Lam HY, Mu XJ, Stütz AM, Tanzer A, Cayting PD, Snyder M, et al. (Leden 2010). „Analýza strukturálních variant s rozlišením nukleotidů pomocí BreakSeq a knihovny bodů přerušení“ . Přírodní biotechnologie . Přírodní biotechnologie. 28 (1): 47–55. doi : 10,1038/nbt.1600 . PMC 2951730 . PMID 20037582 .
- „Nový výzkum vrhá světlo na genetické příčiny autismu“ . Centrum singularity. 15. června 2010. Archivováno od originálu dne 18. června 2010 . Citováno 15. června 2010 .
externí odkazy
- Kopie projektu změny čísla , Sanger Institute
- Tvrzení: Jednovaječná dvojčata mají identickou DNA
- Integrativní anotační platforma pro variace počtu kopií u lidí
- Bibliografie o variacích počtu kopií
- Databáze genomových variant , databáze strukturálních variant v lidském genomu
- Detekce variací počtu kopií pomocí genotypování SNP s vysokou hustotou
- Oxfordská genová technologie
- Číslo kopie BioDiscovery Nexus
- Mapování variací počtu kopií ve vysokém rozlišení u 2 026 zdravých jedinců
- Projekt 1000 genomů
- cn.FARMS: latentní variabilní model k detekci variací počtu kopií v datech microarray s nízkou mírou falešného zjišťování, balíček R - software
- cn.MOPS: směs Poissonů pro zjištění variací počtu kopií v sekvenčních datech příští generace — software