Atropoizomer - Atropisomer
Atropisomery jsou stereoizomery vznikající v důsledku bráněné rotace kolem jednoduché vazby , kde energetické rozdíly způsobené sterickým kmenem nebo jinými přispěvateli vytvářejí bariéru rotace, která je dostatečně vysoká, aby umožnila izolaci jednotlivých konformerů .
Etymologie a historie
Slovo atropisomer (řec. Άτροπος, atropos , což znamená „bez odbočky“) bylo vytvořeno v aplikaci na teoretický koncept německým biochemikem Richardem Kuhnem pro klíčový objem Stereochemie Karla Freudenberga v roce 1933. Atropisomerismus byl poprvé experimentálně detekován v tetra substituovaném bifenyl , dikyselina , od George Christie a Jamese Kennera v roce 1922. Michinori Ōki dále upřesnil definici atropizomerů s přihlédnutím k teplotní závislosti spojené s interkonverzí konformerů a upřesnil, že atropizomery se interkonvertují s poločasem rozpadu alespoň 1000 sekund při dané teplotě, což odpovídá energetické bariéře 93 kJ mol −1 (22 kcal mol −1 ) při 300 K (27 ° C).
Energetika
Stabilita jednotlivých atropoizomerů je dána odpudivými interakcemi, které inhibují rotaci. Přispívá jak sterický objem, tak v zásadě délka a tuhost vazby spojující dvě podjednotky. Běžně atropoizomerii je studován dynamickou nukleární magnetické rezonance spektroskopie, protože k atropoizomerii je forma fluxionality .Inferences z teorie a výsledky reakce výstupů a výnosy také přispívají.
Atropizomery vykazují axiální chiralitu ( rovinná chiralita ). Když je bariéra pro racemizaci vysoká, jak ilustrují ligandy BINAP , tento jev nabývá praktické hodnoty v asymetrické syntéze. Methaqualone, anxiolytikum a hypnotikum-sedativum, je klasickým příkladem molekuly léčiva, která vykazuje fenomén atropizomerismu.
Stereochemické přiřazení
Určení axiální stereochemie biarylových atropoizomerů lze provést pomocí Newmanovy projekce podél osy bráněné rotace. Ortho , a v některých případech meta substituenty jsou nejprve přiřazena priorita vychází z prioritní pravidla Cahn-Ingold-Prelog . Jedno schéma nomenklatury je založeno na představě helicity definované těmito skupinami. Počínaje substituentem s nejvyšší prioritou v nejbližším kruhu a pohybem po nejkratší cestě k substituentu s nejvyšší prioritou v druhém kruhu je absolutní konfigurace přiřazena P nebo Δ ve směru hodinových ručiček a M nebo Λ proti směru hodinových ručiček. Alternativně mohou být všechny čtyři skupiny seřazeny podle prioritních pravidel Cahn – Ingold – Prelog, přičemž celková priorita je dána skupinám na „předním“ atomu Newmanovy projekce. Tyto dvě konfigurace se nazývají R A a S analogicky k tradičním R / S pro tradiční čtyřboká stereocentru.
Syntéza
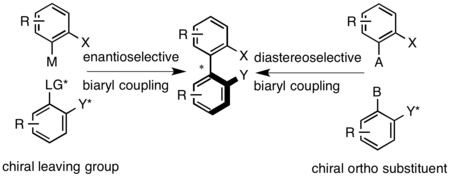
Axiálně chirální biarylové sloučeniny se připravují kopulačními reakcemi, např. Ullmannovou kopulací , Suzuki-Miyaurovou reakcí nebo palladiem katalyzovanou arylací arenů. V návaznosti na syntézu je racemický biaryl štěpen klasickými metodami. Diastereoselektivní vazby lze dosáhnout použitím chirálního můstku, který spojuje dvě arylové skupiny, nebo použitím chirálního pomocného zařízení v jedné z poloh proximálně k axiálnímu můstku. Enantioselektivní kopulace může být dosaženo použitím chirální odstupující skupiny na jednom z biarylů nebo za oxidačních podmínek, které využívají chirální aminy k nastavení axiální konfigurace.
Jednotlivé atropoizomery mohou být izolovány krystalizací racemátů řízenou semeny. Tak, 1,1'-binaftyl krystalizuje z taveniny jako jednotlivé enantiomery.
Rozsah
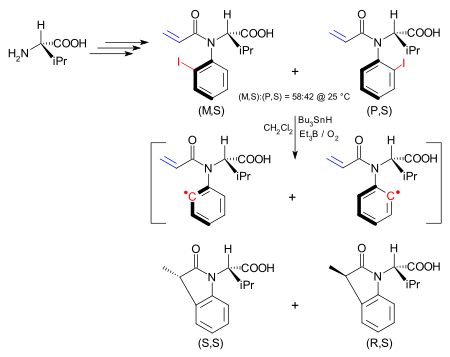
V jedné aplikaci je asymetrie v atropoizomeru přenesena v chemické reakci do nového stereocentra . Atropisomer je jodarylová sloučenina syntetizovaná z (S)- valinu a existuje jako (M, S) izomer a (P, S) izomer. Interkonverzní bariéra mezi nimi je 24,3 kcal / mol (101,7 kJ / mol). (M, S) izomer lze získat výhradně z této směsi rekrystalizací z hexanů . Jód skupina homolytically odstraní za vzniku arylového zbytku pomocí tributylcínhydridu / triethylbór kyslíku směsi / jako v reakci Bartoň-McCombie . Ačkoli je v arylovém radikálu nyní odstraněna bráněná rotace, je intramolekulární reakce s alkenem mnohem rychlejší než rotace vazby uhlík -dusík , takže je zachována stereochemie. Tímto způsobem (M, S) izomer poskytuje (S, S) dihydroindolon .
Nejdůležitější třídou atropizomerů jsou biaryly, jako je kyselina difenová , což je derivát bifenylu s úplnou sadou orto substituentů. Existují také heteroaromatické analogy bifenylových sloučenin, kde dochází k bráněné rotaci kolem vazby uhlík-dusík nebo dusík-dusík. Jiné jsou dimery derivátů naftalenu, jako je 1,1'-bi-2-naftol . Podobným způsobem mohou alifatické kruhové systémy, jako cyklohexany spojené jednoduchou vazbou, vykazovat atropizomerismus za předpokladu, že jsou přítomny objemné substituenty . Ukázalo se, že použití axiálně chirálních biarylových sloučenin, jako je BINAP , QUINAP a BINOL , je užitečné v oblasti asymetrické katalýzy jako chirálních ligandů.
Jejich schopnost poskytovat stereoindukci vedla k použití v kovem katalyzovaných hydrogenačních, epoxidačních, adičních a allylových alkylačních reakcích. Další reakce, které lze katalyzovat použitím chirálních biarylových sloučenin, jsou Grignardova reakce , Ullmannova reakce a Suzukiho reakce . Nedávný příklad v oblasti chirální biarylové asymetrické katalýzy využívá pětičlenný imidazol jako součást atropoizomerního lešení. Tento specifický fosfor, dusík ligand Ukázalo se, že provedení enantioselektivní 3 -Coupling.
Přírodní produkty, design drog
Mnoho atropizomerů se vyskytuje v přírodě a některé mají aplikace pro návrh léčiv. Bylo zjištěno, že přírodní produkt Mastigophorene A pomáhá při růstu nervů. Mezi další příklady přirozeně se vyskytujících atropoizomerů patří vankomycin izolovaný z Actinobacterium a knipholone , který se nachází v kořenech Kniphofia foliosa z čeledi Asphodelaceae . Složitost struktury u vankomycinu je významná, protože se může vázat na peptidy kvůli složitosti její stereochemie, která zahrnuje více stereocenter, dvě chirální roviny v její stereogenní biarylové ose. Knipholone se svou axiální chiralitou vyskytuje v přírodě a bylo prokázáno, že nabízí dobré antimalarické a protinádorové aktivity, zejména ve formě M.
Použití atropoisomerních léčiv poskytuje další způsob, jak mohou mít léčiva stereochemické variace a specificitu v designu. Jedním příkladem je ( -) - N -acetylallocolchinol, lék, který byl objeven na pomoc při léčbě rakoviny chemoterapií.
Telenzepin je atropoizomerní v konformaci svého centrálního thienobenzodiazepinového kruhu. Tyto dva enantiomery byly vyřešeny a bylo zjištěno, že (+)-izomer, který je asi 500krát aktivnější než (-)-izomer na muskarinových receptorech v krysí mozkové kůře. Při navrhování léčiv však ne vždy pomáhá atropizomerismus. V některých případech je výroba léčiv z atropizomerů náročná, protože izomery se mohou mezi sebou převádět rychleji, než se očekávalo. Atropisomery mohou také v těle interagovat odlišně a stejně jako u jiných typů stereoizomerů je důležité před podáním léků pacientům tyto vlastnosti prozkoumat.
Viz také
Reference
Další čtení
- Allen K (14. listopadu 2005). „Atropizomerismus: axiální chiralita v přírodě a syntéza“ (PDF) . Seminář literatury, Stoltz Research Group . Kalifornský technologický institut. Archivováno z originálu (PDF) 3. března 2016.