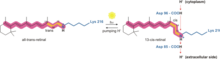
Elektrochemický gradient - Electrochemical gradient
Elektrochemické sklon je sklon z elektrochemického potenciálu , obvykle pro iont , který se může pohybovat přes membránu . Gradient se skládá ze dvou částí, chemického gradientu nebo rozdílu v koncentraci rozpuštěné látky přes membránu a elektrického gradientu nebo rozdílu v náboji přes membránu. V případě nestejných koncentrací iontu přes propustnou membránu se ion bude přes membránu pohybovat z oblasti vyšší koncentrace do oblasti nižší koncentrace jednoduchou difúzí . Ionty také nesou elektrický náboj, který tvoří elektrický potenciál přes membránu. Pokud dojde k nerovnoměrnému rozdělení nábojů přes membránu, pak rozdíl v elektrickém potenciálu generuje sílu, která pohání iontovou difúzi, dokud nejsou náboje vyváženy na obou stranách membrány.
Definice
Elektrochemický gradient je gradient elektrochemického potenciálu:
- , s
- chemický potenciál druhů iontů
- valence iontových druhů
- F, Faradayova konstanta
- místní elektrický potenciál
Přehled
Elektrochemický potenciál je důležitý v elektroanalytické chemii a průmyslových aplikacích, jako jsou baterie a palivové články. Představuje jednu z mnoha zaměnitelných forem potenciální energie, jejichž prostřednictvím lze energii uchovávat .
V biologických procesech je směr pohybu iontu difúzí nebo aktivním transportem přes membránu určen elektrochemickým gradientem. V mitochondriích a chloroplastech se používají protonové gradienty ke generování chemiosmotického potenciálu, který je také známý jako protonová hybná síla . Tato potenciální energie se používá pro syntézu ATP oxidační fosforylací nebo fotofosforylací .
Elektrochemický gradient má dvě složky. Za prvé, elektrická součást je způsobena rozdílem náboje na lipidové membráně. Za druhé, chemická složka je způsobena rozdílnou koncentrací iontů přes membránu. Kombinace těchto dvou faktorů určuje termodynamicky příznivý směr pohybu iontu přes membránu.
Elektrochemický gradient je analogický tlaku vody přes vodní elektrárnu . Transportní proteiny membrány , jako je sodíko-draselné čerpadlo v membráně, jsou ekvivalentní turbínám, které přeměňují potenciální energii vody na jiné formy fyzické nebo chemické energie, a ionty, které procházejí membránou, jsou ekvivalentní vodě, která končí na dně přehrady. Energii lze také použít k čerpání vody do jezera nad přehradou. Podobným způsobem lze chemickou energii v článcích použít k vytvoření elektrochemických gradientů.
Chemie
Termín se obvykle používá v kontextech, ve kterých má probíhat chemická reakce, jako je reakce zahrnující přenos elektronu na bateriovou elektrodu. V baterii elektrochemický potenciál vznikající pohybem iontů vyrovnává reakční energii elektrod. Maximální napětí, které může reakce baterie produkovat, se někdy nazývá standardní elektrochemický potenciál této reakce (viz také Potenciál elektrody a Tabulka standardních potenciálů elektrod ). V případech, které se týkají konkrétně pohybu elektricky nabitých rozpuštěných látek, je potenciál často vyjádřen v jednotkách voltů . Viz: Koncentrační cela .
Biologický kontext
Generování transmembránového elektrického potenciálu pohybem iontů přes buněčnou membránu pohání biologické procesy, jako je vedení nervů , svalová kontrakce , sekrece hormonů a smyslové procesy. Podle konvence má typická živočišná buňka transmembránový elektrický potenciál uvnitř buňky ve srovnání s vnějškem -50 mV až -70 mV.
Elektrochemické gradienty také hrají roli při vytváření protonových gradientů v oxidativní fosforylaci v mitochondriích. Posledním krokem buněčného dýchání je elektronový transportní řetězec . Čtyři komplexy vložené do vnitřní membrány mitochondrií tvoří elektronový transportní řetězec. Protony z matrice do mezimembránového prostoru (IMS) však pumpují pouze komplexy I, III a IV . Celkem je z matice do IMS translokováno deset protonů, které generují elektrochemický potenciál více než 200 mV. To pohání tok protonů zpět do matrice prostřednictvím ATP syntázy, která produkuje ATP přidáním anorganického fosfátu do ADP . Generování protonového elektrochemického gradientu je tedy zásadní pro produkci energie v mitochondriích. Celková rovnice pro elektronový transportní řetězec je:
NADH + 11 H + (matice) + 1/2 O 2 → NAD + + 10 H + (IMS) + H 2 O.
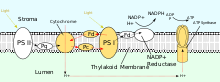
Podobně jako v elektronovém transportním řetězci, reakce závislé na světle fotosyntézy pumpují protony do tylakoidního lumen chloroplastů, aby poháněly syntézu ATP pomocí ATP syntázy. Protonový gradient lze generovat buď necyklickou nebo cyklickou fotofosforylací. Z proteinů, které se účastní necyklické fotofosforylace, fotosystém II (PSII), plastiquinon a komplex cytochromu b 6 f přímo přispívají ke generování protonového gradientu. Pro každý čtyři fotony absorbované PSII je do lumenu pumpováno osm protonů. Celková rovnice pro fotofosforylaci je:
2 NADP + + 6 H + (stroma) + 2 H 2 O → 2 NADPH + 8 H + (lumen) + O 2 .
Několik dalších transportérů a iontových kanálů hraje roli při generování protonového elektrochemického gradientu. Jedním z nich je TPK 3 , draslíkový kanál, který je aktivován Ca 2+ a vede K + z lumenu thylakoidu do stromatu, což pomáhá stanovit gradient pH . Na druhé straně elektro-neutrální K + efluxní antiporter (KEA 3 ) transportuje K + do lumen thylakoidu a H + do stromatu, které pomáhá vytvořit elektrické pole .
Přechody iontů
Protože jsou ionty nabité, nemohou projít membránou jednoduchou difúzí. Dva různé mechanismy mohou transportovat ionty přes membránu: aktivní nebo pasivní transport. Příkladem aktivní transport iontů je Na + -K + -ATPasy (NKA). NKA katalyzuje hydrolýzu ATP na ADP a anorganický fosfát a pro každou molekulu ATP hydrolizované jsou tři Na + transportovány ven a dva K + jsou transportovány uvnitř buňky. Díky tomu je vnitřek buňky negativnější než vnějšek a konkrétněji generuje membránový potenciál V membrány asi -60 mV. Příkladem pasivního transportu jsou iontové toky kanály Na + , K + , Ca 2+ a Cl - . Tyto ionty mají tendenci se pohybovat po koncentračním gradientu. Protože je například mimo buňku vysoká koncentrace Na + , bude Na + proudit kanálem Na + do buňky. Protože je elektrický potenciál uvnitř buňky záporný, příliv kladného iontu depolarizuje membránu, čímž se transmembránový elektrický potenciál blíží nule. Na + však bude i nadále klesat svým koncentračním gradientem, pokud je účinek chemického gradientu větší než účinek elektrického gradientu. Jakmile jsou účinky obou gradientů stejné (pro Na + toto při membránovém potenciálu asi + 70 mV), příliv Na + se zastaví, protože hnací síla (ΔG) je nulová. Rovnice pro hnací sílu je:
V této rovnici R představuje plynovou konstantu , T představuje absolutní teplotu , z je iontový náboj a F představuje Faradayovu konstantu .
Koncentrace buněčných iontů jsou uvedeny v tabulce níže. X- představuje proteiny s čistým záporným nábojem.
| Ion | Savec | Oliheň chobotnice | S. cerevisiae | E-coli | Mořská voda | ||
|---|---|---|---|---|---|---|---|
| Buňka | Krev | Buňka | Krev | ||||
| K + | 100 - 140 | 4-5 | 400 | 10 - 20 | 300 | 30 - 300 | 10 |
| Na + | 5-15 | 145 | 50 | 440 | 30 | 10 | 500 |
| Mg 2+ | 10 0,5 - 0,8 |
1 - 1,5 | 50 | 30 - 100 0,01 - 1 |
50 | ||
| Ca 2+ | 10 -4 | 2,2 - 2,6 1,3 - 1,5 |
10 −4 - 3 × 10 −4 | 10 | 2 | 3 10 −4 |
10 |
| Cl - | 4 | 110 | 40 - 150 | 560 | 10-200 | 500 | |
| X - | 138 | 9 | 300 - 400 | 5-10 | |||
| HCO 3 - | 12 | 29 | |||||
| pH | 7,1 - 7,3 | 7,35 až 7,45 (normální pH arteriální krve)
6,9 - 7,8 (celkový rozsah) |
7,2 - 7,8 | 8.1 - 8.2 | |||
Přechody protonů
Zvláště gradienty protonů jsou v mnoha typech buněk důležité jako forma skladování energie. Gradient se obvykle používá k pohonu ATP syntázy, bičíkové rotace nebo transportu metabolitů . Tato část se zaměří na tři procesy, které pomáhají vytvořit v jejich buňkách protonové gradienty: bakteriorhodopsin a necyklická fotofosforylace a oxidační fosforylace.
Bakteriorhodopsin
Bakteriorhodopsin generuje v Archaea protonový gradient prostřednictvím protonové pumpy . Protonová pumpa se spoléhá na protonové nosiče, které vytlačují protony ze strany membrány s nízkou koncentrací H + na stranu membrány s vysokou koncentrací H + . V bakteriorodopsin je protonové pumpy je aktivován absorpci fotonů 568 nm vlnové délky , což vede k isomerizaci na Schiffovy báze (SB) v sítnice tvořících stav K. Tím se SB vzdálí od Asp85 a Asp212, což způsobí přenos H + z SB do Asp85 za vzniku stavu M1. Protein se poté přesune do stavu M2 oddělením Glu204 od Glu194, který uvolní proton z Glu204 do vnějšího média. SB je reprotonován Asp96, který tvoří stav N. Je důležité, aby druhý proton pocházel z Asp96, protože jeho deprotonovaný stav je nestabilní a rychle reprotonován protonem z cytosolu . Protonace Asp85 a Asp96 způsobující opětovnou izomerizaci SB tvořící stav O. Nakonec se bakteriorhodopsin vrátí do klidového stavu, když Asp85 uvolní svůj proton na Glu204.
Fotofosforylace
PSII také spoléhá na světlo, které řídí tvorbu protonových gradientů v chloroplastech, nicméně PSII k dosažení tohoto cíle využívá vektorovou redoxní chemii. Spíše než k fyzickému transportu protonů přes protein, reakce vyžadující vazbu protonů budou probíhat na extracelulární straně, zatímco reakce vyžadující uvolňování protonů budou probíhat na intracelulární straně. Absorpce fotonů o vlnové délce 680 nm se používá k excitaci dvou elektronů v P 680 na vyšší energetickou úroveň . Tyto elektrony s vyšší energií jsou přeneseny na plastochinon vázaný na protein (PQ A ) a poté na nevázaný plastochinon (PQ B ). To redukuje plastochinon (PQ) na plastochinol (PQH 2 ), který se uvolňuje z PSII po získání dvou protonů ze stromatu. Elektrony v P 680 jsou doplňovány oxidací vody prostřednictvím komplexu vyvíjejícího kyslík (OEC). To má za následek uvolnění O 2 a H + do lumen. Celková reakce je zobrazena:
Poté, co byl propuštěn z PSII, PQH 2 pohybuje na cytochromu b 6 f komplex, který pak přenáší dva elektrony z PQH 2 až plastocyaninového ve dvou oddělených reakcích. Proces, který nastává, je podobný cyklu Q v komplexu III elektronového transportního řetězce. V první reakci se PQH 2 váže na komplex na lumenové straně a jeden elektron je přenesen do centra železo-síra, které jej poté přenese na cytochrom f, který jej následně přenese na plastokyanin. Druhý elektron je přenesen do hemu b L, který jej poté přenese do heme b H, který jej následně přenese do PQ. Ve druhé reakci se druhý PQH 2 oxiduje a přidá elektron k dalšímu plastokyaninu a PQ. Obě reakce společně přenesou do lumenu čtyři protony.
Oxidační fosforylace
V elektronového transportního řetězce komplex I (CI) katalyzuje na snížení o ubichinonu (UQ) na ubichinol (UQH 2 ) převodem dvou elektronů z redukovaného nikotinamid adenin dinukleotid (NADH), který se translokuje čtyři protony z mitochondriální matrix do IMS :
Komplex III (CIII) katalyzuje Q-cyklus . První krok zahrnující přenos dvou elektronů z UQH 2 redukovaného CI na dvě molekuly oxidovaného cytochromu c v místě Q o . Ve druhém kroku další dva elektrony redukují UQ na UQH 2 v místě Q i . Celková reakce je zobrazena:
Komplex IV (CIV) katalyzuje přenos dvou elektronů z cytochromu c redukovaného CIII na polovinu plného kyslíku. Využití jednoho plného kyslíku v oxidační fosforylaci vyžaduje přenos čtyř elektronů. Kyslík pak spotřebuje čtyři protony z matrice za vzniku vody, zatímco další čtyři protony jsou čerpány do IMS. Celková reakce je zobrazena:
Viz také
Reference
- Campbell & Reece (2005). Biologie . Pearson Benjamin Cummings. ISBN 978-0-8053-7146-8.
- Stephen T. Abedon, „Důležitá slova a pojmy z kapitoly 8, Campbell & Reece, 2002 (14. 1. 2005)“, pro biologii 113 na Ohio State University